3,4,6-Tri-O-acetyl-D-glucal
3,4,6-Tri-O-acetyl-D-glucal ist eine chemische Verbindung, die sich von der Glucose ableitet. Es ist als Zwischenprodukt in der organischen Synthese von Bedeutung.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
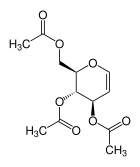 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 3,4,6-Tri-O-acetyl-D-glucal | ||||||||||||||||||
| Andere Namen |
1,2-Didesoxy-3,4,6-tri-O-acetyl-D-arabino-1-hexenopyranose | ||||||||||||||||||
| Summenformel | C12H16O7 | ||||||||||||||||||
| Kurzbeschreibung |
weiße Kristalle oder Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 272,25 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Geschichte
3,4,6-Tri-O-acetyl-D-glucal wurde erstmals 1913 von Emil Fischer synthetisiert. Fischer ging davon aus, dass bei der Reaktion von Acetobromglucose mit Zink in Essigsäure das 2,3,4,6-Tetra-O-acetyl-1,5-anhydro-D-glucitol[3] entstehen müsste. Stattdessen erhielt er dabei die Titel-Verbindung mit einer Ausbeute von 83 %. Außerdem schlug er eine Strukturformel für die Titel-Verbindung vor, welche damals bereits unsicher war und aus heutiger Sicht als falsch angesehen werden kann.[2]

Gewinnung und Darstellung
Eine modernere Synthesevorschrift sieht die Reduktion der Acetobromglucose mit Chrom(II)-Salzen der Edetinsäure in einem biphasischen System aus Wasser und Diethylether vor. Dabei steigt die Oxidationsstufe des Chroms auf drei und das Produkt wird in etwas höheren Ausbeuten erhalten als bei Fischer.[4]
Eigenschaften
3,4,6-Tri-O-acetyl-D-glucal zersetzt sich in kochendem Wasser.[2]
Verwendung
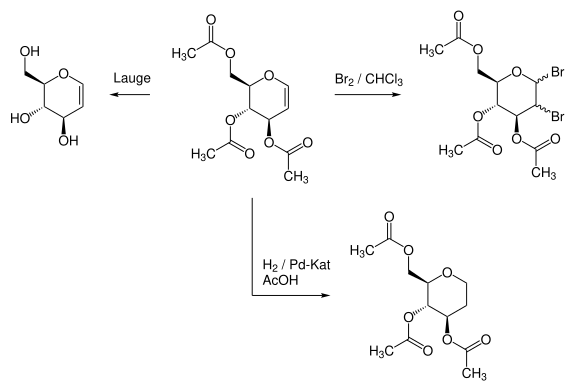
Typische Reaktionen des 3,4,6-Tri-O-acetyl-D-glucals sind die Addition von Brom oder Wasserstoff an die Doppelbindung oder auch die Entschützung der Acetylgruppen durch Alkalien. Welches Diastereomerenverhältnis bei der gebildeten Dibrom-Verbindung vorliegt wurde von Fischer in seiner originalen Veröffentlichung nicht untersucht.[2]
Nachweise
Tollensprobe, Fehling-Probe und Schiffsche Probe sind positiv.[2]
Siehe auch
Einzelnachweise
- Datenblatt Tri-O-acetyl-D-glucal bei Sigma-Aldrich, abgerufen am 12. August 2022 (PDF).
- E. Fischer: Über neue Reduktionsprodukte des Traubenzuckers: Glucal und Hydro-glucal Untersuchungen Über Kohlenhydrate und Fermente II (1908–1919). In: Chemische Berichte. Band 47, Nr. 1, 1922, S. 393–407, doi:10.1002/cber.19140470132.
- Externe Identifikatoren von bzw. Datenbank-Links zu 2,3,4,6-Tetra-O-acetyl-1,5-anhydro-D-glucitol: CAS-Nummer: 13137-69-4, PubChem: 2728909, ChemSpider: 2010876, Wikidata: Q113501109.
- G. Kovács, K. Micskei, L. Somsák: Preparation of acetylated pyranoid glycals from glycosyl halides by chromium (II) complexes under aqueous biphasic conditions. In: Carbohydrate Research. Band 336, Nr. 3, 2001, S. 225–228, doi:10.1016/S0008-6215(01)00254-3.