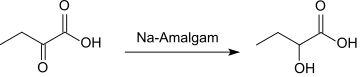2-Oxobutansäure
2-Oxobutansäure ist eine aliphatische Ketocarbonsäure, die sich von der Buttersäure ableitet. Ihr Flammpunkt liegt bei 81 °C.[1] Sie kommt in den Metabolismen zahlreicher Aminosäuren vor und ist ein Abbauprodukt von sowohl Cystathionin als auch von Threonin.[4]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | 2-Oxobutansäure | |||||||||||||||||||||
| Andere Namen |
2-Oxobuttersäure | |||||||||||||||||||||
| Summenformel | C4H6O3 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Kristalle[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 102,09 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,2 g·cm−3 (20 °C)[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| Löslichkeit |
mäßig in Wasser (100 g·l−1 bei 20 °C)[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Darstellung
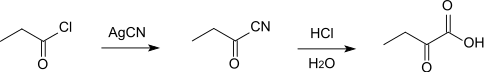
2-Oxobutansäure kann aus Propionylchlorid dargestellt werden, das zunächst mit Silbercyanid in Propionsäurenitril umgewandelt wird. Aus diesem bildet sich dann durch Hydrolyse mit Salzsäure die gewünschte Verbindung.[5]
Eine weitere Synthesemöglichkeit geht von Oxalsäurediethylester aus, der in einer Claisen-Kondensation mit Propionsäureethylester und Natriumethanolat zu Methyloxalessigsäureethylester umgewandelt wird. Beim Kochen mit Schwefelsäure findet zunächst eine Esterspaltung und anschließend eine Decarboxylierung statt, die zum gewünschten Endprodukt führt.[6]
Reaktionen
Bei der Reduktion von 2-Oxobutansäure mit Natriumamalgam entsteht 2-Hydroxybutansäure.[7]
Abgeleitete Verbindungen
Das Natriumsalz der 2-Oxobutansäure ist unter der CAS-Nummer 2013-26-5 registriert und schmilzt bei 210 °C.[8] Es wird als Substrat in der Bestimmung von Lactatdehydrogenase-Isoenzymen eingesetzt.[8]
Der Ethylester kann aus der Säure und Ethanol mit Benzol und p-Toluolsulfonsäure hergestellt werden.[9] Die Synthese des Methylesters wurde mit Methanol unter Zusatz von Chlortrimethylsilan durchgeführt.[10]
Einzelnachweise
- Datenblatt 2-Oxobutansäure bei Merck, abgerufen am 20. Mai 2010.
- David R. Lide: CRC Handbook of Chemistry and Physics A Ready-reference Book of Chemical and Physical Data. CRC Press, 1995, ISBN 978-0-8493-0595-5 (eingeschränkte Vorschau in der Google-Buchsuche).
- Datenblatt 2-Oxobutyric acid, ≥95%, FG bei Sigma-Aldrich, abgerufen am 1. Dezember 2019 (PDF).
- Eintrag zu 2-Ketobutyric acid in der Human Metabolome Database (HMDB), abgerufen am 24. September 2013.
- L. Claisen, E. Moritz: "Ueber Propionylameisensäure" in Berichte der deutschen chemischen Gesellschaft, 1880, 13, S. 2121–2122 (Volltext)
- E. Arnold: "Ueber Methyl- und Aethyloxalessigester" in Justus Liebigs Annalen der Chemie 1888, 246(3), S. 329–338. doi:10.1002/jlac.18882460305
- F. Beilstein: "Handbuch der organischen Chemie", 3. Auflage, 1. Band. Verlag Leopold Voss, 1893. S. 590–591. Volltext
- Datenblatt Sodium 2-oxobutyrate, powder bei Sigma-Aldrich, abgerufen am 1. Dezember 2019 (PDF).
- D. Ferri, T. Bürgi, A. Baiker: "Conformational isomerism of a-Ketoesters. A FTIR and ab initio study" in J. Chem. Soc., Perkin Trans. 2 2000, p. 221–228
- Dissertation "Totalsynthese von Camptothecin", Deshan Liu, Georg-August-Universität Göttingen, 2008, S. 100.