2-Methylfuran
2-Methylfuran ist eine chemische Verbindung aus der Gruppe der Furane und ist isomer zu 3-Methylfuran.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
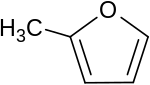 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 2-Methylfuran | |||||||||||||||
| Andere Namen |
Silvan | |||||||||||||||
| Summenformel | C5H6O | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit etherischem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 82,10 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte |
0,91 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
64 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
schwer löslich in Wasser (3 g·l−1 bei 20 °C)[1] | |||||||||||||||
| Brechungsindex |
1,4332 (20 °C, 589 nm)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Vorkommen
2-Methylfuran kommt natürlich in Form als Geruchskomponente von Zigarettenrauch und Schimmelpilzen vor.[3]
Gewinnung und Darstellung
2-Methylfuran kann durch eine Palladium katalysierte Reaktion von Penta-1,3-dien mit Wasserstoffperoxid gewonnen werden.[4]
Industriell wird 2-Methylfuran aus Furfurylalkohol durch katalytische Hydrierung mit einem Kupfer-Katalysator in der Dampfphase hergestellt.[5]
Ein weiteres Verfahren zur Herstellung von 2-Methylfuran ist die elektrokatalytische Hydrogenolyse von Furfural.[6]
Eigenschaften
2-Methylfuran ist ein leicht flüchtige, farblose Flüssigkeit mit etherischem Geruch, die schwer löslich in Wasser ist. Sie zersetzt sich bei starker Erhitzung und besitzt bei 20 °C eine dynamische Viskosität von 4 mPa·s.[1]
Verwendung
2-Methylfuran wurde im Zweiten Weltkrieg als Benzinzusatz mit hoher Oktanzahl verwendet.[7] Außerdem wird es zur Herstellung von 2-Methylthiophen genutzt.[8]
Sicherheitshinweise
Die Dämpfe von 2-Methylfuran bilden mit Luft ein explosionsfähiges Gemisch (Flammpunkt −22 °C).[1]
Einzelnachweise
- Eintrag zu 2-Methylfuran in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- Datenblatt 2-Methylfuran bei Merck, abgerufen am 12. Oktober 2012.
- Wolfgang Legrum: Riechstoffe, zwischen Gestank und Duft. Springer DE, 2011, ISBN 3-8348-1245-5, S. 67 (eingeschränkte Vorschau in der Google-Buchsuche).
- C. W. Jones: Applications of Hydrogen Peroxide and Derivatives. Royal Society of Chemistry, 1999, ISBN 0-85404-536-8, S. 102 (eingeschränkte Vorschau in der Google-Buchsuche).
- Patent US6852868: Catalytic hydrogenation of furfural to produce 2-methylfuran and 2-methyltetrahydrofuran, using a reduced copper based catalyst. Angemeldet am 21. August 2002, veröffentlicht am 8. Februar 2005, Anmelder: Pure Energy Corporation, Erfinder: Irshad Ahmed.
- Peter Nilges, Uwe Schröder: Electrochemistry for biofuel generation: production of furans by electrocatalytic hydrogenation of furfurals. In: Energy & Environmental Science. Band 6, Nr. 10, 20. September 2013, S. 2925–2931, doi:10.1039/C3EE41857J (rsc.org [abgerufen am 30. November 2021]).
- Peter Kurzweil, Paul Scheipers: Chemie: Grundlagen, Aufbauwissen, Anwendungen und Experimente. Springer DE, 2012, ISBN 3-8348-1555-1, S. 274 (eingeschränkte Vorschau in der Google-Buchsuche).
- K. B. Wiberg, H. F. McShane: 2-Chloromethylthiophene In: Organic Syntheses. 29, 1949, S. 31, doi:10.15227/orgsyn.029.0031; Coll. Vol. 3, 1955, S. 197 (PDF).

