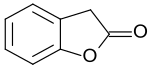
2-Cumaranon
2-Cumaranon ist ein bicyclischer Heteroaromat, in dem ein sechsgliedriger Benzolring mit einem fünfgliedrigen γ-Butyrolacton anelliert ist. Das 2(3H)-Benzofuranon kann auch als Lacton der (2-Hydroxyphenyl)essigsäure[5] aufgefasst werden. Die Benzofuranon-Grundstruktur liegt einigen Naturstoffen – wie dem aus Rosmarinöl isolierbaren Rosmadial[6][7] – auch mit z. T. hoher pharmakologischer Aktivität, wie z. B. Griseofulvin und Rifampicin, zugrunde. 2-Cumaranon ist Ausgangsstoff für Chemilumineszenz- und Fluoreszenz-Farbstoffe, für synthetische pharmazeutische Wirkstoffe, wie z. B. das Antiarrhythmikum Dronedaron und insbesondere für das Fungizid Azoxystrobin.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Cumaranon | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C8H6O2 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 134,13 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser (3,8 g·l−1 bei 30 °C[2]) und in Acetonitril | ||||||||||||||||||
| Brechungsindex |
1,2236 (14 °C, 589 nm)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen und Darstellung
Im Jahr 1884 berichteten Adolf von Baeyer und Paul Fritsch die Synthese von 2-Cumaranon – hier als Lacton der o-Oxyphenylessigsäure bezeichnet – durch Destillation „über freiem Feuer“ der (2-Hydroxyphenyl)essigsäure.[4]

Das Lacton 3H-Benzofuran-2-on wird dabei unter intramolekularer Wasserabspaltung bei hoher Temperatur in verunreinigter Form gebildet.
Auch die Darstellung durch oxidativen intramolekularen Ringschluss aus Phenylessigsäure liefert wegen der Oxidationsempfindlichkeit der Methylengruppe und der Entstehung von mehreren Nebenprodukten 2-Cumaranon nur bescheidene Ausbeuten (< 20 %).[8]

Ozonolyse von 2-Allylphenol[9], das durch Alkylierung von Phenol mit Allylbromid zum Phenylallylether und dessen Claisen-Umlagerung erhalten wird, liefert 2-Hydroxyphenylessigsäure und diese durch Wasserabspaltung 2-Cumaranon. Trotz guter Ausbeuten ist diese Route ökonomisch und sicherheitstechnisch für einen industriellen Prozess ungeeignet.[10]
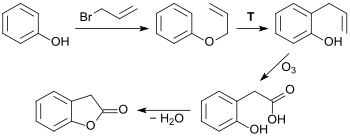
Im industriellen Maßstab werden zunächst die wohlfeilen Ausgangsstoffe Cyclohexanon und Glyoxylsäure in einer säurekatalysierten Aldolkondensation zur (überwiegend) cis-2-Oxocyclohexyliden-essigsäure (A) umgesetzt, die in einem zweiten Schritt unter Wasserabspaltung in das so genannte Enollacton (B) übergeht (90 % Ausbeute). Das Enollacton wird in einem kontinuierlichen Prozess bei 250 °C in der Dampfphase an einem Palladium-Kontakt zum 2-Cumaranon (C) dehydriert (Ausbeute ca. 67 %).[11][12][13]

Ein alternativer Prozess mit Glyoxylsäuremethylester-methylhemiacetal statt Glyoxylsäure als Ausgangsstoff hat sich nicht durchgesetzt.[14]
Eigenschaften
Reines 2-Cumaranon liegt als cremefarbener bis hellgelber Feststoff mit aromatischem Geruch vor.[2] Bei der Reinigung durch Destillation „geht ein farbloses Öl über, welches in der Vorlage zu prachtvollen, durchsichtigen, gut ausgebildeten Krystallen erstarrt“.[15] 3H-Benzofuran-2-on ist in heißem Wasser und Diethylether[4] sowie in Acetonitril löslich.[14] Das Lacton wird in heißem Wasser langsam, in wässrigen Alkalien schnell zur 2-Hydroxyphenylessigsäure bzw. ihrem Alkalisalz hydrolysiert.[4]
Anwendungen
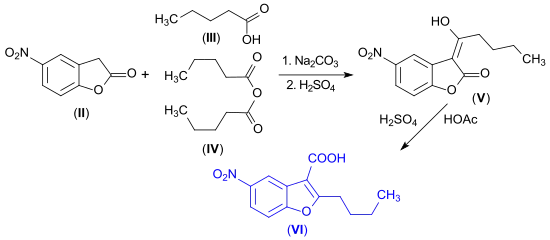
5-Nitro-3H-benzofuran-2-on wird bei der Nitrierung von 2-Cumaranon mit Nitriersäure gebildet.[16][17]

Aus der Nitroverbindung kann durch katalytische Hydrierung an einem Palladium-Kontakt das 5-Amino-3H-benzofuran-2-on erhalten werden.[16]
Lactone wie 2-Cumaranon (I) werden von Nukleophilen leicht unter Ringöffnung gespalten. So reagiert 5-Nitro-3H-benzofuran-2-on mit sekundären Aminen zu 2-Hydroxyphenylessigsäureamiden, aus denen bei Hydrierung die entsprechenden 3-Amino-6-hydroxyphenylethylamine – brauchbare Vorstufen für Haarfarbstoffe – entstehen.[17]

Kondensation des 5-Nitro-3H-benzofuran-2-ons (II) mit einem Gemisch aus Valeriansäure (III) und Valeriansäureanhydrid (IV)[18] liefert das Enollacton (V), das beim Erhitzen umlagert in die substituierte Benzofurancarbonsäure (VI) – eine Schlüsselvorstufe für das Antiarrhythmikum Dronedaron.[19]
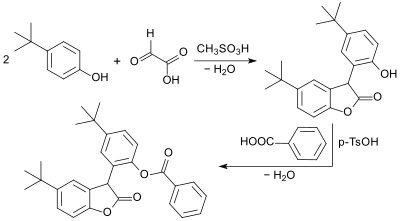
Einer Klasse von Antioxidantien und Radikalfängern – insbesondere zur Stabilisierung von Polypropylen – liegt ebenfalls die Grundstruktur des 2-Cumaranons zugrunde. Bei der Synthese einer Modellverbindung wird Glyoxylsäure mit 2 Mol 4-tert-Butylphenol in Gegenwart von Methansulfonsäure CH3SO3H zu einer phenolischen Zwischenstufe kondensiert und anschließend mit Benzoesäure verestert.[20]
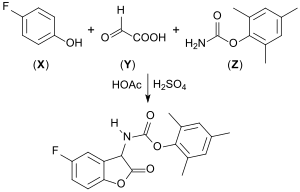
In einer als Eintopfreaktion ausgeführten Tscherniak-Einhorn-Reaktion von 4-Fluorphenol (X), Glyoxylsäure (Y) und Carbamaten, wie z. B. Methylcarbamat[21] oder Carbamidsäuremesitylester (Z), entstehen 2-Cumaranone mit Carbamid-Seitenketten, die mit starken Basen, wie z. B. DBU oder t-BuOK, und in Gegenwart von Sauerstoff ausgeprägte Chemilumineszenz zeigen.[22][23][24]
Volumenmäßig mit Abstand wichtigste Anwendung von 2-Cumaranon ist die als Ausgangsstoff für die Synthese des Fungizids Azoxystrobin[25] (Amistar® der Firma Syngenta) aus der Klasse der Strobilurine.
Einzelnachweise
- Datenblatt 2-Coumaranone bei Alfa Aesar, abgerufen am 15. Juni 2022 (Seite nicht mehr abrufbar).
- Datenblatt 2-Cumaranon bei Sigma-Aldrich, abgerufen am 10. Juni 2022 (PDF).
- Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 183.
- A. Baeyer, P. Fritsch: Ueber die o-Oxyphenylessigsäure und ihre Derivate. In: Chem. Ber. Band 17, Nr. 1, 1884, S. 973–975, doi:10.1002/cber.188401701258.
- Externe Identifikatoren von bzw. Datenbank-Links zu (2-Hydroxyphenyl)essigsäure: CAS-Nummer: 614-75-5, EG-Nummer: 210-393-2, ECHA-InfoCard: 100.009.450, PubChem: 11970, ChemSpider: 11476, Wikidata: Q27103728.
- Externe Identifikatoren von bzw. Datenbank-Links zu (2'S,3R)-7-hydroxy-6-isopropyl-3',3'-dimethyl-2-oxospiro[1-benzofuran-3,1'-cyclohexane]-2',4-dicarbaldehyde: CAS-Nummer: 85514-31-4, PubChem: 15801061, ChemSpider: 2339134, Wikidata: Q104392500.
- N. Nakatani, R. Inatani: A New Diterpene Lactone, Rosmadial, from Rosemary (Rosmarinus officinalis L.). In: Biosci. Biotechnol. Biochem. Band 47, Nr. 2, 1983, S. 353–358, doi:10.1080/00021369.1983.10865620.
- T. Fukagawa, Y. Fujiwara, H. Taniguchi: Palladium-catalyzed intramolecular aromatic nuclear acyloxylation: preparation of 2-coumaranone. In: J. Org. Chem. Band 47, Nr. 12, 1982, S. 2491–2493, doi:10.1021/jo00133a055.
- Externe Identifikatoren von bzw. Datenbank-Links zu 2-allylphenol: CAS-Nummer: 1745-81-9, EG-Nummer: 217-119-0, ECHA-InfoCard: 100.015.563, GESTIS-Stoffdatenbank: 494065, PubChem: 15624, ChemSpider: 14864, DrugBank: DB02534, Wikidata: Q27093513.
- Patent EP1481959A1: Verfahren zur Herstellung von Lactonen und von aromatischen Hydroxycarbonsäuren. Angemeldet am 28. April 2004, veröffentlicht am 1. Dezember 2004, Anmelder: DSM Fine Chemicals Austria Nfg GmbH & CO., KG, Erfinder: W. Jary.
- N. Carmona, P. Gallezot, A. Perrard, L. Carmona, G. Mattioda, J.-C. Vallejos: Synthesis of 2-Coumaranone by Catalytic Dehydrogenation of α-Carboxymethylidene Cyclohexanone, in Catalysis of Organic Reactions, Frank E. Herkes, editor. Marcel Dekker, Inc., New York, NY, U.S.A. 1998, ISBN 0-8247-1929-8, S. 381–390.
- Patent US5616733: Preparation method for 2-coumaranone. Angemeldet am 7. Juni 1995, veröffentlicht am 1. April 1997, Anmelder: Société Française Hoechst, Erfinder: J.-C. Vallejos, A. Perrard, Y. Christidis, P. Gallezot.
- Patent EP0818451A1: Procédé de préparation de l’énollactone de l’acide 2-oxocyclohexylidène acétique et application à la préparation de la 2-coumaranone. Angemeldet am 2. Juli 1997, veröffentlicht am 14. Januar 1998, Anmelder: Clariant Chimie S.A., Erfinder: N. Carmona, L. Carmona, A. Perrard, J.-C. Vallejos.
- Patent EP149838A1: Verfahren zur Herstellung von 2-Coumaron und substituierten 2-Coumaronen. Angemeldet am 9. Mai 2001, veröffentlicht am 25. August 2004, Anmelder: DSM Fine Chemicals Austria Nfg GmbH & CO., KG, Erfinder: M. Stanek, P. Hildebrand, C. Zimmermann, M. Castelijns.
- S. Czaplicki, Stanislaus von Kostanecki, V. Lampe: Versuche zur Synthese des Chromenols und seiner Derivate. In: Chem. Ber. Band 42, Nr. 1, 1909, S. 827–838, doi:10.1002/cber.190904201133.
- Christopher E. Malmberg: Total Synthesis of Clavatadine A Analogs to Produce a Viable Reversible Inhibitor for Factor XIa. (PDF) In: MS Thesis. Central Washington University Central Washington University, 2015, S. 14, abgerufen am 20. Juni 2022.
- Patent US7070630B2: Primary intermediates für oxidative coloration of hair. Angemeldet am 3. Mai 2004, veröffentlicht am 7. April 2006, Anmelder: The Procter & Gamble Co., Erfinder: M.-I. Lim, Y.-G. Pan.
- Externe Identifikatoren von bzw. Datenbank-Links zu Valeric anhydride: CAS-Nummer: 2082-59-9, EG-Nummer: 218-212-9, ECHA-InfoCard: 100.016.557, GESTIS-Stoffdatenbank: 494157, PubChem: 74959, ChemSpider: 1770130, Wikidata: Q72515982.
- Patent EP2508517A1: Process for the preparation of N-alkyl-2(hydroxy-4-benzoyl)-3-benzofurans and its intermediates thereof. Angemeldet am 15. Dezember 2004, veröffentlicht am 10. Oktober 2012, Anmelder: Clariant Specialty Fine Chemicals (France), Erfinder: A. Shoutteeten, F. Bleger, F. Mordacq, J. Piron.
- Patent EP2500341B1: Benzofuranone derivatives and application of the same. Angemeldet am 6. September 2011, veröffentlicht am 26. Juni 2013, Anmelder: Chitec Technology Co., Ltd., Double Bond Chemical Ind., Co., Ltd., FDC, Lees Chemical Industry Co. Ltd., Erfinder: C.-F. Chiu, C.-Y. Su, S. Lee.
- R. Krieg, B. Hoffmann, D. Weiß, C. Biskup: First synthesis of highly chemiluminescent benzo[b]furan-2(3H)-ones bearing a urea substructure. In: Helv. Chim. Acta. Band 102, Nr. 6, 2019, S. e1800243, doi:10.1002/hlca.201800243.
- S. Schramm et al.: Investigations on the synthesis and chemiluminescence of novel 2-coumaranones. In: Arkivoc. Band 3, 2013, S. 174–188 (arkat-usa.org).
- S. Schramm et al.: Investigations on the synthesis and chemiluminescence of novel 2-coumaranones - II. In: Arkivoc. Band 5, 2015, S. 44–59 (arkat-usa.org).
- 2-Coumaranone-1-L. (PDF; 170 kB) In: caymanchem.com. Cayman Chemical Co., abgerufen am 20. Juni 2022 (englisch).
- Patent WO199208703: Process for the preparation of pyrimidine compounds. Angemeldet am 12. November 1991, veröffentlicht am 29. Mai 1992, Anmelder: Imperial Chemical Industries PLC, Erfinder: J.D. Jones, G.A. DeBoos, P. Wilkinson, B.G. Cox, J.M. Fielden.
