2-Chlor-2-methylpropan
2-Chlor-2-methylpropan (tert-Butylchlorid) ist eine farblose, wasserklare Flüssigkeit. Es gehört zur Gruppe der Halogenalkane und ist das einfachste tertiäre Chloralkan.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
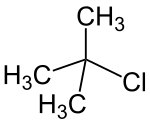 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Chlor-2-methylpropan | ||||||||||||||||||
| Andere Namen |
tert-Butylchlorid | ||||||||||||||||||
| Summenformel | C4H9Cl | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 92,57 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,84 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
51 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
schwer löslich in Wasser (2,9 g·l−1 bei 15 °C)[1] | ||||||||||||||||||
| Brechungsindex |
1,3857 (20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Herstellung
Die Synthese von 2-Chlor-2-methylpropan gelingt in sehr guter Ausbeute durch nucleophile Substitution (Reaktionstyp SN1) von tert-Butylalkohol mit konzentrierter Salzsäure (Lucas-Reaktion). Das Produkt wird durch Trocknen und anschließende Destillation gereinigt.

Als Nebenprodukt dieser Reaktion entsteht durch Abspaltung eines Protons aus dem intermediären Carbeniumion das 2-Methylpropen (Isobuten). Eine technische Herstellung kann als Gasphasenreaktion zwischen Isobuten und Chlorwasserstoff in Gegenwart von Aluminiumoxid bei 100 °C erfolgen.[3]
Eigenschaften
Physikalische Eigenschaften
2-Chlor-2-methylpropan ist eine farblose, leicht bewegliche Flüssigkeit. Es besitzt mit 0,842 g/cm3 eine geringere Dichte als Wasser. Es ist recht leicht flüchtig und siedet bereits bei etwa 51 °C. Mit den meisten organischen Lösungsmitteln ist es in jedem Verhältnis mischbar.
Chemische Eigenschaften
Als tertiäres Halogenalkan reagiert 2-Chlor-2-methylpropan aufgrund der sterischen Hinderung im Vergleich zu anderen Halogenalkanen eher langsam. SN2-Reaktionen sind kaum möglich. Bei der Reaktion mit Basen erfolgt unter Abspaltung eines Protons von einer der Methylgruppen die Eliminierung (E2) zum 2-Methylpropen (Isobuten).
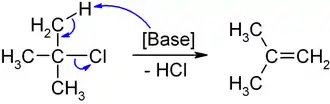
Unter Einwirkung von wasserfreien Lewissäuren, wie z. B. Aluminiumchlorid oder Eisen(III)-chlorid, kommt es unter Abspaltung eines Chlorid-Ions zur Bildung des tert-Butylkations, welches als Elektrophil alkylierend wirken kann.
Mit Wasser reagiert tert. Butylchlorid langsam hydrolytisch in einer nucleophilen Substitution (SN1-Reaktion) unter Bildung von tert. Butanol, Wasserstoffionen und Chloridionen. Diese Reaktion lässt sich über Leitfähigkeitsmessung verfolgen, da die Konzentration der gebildeten Ionen immer mehr zunimmt und im gleichen Maße die Konzentration von tert. Butylchlorid abnimmt. Die Auswertung dieser Messung zeigt, dass hierbei eine Reaktion 1. Ordnung vorliegt.[4]
Sicherheitstechnische Kenngrößen
2-Chlor-2-methylpropan bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei ca. −33 °C.[5] Der Explosionsbereich liegt zwischen 1,8 Vol.‑% als untere Explosionsgrenze (UEG) und 10,1 Vol.‑% als obere Explosionsgrenze (OEG).[1] Die Zündtemperatur beträgt 570 °C.[1] Der Stoff fällt somit in die Temperaturklasse T1.
Verwendung
In der organisch-chemischen Synthese dient 2-Chlor-2-methylpropan zur Einführung einer tert-Butylgruppe in organische Moleküle.[6] So wird die Verbindung als Elektrophil in Friedel-Crafts-Alkylierungen verwendet, um einen tert-Butylrest an einen Aromaten zu binden. Ausgehend von Benzol gelingt unter Katalyse mit wasserfreiem Aluminiumchlorid die Darstellung von tert-Butylbenzol.
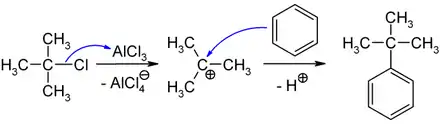
Das dabei zunächst gebildete Tetrachloroaluminat-Ion reagiert mit dem vom Aromaten abgespaltenen Proton zu Chlorwasserstoff unter Rückbildung des Aluminiumchlorids, so dass nur unterstöchiometrische Mengen AlCl3 benötigt werden.
Sicherheitshinweise
Die Substanz kann bei chronischem Kontakt Leber- und Nierenschäden hervorrufen.
Weblinks
- Eintrag zu 2-Chloro-2-methylpropane bei Thermo Fisher Scientific, abgerufen am 13. Oktober 2023.
- Datenblatt 2-Chlor-2-methylpropan bei Merck, abgerufen am 26. Februar 2010.
Einzelnachweise
- Eintrag zu tert-Butylchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-106.
- H. P. A. Groll, G. Hearne, F. F. Rust, W. E. Vaughan: HALOGENATION OF HYDROCARBONS Chlorination of Olefins and Olefin-Paraffin Mixtures at Moderate Temperatures; Induced Substitution, in: Ind. Eng. Chem., 1939, 31 (10), S. 1239–1244; doi:10.1021/ie50358a017.
- Jansen/Ralle/Peper: Reaktionskinetik und chemisches Gleichgewicht, Aulis Verlag, Köln 1984, ISBN 3-7614-0642-8.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen – Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- Eintrag zu Butylchloride. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. März 2018.
