2,4,6-Tri-tert-butylphenol
2,4,6-Tri-tert-butylphenol (2,4,6-TTBP) ist ein mit drei tert-Butylgruppen symmetrisch substituiertes und dadurch stark sterisch gehindertes Phenol. Der hohe Substitutionsgrad macht 2,4,6-TTBP zu einem leicht oxidierbaren elektronenreichen Aromaten und zu einer sehr schwachen Säure. Das durch Oxidation entstehende tiefblaue 2,4,6-Tri-tert-butylphenoxy-Radikal ist mehrere Wochen bei Raumtemperatur stabil.[8]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 2,4,6-Tri-tert-butylphenol | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C18H30O | |||||||||||||||
| Kurzbeschreibung |
kristalliner, gelber Feststoff[1] bzw. schwach gelbes Kristallpulver[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 262,44 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| pKS-Wert |
12,2[5] | |||||||||||||||
| Löslichkeit |
sehr wenig löslich in Wasser (35 μg·cm−3 bei 2 °C)[5] und Alkali, löslich in organischen Lösungsmitteln, wie z. B. Ethanol, Aceton und Tetrachlormethan[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: fortpflanzungsgefährdend (CMR), persistent, bioakkumulativ und toxisch (PBT)[7] | |||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Im Gegensatz zu anderen Alkylphenolen ist die Verbindung im Alkalischen praktisch unlöslich und zeigt auch nicht die charakteristische Färbung von Phenolen mit Eisen(III)-chlorid. 2,4,6-TTBP wird als Antioxidans in industriellen Anwendungen eingesetzt.
Vorkommen und Darstellung
Bereits 1890 erhielt Wilhelm Koenigs bei der Umsetzung von Phenol mit dem verzweigten Alken Isoamylen (Isopenten, 2-Methyl-2-buten) und katalytischen Mengen konzentrierter Schwefelsäure komplexe Stoffgemische unklarer Zusammensetzung – vermutlich aus Phenylalkylethern und Alkylphenolen – und folgerte richtig, dass „auch in diesem Falle scheinbar eine directe Addition eines ungesättigten Kohlenwasserstoffs an eine aromatische Substanz statt[findet]“.[9]
Weitere Arbeiten zeigten, dass bei der elektrophilen aromatischen Substitution von Phenol mit Isobuten (2-Methyl-2-propen) in Gegenwart von Friedel-Crafts-Katalysatoren, wie z. B. Aluminiumchlorid, Bortrifluorid, sauren Ionenaustauschern oder Aluminiumphenolaten[10] Produktgemische entstehen, die neben relativ wenig 2,4,6-TTBP die Monosubstitutionsprodukte 2-tert-Butylphenol (2-TBP) und 4-tert-Butylphenol (4-TBP), sowie die Disubstitutionsprodukte 2,4-Di-tert-butylphenol (2,4-DTBP), 2,6-Di-tert-butylphenol (2,6-DTBP) und 2,5-Di-tert-butylphenol (2,5-DTB) enthalten.
Auch unter milden Reaktionsbedingungen, wie z. B. mit tert-Butanol als Reaktand und der ionischen Flüssigkeit TEBSA-HSO4 (aus 1,4-Butansulton, Triethylamin und Schwefelsäure)[11] als Katalysator und Lösungsmittel – Bedingungen, die als Grüne Chemie klassifiziert werden – fallen Produktgemische an, die in diesem Fall vorwiegend 2,4-DTBP enthalten.[12]
Aus den Produktgemischen können die niedrigsubstituierten Phenolderivate destillativ isoliert werden. Das 2,4,6-TTBP kann von dem nur schwer abtrennbaren Nebenprodukt 2,5-DTBP durch Schmelzkristallisation in sehr hoher Reinheit (> 99,9 %) separiert werden.[13]
2,4,6-Tri-tert-butylphenol fällt auch als (meist unerwünschtes) Nebenprodukt bei der Synthese der in größeren Mengen als Antioxidantien eingesetzten Disubstitutionsprodukte 2,4-DTBP und 2,6-DTBP an.
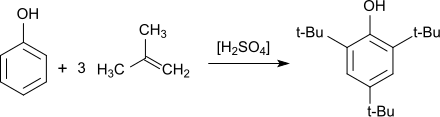
Die gezielte Synthese von 2,4,6-Tri-tert-butylphenol, die sich wegen ihrer Einfachheit – nur flüssige Reaktanden – auch als Praktikumsversuch eignet, geht aus von Phenol, überschüssigem Methyl-tert-butylether (MTBE) als Alkylierungsmittel (über das intermediär gebildete tertiäre Carbeniumion) und Schwefelsäure als Katalysator, wobei 2,4,6-TTBP in 69%iger Ausbeute erhalten wird.[14]
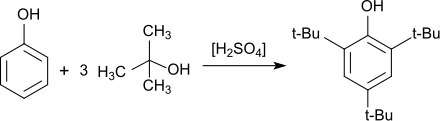
Phenol reagiert bei Temperaturen von 50–60 °C in Gegenwart saurer Katalysatoren, wie z. B. Schwefelsäure oder Aluminiumchlorid und einem Überschuss an gasförmigem Isobuten in Ausbeuten bis 90 % zu 2,4,6-Tri-tert-butylphenol.[4]
Eigenschaften
2,4,6-Tri-tert-butylphenol ist ein gelblicher Feststoff, der sich in vielen organischen Lösungsmitteln löst, nicht jedoch in wässrigen oder alkoholischen Alkalilösungen. Die für Phenole charakteristische grün-blaue Färbung mit Eisen(III)-chlorid tritt bei 2,4,6-TTBP nicht auf. Die Verbindung ist an der Luft oxidierbar, aber praktisch nicht bioabbaubar.[5]
Als elektronenreicher Aromat ist 2,4,6-Tri-tert-butylphenol auch elektrochemisch leicht zu oxidieren.[15] Dabei wird im Alkalischen das gebildete Phenolat-Anion zunächst in einer reversiblen Reaktion zum Phenoxy-Radikal oxidiert. Das stabile Radikal wird durch weiteren Elektronenentzug zum Phenoxonium-Kation oxidiert, das in Wasser zum 2,4,6-Tri-tert-butyl-4-hydroxy-2,5-cyclohexadienon reagiert.
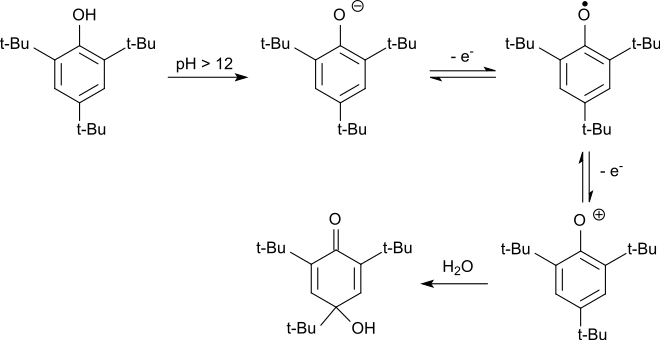
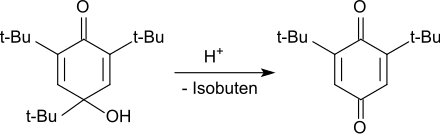
In sauren Medien wird das Hydroxydienon unter Abspaltung der tert-Butylgruppe in 4-Stellung zum 2,6-Di-tert-butylhydrochinon dealkyliert, das zum Endprodukt 2,6-Di-tert-butyl-1,4-benzochinon oxidiert wird.
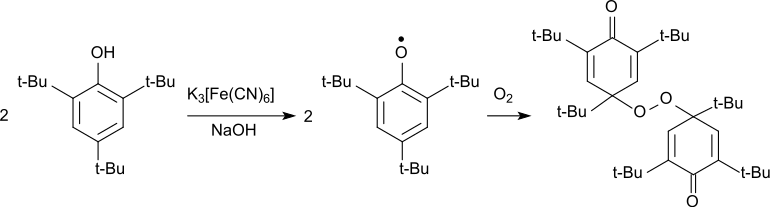
Die Oxidation von 2,4,6-Tri-tert-butylphenol im Alkalischen zum intensiv blau gefärbten Phenoxy-Radikal kann auch mit Kaliumhexacyanidoferrat(III) erfolgen.[14] Das 2,4,6-Tri-tert-butylphenoxy-Radikal bildet bei Abkühlen auf −70 °C blaue Kristalle, die bei Raumtemperatur mehrere Wochen stabil sind und sich nur allmählich gelb färben.[8] Das Phenoxy-Radikal reagiert mit Luftsauerstoff als Diradikal unter Bildung eine 4,4′-verknüpften Peroxids, das gelbe Kristalle bildet.[16]
Anwendungen
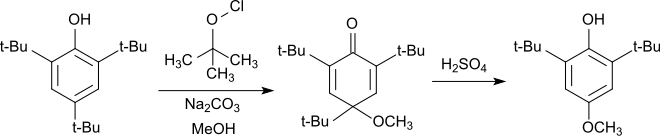
Das elektronenreiche 2,4,6-Tri-tert-butylphenol lässt sich leicht zum Phenoxyradikal oxidieren, das in 4-Stellung Phenole,[17][18] ebenso wie Alkohole und Thiole[19] zu den entsprechenden Cyclohexadienonen addiert. Die in der Literatur auch als Chinolether bezeichneten Cyclohexadienone spalten beim Erhitzen im Sauren die 4-ständige tert-Butylgruppe ab und aromatisieren zum substituierten Phenol.
Die Reaktion kann zur Synthese des als Antioxidans häufig verwendeten 2,6-Di-tert-butyl-4-methoxyphenols eingesetzt werden.
2,4,6-Tri-tert-butylphenol wird wie die anderen mehrfach alkylierten Alkylphenole als Stabilisatoren, Radikalfänger und Antioxidantien in technischen Anwendungen, wie z. B. in Treibstoffen, Hydraulikflüssigkeiten und Schmierölen, ebenso wie in elastomeren und thermoplastischen Kunststoffen eingesetzt. Wegen seiner ausgeprägten Persistenz, seiner hohen Neigung zu Bioakkumulation und aquatischen Toxizität findet 2,4,6-TTBP nur geringe industrielle Verwendung und ist z. B. in Japan verboten.
Das Phenoxyradikal aus 2,4,6-TTBP ist auch als sterisch anspruchsvolle Schutzgruppe in einem Reagens zur Übertragung einer nukleophilen Dimethylaminomethyl-[(CH3)2N-CH2-]gruppe unter Bildung tertiärer Amine beschrieben.[20]
Sicherheitshinweise/Toxikologie
2,4,6-Tri-tert-butylphenol wurde 2017 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von 2,4,6-Tri-tert-butylphenol waren die Besorgnisse bezüglich Umweltexposition sowie der Gefahren ausgehend von einer möglichen Zuordnung zur Gruppe der PBT/vPvB-Stoffe. Die Neubewertung fand ab 2017 statt und wurde von Belgien durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[21][22]
Weblinks
Einzelnachweise
- Datenblatt 2,4,6-Tri-tert-butylphenol bei Sigma-Aldrich, abgerufen am 13. Dezember 2022 (PDF).
- Eintrag zu 2,4,6-Tri-tert-butylphenol bei TCI Europe, abgerufen am 6. Januar 2017.
- William M. Haynes: CRC Handbook of Chemistry and Physics, 94th Edition. CRC Press, Boca Raton, FL, U.S.A. 2015, ISBN 978-1-4665-7114-3, S. 3–518.
- G.H. Stillson, D.W. Sawyer, C.K. Hunt: The hindered phenols. In: J. Am. Chem. Soc. Band 67, Nr. 2, 1945, S. 303–307, doi:10.1021/ja01218a045.
- Screening Assessment for the Challenge, Phenol, 2,4,6-tris(1,1-dimethylethyl)-(2,4,6-tri-tert-butylphenol), CAS Registry Number 732-26-3. (PDF) Environment Canada, Health Canada, November 2008, abgerufen am 11. Januar 2017.
- Eintrag zu 2,4,6-tri-tert-butylphenol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 12. Dezember 2022. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 24. Januar 2024.
- C.D. Cook, D.A. Kuhn, P. Fianu: Oxidation of hindered phenols. IV. Stable phenoxy radicals. In: J. Am. Chem. Soc. Band 78, Nr. 9, 1956, S. 2002–2005, doi:10.1021/ja01590a067.
- W. Koenigs: Ueber Condensationen ungesättigter Kohlenwasserstoffe mit Phenolen. In: Chem. Ber. Band 23, Nr. 2, 1890, S. 3144–3146, doi:10.1002/cber.189002302257.
- Patent US3133974: Phenol alkylation process. Angemeldet am 23. November 1960, veröffentlicht am 19. Mai 1964, Anmelder: Ethyl Corp., Erfinder: R.P. Curry, J.C. Geddes.
- A.R. Hajipour, Y. Ghayeb, N. Sheikhan, A.E. Ruoho: Brønsted acidic ionic liquid as an efficient and reusable catalyst for one-pot synthesis of 1-amidoalkyl 2-naphthols under solvent-free conditions. In: Tetrahedron Lett. Band 50, 2009, S. 5649–5651, doi:10.1016/j.tetlet.2009.07.116.
- P. Elavarasan, K. Kondamundi, S. Upadhyayula: Synthesis of antioxidants: green chemistry route. In: Int. J. Chem. Sci. Band 8, Nr. 5, 2010, S. S578–S584 (academia.edu).
- Patent WO0014043: Purification of alkylated phenols by melt crystallization. Angemeldet am 1. Juli 1999, veröffentlicht am 16. März 2000, Anmelder: General Electric Co., Erfinder: A.J. Mahood.
- B.G. Somers, C.D. Cook: The preparation of 2,4,6-tri-tert-butylphenol. In: J. Chem. Educ. Band 32, Nr. 6, 1955, S. 312, doi:10.1021/ed032p312.
- J.A. Richards, P.E. Whitson, D.H. Evans: Electrochemical oxidation of 2,4,6-tri-tert-butylphenol. In: J. Electroanal. Chem. Band 63, Nr. 3, 1975, S. 311–327, doi:10.1016/s0022-0728(75)80303-2.
- C.D. Cook, R.C. Woodworth: Oxidation of hindered phenols. II. The 2,4,6-Tri-t-butylphenoxy radical. In: J. Am. Chem. Soc. Band 75, Nr. 24, 1953, S. 6242–6244, doi:10.1021/ja01120a040.
- E. Müller, K. Ley, G. Schlechte: Über Sauerstoffradikale, VIII. Über Dehydrierung von Phenolen. In: Chem. Ber. Band 90, Nr. 11, 1957, S. 2660–2672, doi:10.1002/cber.19570901136.
- Patent US3410878: Preparation of quinol ethers. Angemeldet am 1. April 1964, veröffentlicht am 12. November 1968, Anmelder: General Electric Co., Erfinder: H.-D. Becker.
- Patent US3895069: Process for the preparation of 2,4,6-trialkyl-4-alkylthio or 4-alkoxycyclohexadi-2,5-ene-1-ones. Angemeldet am 20. Februar 1973, veröffentlicht am 15. Juli 1975, Anmelder: Imperial Chemical Industries Ltd., Erfinder: J.H. Atkinson, D. Clark.
- D. Seebach, T. Hassel: 2,4,6-Tri-tert-butylphenoxy (TBPO) als sterisch wirksame Carbonylschutzgruppe — Ein neues nucleophiles Dimethylaminomethylierungsmittel. In: Angew. Chem. Band 90, Nr. 4, 1978, S. 296–297, doi:10.1002/ange.19780900422.
- Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): 2,4,6-tri-tert-butylphenol, abgerufen am 26. März 2019.


