2,3-Dihydroxyanthrachinon
2,3-Dihydroxyanthrachinon, auch bekannt als Hystazarin, ist eine organische Verbindung aus der Stoffgruppe der Anthrachinone (genauer der Dihydroxyanthrachinone).
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | 2,3-Dihydroxyanthrachinon | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C14H8O4 | ||||||||||||
| Kurzbeschreibung |
Gelb-braune Nadeln[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 240,21 g·mol−1 | ||||||||||||
| Aggregatzustand |
Fest | ||||||||||||
| Löslichkeit |
| ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Geschichte
2,3-Dihydroxyanthrachinon wurde 1888 von Carl Liebermann entdeckt. Er nannte es Hystazarin.[3]
Vorkommen

Hystazarin kommt als 2-Hydroxy-3-methoxyanthrachinon im indischen Krapp (lat. Rubia cordifolia) vor.[5]
Gewinnung und Darstellung
Das Derivat aus dem indischen Krapp lässt sich durch Erhitzen mit konz. Salzsäure unter Abspaltung von Chlormethyl zu Hystazarin umwandeln.[5]
Werden Brenzcatechin und Phthalsäureanhydrid zusammen mit Schwefelsäure erhitzt, so entsteht neben Alizarin überwiegend Hystazarin.[3] Kondensiert man Brenzcatechin und Phthalsäureanhydrid aber vorher in einer Natrium-Aluminiumchloridschmelze, so lässt sich eine Ketosäure erhalten, welche durch Erhitzen mit Schwefelsäure beinahe reines Hystazarin (90 % Ausbeute) ergibt.[6]
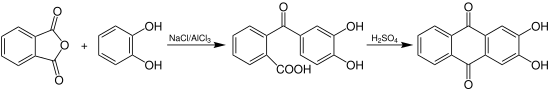
Wird Hystazarindimethylether mit Bromwasserstoffsäure vermischt, so entsteht nach längerem Erhitzen reines Hystazarin unter Abspaltung von Brommethan.[7]
Einzelnachweise
- Eintrag zu Hystazarin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 4. August 2018.
- P. Pfeiffer, Ph. Fischer, J. Kuntner, P. Monti, Z. Pros: Zur Theorie der Farblacke, II. In: Justus Liebigs Annalen der Chemie. 398, 1913, S. 137–196, doi:10.1002/jlac.19133980203.
- Carl Liebermann: Ueber ein neues Dioxyanthrachinon, das Hystazarin, In: Berichte der deutschen chemischen Gesellschaft, Band 21, Nr. 2, July 1888, S. 2501–2502, doi:10.1002/cber.18880210252.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Emil Abderhalden (Hrsg.): Biochemisches Handlexikon: VI. Band Farbstoffe der Pflanzen- und der Tierwelt. Band 4. Springer Berlin Heidelberg, 1911, ISBN 3-642-90816-0, S. 97–98, doi:10.1007/978-3-642-90816-3.
- Hans Waldmann: Synthese des Hystazarins. In: Journal für Praktische Chemie. 150, 1938, S. 99–106, doi:10.1002/prac.19381500403.
- K. Lagodzinski: Ueber 2,3-Dioxyanthracen. In: Justus Liebigs Annalen der Chemie. 342, 1905, S. 90–111, doi:10.1002/jlac.19053420106.