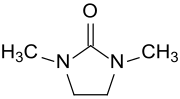
1,3-Dimethyl-2-imidazolidinon
1,3-Dimethyl-2-imidazolidinon (DMEU) ist ein cyclischer Harnstoff mit einem fünfgliedrigen Imidazolidin-Grundgerüst und somit ein Homologes des Dimethylpropylenharnstoffs DMPU. Als hochsiedendes und stark polares aprotisches Lösungsmittel mit hoher chemischer und thermischer Stabilität eignet sich DMEU als Reaktionsmedium für Umsetzungen bei Temperaturen über 180 °C.[7] N,N′-Dimethylethylenharnstoff ist mit praktisch allen organischen Lösungsmitteln mischbar und löst auf Grund seines hohen Dipolmoments und seiner hohen Dielektrizitätskonstante viele organische und anorganische Verbindungen.[8][9] Es ist daher auch ein brauchbarer Ersatz für das carcinogene Lösungsmittel Hexamethylphosphorsäuretriamid HMPT.[10]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 1,3-Dimethyl-2-imidazolidinon | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C5H10N2O | ||||||||||||||||||
| Kurzbeschreibung |
klare, farblose Flüssigkeit[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 114,15 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
vollständig mischbar mit Wasser[5], löslich in Dimethylformamid DMF und Tetrahydrofuran THF[6] | ||||||||||||||||||
| Brechungsindex |
1,4720 (25 °C, 589 nm)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen und Darstellung
1,3-Dimethyl-2-imidazolidinon wird industriell durch Reaktion von Phosgen mit 1,2-Dimethylethylendiamin DMEDA hergestellt.[11]
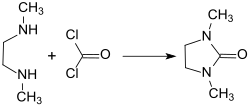
Bei optimierter Prozessführung – pH-Kontrolle (pH 7,3), Steuerung der Temperatur und Zugabe der Reaktanden – kann DMEU in 99,5 % Reinheit und 92,1 % Ausbeute erhalten werden. Unter Vermeidung des toxischen Phosgens ist 1,3-Dimethyl-2-imidazolidinon auch mit Kohlendioxid CO2[8] oder Harnstoff als Quelle für die Carbonylgruppe in guter Ausbeute und hoher Reinheit zugänglich.[7]
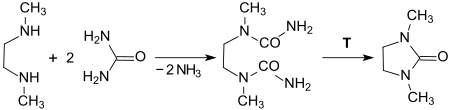
Die thermische Zersetzung des im kontinuierlichen Prozess nicht isolierten Zwischenprodukts Bis-Harnstoff findet in 1,3-Dimethyl-2-imidazolidinon als hochsiedendes Lösungsmittel statt und liefert DMEU in sehr hoher Reinheit (>99,9 %) und sehr guter Ausbeute (98 %). Die Reinheit des erhaltenen DMEU ist stark von der Reinheit des eingesetzten DMEDA abhängig, das oft Nebenprodukte mit sehr ähnlichen Siedepunkten enthält.
In neuerer Zeit wurde 1,2-Dimethyl-2-imidazolidinon als „Senke für das Klimagas CO2“ diskutiert.[12] Überkritisches Kohlenstoffdioxid scCO2 reagiert mit N,N′-Dimethylethylendiamin in Gegenwart von mesoporösen Silikaten vom MCM-41-Typ bei 300 °C und 16 MPa Druck in einem kontinuierlichen Prozess quantitativ zu DMEU.

Die erforderlichen Reaktionsbedingungen erscheinen jedoch für einen „grünen Prozess“ ungeeignet.
Eigenschaften
1,3-Dimethyl-2-imidazolidinon ist eine klare, farblose Flüssigkeit mit charakteristischem scharfem Geruch,[8] die sich mit Wasser und vielen organischen Lösungsmitteln mischt. Die Verbindung ist hygroskopisch und besitzt einen breiten Flüssigkeitsbereich von über 200 °C. Sie ist auch bei erhöhten Temperaturen stabil gegenüber Säuren und Basen. Ihr hohes Dipolmoment (4,05–4,09 D) und ihre große Dielektrizitätskonstante (37,60 F·m−1)[8][13] erleichtern die Solvatisierung von Kationen, wodurch anionische nucleophile Reaktionen beschleunigt werden.
Wegen seiner günstigen Eigenschaften, z. B. geringe Hautreizung und niedrige Toxizität, wurde DMEU als Ersatz für problematische und thermisch instabile Lösungsmittel, wie z. B. Dimethylformamid DMF oder Dimethylsulfoxid DMSO vorgeschlagen. Allerdings wird DMEU in einer Vergleichsstudie unterschiedlichster Lösungsmitteln neben Acetonitril, DMSO und 2-Methyltetrahydrofuran ebenfalls als „problematic“ eingestuft.[14]
Anwendungen
DMEU als Lösungsmittel
Das gegen Säuren und Basen auch bei hohen Temperaturen stabile 1,3-Dimethyl-2-imidazolidinon eignet sich als Lösungsmittel für Alkalien, die im Gemisch mit oberflächenaktiven Stoffen und Alkoholen gute Reinigungsmittel für Metall- und Glasoberflächen sind.
Mit Farbstoffen und Pigmenten bildet DMEU stabile Lösungen bzw. Dispersionen, die Lagerungsstabilität und Anwendungseigenschaften der Zubereitungen verbessern.
Für das Ätzen von Polytetrafluorethylenoberflächen zur besseren Benetzung durch Klebstoffe oder zur Verbindung mit Metalloberflächen eignet sich eine Lösung von Naphthalin-Natrium in 1,3-Dimethyl-2-imidazolidinon.
Wie andere flüssigen Amide, z. B. DMF, NMP oder DMPU, kann DMEU als Abbeizmittel (Stripper), typischerweise mit anderen polaren Lösungsmitteln und Aminen, wie z. B. Diglycolamin HO-(CH2)2-O-(CH2)2-NH2, für Photoresists eingesetzt werden.
1,2-Dimethyl-2-imidazolidinon wird anstelle des toxischen Sulfolans als Extraktionsmittel für das Aromatengemisch BTEX in Erdölraffinerien vorgeschlagen.
DMEU als Reaktionsmedium
Unlängst wurde die Synthese von Essigsäure durch Methanol-Hydrocarboxylierung mit CO2 und Wasserstoff H2 bei 200 °C in 1,3-Dimethyl-2-imidazolidinon als Lösungsmittel mit einem Ruthenium-Rhodium-Katalysatorengemisch, Imidazol als Ligand und Lithiumiodid LiI als Promotor berichtet.[15]
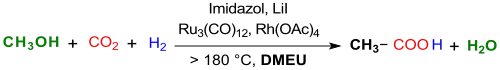
Mit einer TOF von maximal 30,8 h−1, einer TON von 1022 nach fünf Zyklen, einer Essigsäureausbeute von 70 % nach 12 Stunden bei 200 °C und dem Einsatz der teuren Katalysatoren Trirutheniumdodecacarbonyl Ru3(CO)12 und Rhodium(II)-acetat Rh2(OAc)4 erreicht die Effizienz dieses Verfahrens bei weitem noch nicht die des im industriellen Großmaßstab genutzten Cativa-Prozesses für Essigsäure (Carbonylierung von Methanol).
3-Phenoxybenzylalkohol, eine wichtige Vorstufe für die Insektizidklasse der Pyrethroide, kann durch Ullmann-Reaktion von 3-Hydroxybenzylalkohol mit Chlorbenzol in 1,3-Dimethyl-2-imidazolidinon in Gegenwart von Kaliumcarbonat und katalytischen Mengen von 8-Hydroxychinolin und Kupfer(I)-chlorid CuCl in 88 %iger Ausbeute erhalten werden, während unter gleichen Reaktionsbedingungen in DMF nur 21 % und in DMSO 58 % erreicht werden.[16]
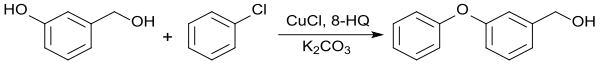
Der Halogenaustausch als nucleophile aromatische Substitutionen an elektronenarmen Aromaten, wie z. B. an 4-Chlorbenzonitril, gelingt mit Kaliumfluorid KF in DMEU bei 290 °C in einem druckfesten Reaktor in 91 %iger Ausbeute zu 4-Fluorbenzonitril.[17]
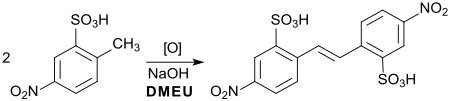
Die bereits 1897[18] beschriebene oxidative Dimerisierung der 2-Methyl-5-nitrobenzolsulfonsäure (Vorstufe für Azofarbstoffe) zur entsprechenden Stilbenverbindung (Vorstufe für den optischen Aufheller 4,4′-Diaminostilben-2,2′-disulfonsäure) lässt sich effizient mit Natriumhydroxid in DMEU durchführen (Ausbeute 90 %).
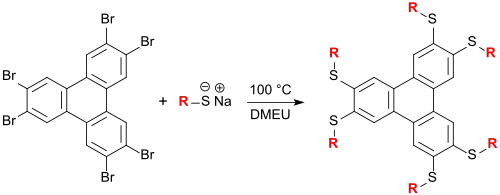
Klaus Praefcke und Mitarbeiter synthetisierten eine große Anzahl flüssigkristalliner Triphenylenderivate auf Thioetherbasis in DMEU als Lösungsmittel, die kolumnare Mesophasen bilden können.[19][20]
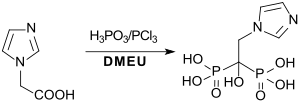
Die hauptsächlich gegen Osteoporose eingesetzten Bisphosphonate Risedronsäure und Zoledronsäure sind in homogener Lösung in 1,3-Dimethyl-2-imidazolidinon in guten Ausbeuten zugänglich.[21]
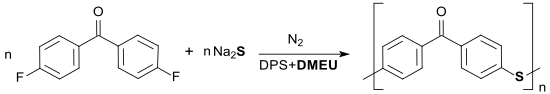
Auch Polykondensationreaktionen können in DMEU bzw. in DMEU-haltigen Lösungsmittelgemischen durchgeführt werden, z. B. die Bildung von hochmolekularem Poly(p-arylensulfid-keton) PPSK bei Temperaturen bis 260 °C. Das Polymer ist nur in konzentrierter Schwefelsäure löslich und auch bei Temperaturen von 300 °C stabil.[22]
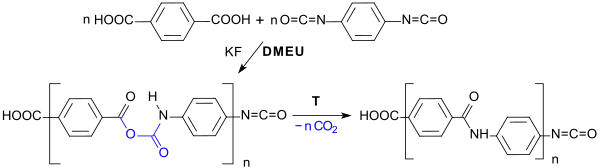
Die Reaktion von aromatischen Dicarbonsäuren, wie z. B. Terephthalsäure mit einem Diisocyanat in DMEU als Lösungsmittel in Gegenwart von Kaliumfluorid[23] oder der Hünig-Base DIPEA[24] führt unter CO2-Abspaltung zu Polyamiden.
Einzelnachweise
- Eintrag zu DIMETHYL IMIDAZOLIDINONE in der CosIng-Datenbank der EU-Kommission, abgerufen am 13. November 2021.
- Datenblatt 1,3-Dimethyl-2-imidazolidinon bei Sigma-Aldrich, abgerufen am 18. August 2019 (PDF).
- Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 78.
- Patent US5594149: Process for producing 1,3-dialkyl-2-imidazolidinone. Angemeldet am 17. April 1996, veröffentlicht am 14. Januar 1997, Anmelder: Mitsui Toatsu Chemical, Inc., Erfinder: H. Naruse, H. Mizuta, S. Umeda, T. Nagata.
- Eintrag zu 1,3-Dimethylimidazolidin-2-on in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Januar 2024. (JavaScript erforderlich)
- Ellen M. Leahy: 1,3-Dimethyl-2-imidazolidinone. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2001, doi:10.1002/047084289X.rd342.
- Patent US5872260: High purity 1,3-dialkylimidazolidinone and preparation process of same. Angemeldet am 21. Juli 1997, veröffentlicht am 16. Februar 1999, Anmelder: Mitsui Chemicals, Inc., Erfinder: H. Mizuta, M. Takaoka, T. Nagata.
- B.J. Barker, J. Rosenfarb, J.A. Caruso: Harnstoffe als Lösungsmittel in der chemischen Industrie. In: Angew. Chem. Band 91, Nr. 7, 1979, S. 560–564, doi:10.1002/ange.19790910707.
- DMITM 1,3-Dimethyl-2-Imidazolidinone. Mitsui Chemicals, Inc., 1. September 2013, abgerufen am 18. August 2018.
- C.-C. Lo, P.-M. Chao: Replacement of carcinogenic HMPA by DMI in insect pheromone synthesis. In: J. Chem. Ecol. Band 16, Nr. 12, 1990, S. 3245–3253, doi:10.1007/BF00982095.
- Patent US4668793: Process for producing 1,3-dimethyl-2-imidazolidinone. Angemeldet am 1. November 1985, veröffentlicht am 26. Mai 1987, Anmelder: Mitsui Toatsu Chemicals, Inc., Erfinder: T. Nagata, N. Kajimoto, M. Wada, H. Nakayama, Y. Yamada.
- T. Seki, Y. Kokubo, S. Ichikawa, T. Suzuki, Y. Kayaki, T. Ikariya: Mesoporous silica-catalysed continuous chemical fixation of CO2 with N,N‘-dimethylethylenediamine in supercritical CO2: the efficient synthesis of 1,3-dimethyl-2-imidazolidinone. In: Chem. Commun. Nr. 3, 2009, S. 349–351, doi:10.1039/B817879H.
- J. Rosenfarb, H.L. Huffman, Jr., J.A. Caruso: Dielectric constants, viscosities, and related physical properties of several substituted liquid ureas at various temperatures. In: J. Chem. Eng. Data. Band 21, Nr. 2, 1976, S. 150–153, doi:10.1021/je60069a034.
- D. Prat, J. Hayler, A. Wells: A survey of solvent selection guides. In: Green Chem. Band 16, Nr. 10, 2014, S. 4546–4551, doi:10.1039/C4GC01149J.
- Q. Qian, J. Zhang, M. Cui, B. Han: Synthesis of acetic acid via methanol hydrocarboxylation with CO2 and H2. In: Nature Commun. Band 1, 2016, S. 11481, doi:10.1037/ncomms11481.
- R. Oi, C. Shimakawa, S. Takenaka: Ullmann ether synthesis in DMI. Preparation of m-phenoxybenzyl alcohol. In: Chem. Lett. Band 17, Nr. 5, 1988, S. 899–900, doi:10.1246/cl.1988.899.
- H. Suzuki, Y. Kimura: Synthesis of 3,4-difluorobenzonitrile and monofluorobenzonitriles by means of halogen exchange fluorination. In: J. Fluor. Chem. Band 52, Nr. 3, 1991, S. 341–351, doi:10.1016/S0022-1139(00)80348-6.
- A.G. Green, A.R. Wahl: Ueber die Oxidation von Paranitrotoluolsulfosäure. In: Ber. dtsch. chem. Ges. Band 30, Nr. 3, 1897, S. 3097–3101, doi:10.1002/cber.189703003128.
- K. Praefcke, A. Eckert, D. Blunk: Core-halogenated, helical-chiral triphenylene-based columnar liquid crystals. In: Liquid Crystals. Band 22, Nr. 2, 1997, S. 113–119, doi:10.1080/026782997209478.
- Patent US4631143: Triphenylene derivates. Angemeldet am 21. Dezember 1984, veröffentlicht am 23. Dezember 1986, Anmelder: Merck Patent GmbH, Erfinder: K. Praefcke, B. Kohne, W. Poules, E. Poetsch.
- Patent WO2008056129A1: Process for the preparation of biphosphonic acids and salts thereof. Angemeldet am 6. November 2007, veröffentlicht am 15. Mai 2008, Anmelder: Hovione Inter Ltd., Erfinder: J. Baptista, Z. Mendes.
- G.-M. Yan, Z.-M. Li, G. Zhang, H.-H. Ren, S.-S. Yuan, Y. Li, J. Yang: High molecular weight poly(p-phenylene sulfide ketone): synthesis and membrane-forming properties. In: J. Polym. Res. Band 23, 2016, S. 61, doi:10.1007/s10965-016-0948-y.
- Patent US5011936: Process for refining 1,3-dimethyl-2-imidazolidinone. Angemeldet am 7. März 1989, veröffentlicht am 30. April 1991, Anmelder: Mitsui Toatsu Chem., Inc., Erfinder: T. Kobayashi, M. Wada, S. Obuchi, H. Takayanagi.
- K.Sasaki, D. Crich: Facile amide bond formation from carboxylic acids and isocyanates. In: Org. Lett. Band 13, Nr. 9, 2011, S. 2256–2259, doi:10.1021/ol200531k.


