1,3-Dichlorpropen
1,3-Dichlorpropen ist eine chemische Verbindung aus der Gruppe der ungesättigten Chlorkohlenwasserstoffe und Alkene.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
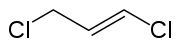 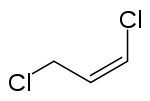 | ||||||||||||||||
| unten: cis-Isomer, oben: trans-Isomer | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 1,3-Dichlorpropen | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C3H4Cl2 | |||||||||||||||
| Kurzbeschreibung |
flüchtige, entzündliche, farblose bis gelbliche Flüssigkeit mit süßlich stechendem, chloroformartigem Geruch[1][2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 110,97 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[2] | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
schlecht in Wasser (1 g·l−1 bei 20 °C)[2] | |||||||||||||||
| Brechungsindex | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
Schweiz: 0,11 ml·m−3 bzw. 0,5 mg·m−3[5] | |||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Isomerie
Die Doppelbindung von 1,3-Dichlorpropen kann (E)- oder (Z)-konfiguriert vorliegen. Ohne besondere Herstellungsmethoden oder Aufreinigungstechnikern liegt 1,3-Dichlorpropen meist in Form einer Gleichgewichtsmischung der isomeren cis- und trans-1,3-Dichlorpropen vor.
| Isomere von 1,3-Dichlorpropen | ||
| Name | (E)-1,3-Dichlorpropen | (Z)-1,3-Dichlorpropen |
| Andere Namen | trans-1,3-Dichlorpropen | cis-1,3-Dichlorpropen |
| Strukturformel |  | |
| CAS-Nummer | 10061-02-6 | 10061-01-5 |
| 542-75-6 (Isomerengemisch) | ||
| EG-Nummer | 626-466-0 | 233-195-8 |
| 208-826-5 (Isomerengemisch) | ||
| ECHA-Infocard | 100.154.864 | 100.030.165 |
| 100.008.024 (Isomerengemisch) | ||
| PubChem | 24726 | 5280970 |
| 24883 (Isomerengemisch) | ||
| Wikidata | Q161507 | Q27109091 |
| Q61854433 (Isomerengemisch) | ||
Geschichte
1,3-Dichlorpropen wurde 1945 als künstliches Bodenbegasungsmittel eingeführt. Ab 1956 wurde es durch Restriktionen bei der Verwendung von Ethylendibromid, Dibromchlorpropen und Methylbromid extensiv eingesetzt.[6]
Gewinnung und Darstellung
1,3-Dichlorpropen entsteht als Nebenprodukt bei der Herstellung von Allylchlorid durch Chlorierung von Propen bei hohen Temperaturen. Alternativ kann es aus 1,3-Dichlorpropanol durch Dehydratisierung mit POCl3 oder mit P4O10 in Benzol gewonnen werden. Das technische Produkt enthält häufig 1,2-Dichlorpropan und 2,3-Dichlorpropen als Verunreinigungen.[6]
Verwendung
1,3-Dichlorpropen wurde hauptsächlich als Pestizid und Nematizid in der Landwirtschaft als Bodenbegasungsmittel und als Desinfektionsmittel (z. B. bei der Containerbegasung) eingesetzt, wobei cis-1,3-Dichlorpropen wirksamer ist. In Deutschland wurde Dichlorpropen häufig im Grundwasser nachgewiesen,[7] wobei der Einsatz in Deutschland seit 2003 vollständig verboten (BGBl. I S. 1533), in Afrika und den USA aber noch üblich (z. B. für Tabak, Mohrrüben, Kartoffeln und Erdbeeren) ist.[8]
Sicherheitshinweise
Die Dämpfe von 1,3-Dichlorpropen können mit Luft ein explosionsfähiges Gemisch (Flammpunkt 27 °C, untere/obere Explosionsgrenze 5,7/14,5 Vol.-%) bilden. Die Verbindung zersetzt sich bei hohen Temperaturen, wobei Chlorwasserstoff entsteht. 1,3-Dichlorpropen ist mit Spezifischer Zielorgan-Toxizität Kategorie 3 (einmalige Exposition) und als giftig beim Verschlucken und bei Hautkontakt eingestuft.[2]
Nachweis
1,3-Dichlorpropen kann nach Adsorption an Aktivkohle mit nachfolgender Desorption durch Headspace-Gaschromatographie nachgewiesen werden.[9]
Weblinks
- Patent DE69502284T2: Drehströmungsreaktor. Angemeldet am 20. Juni 1995, veröffentlicht am 20. August 1998, Anmelder: Shell Internationale Research Maatschappij B.V., Erfinder: Paul Marie Ayoub, Jean Charles Ginestra (Zur Herstellung von Allylchlorid und Dichlorpropen).
- Patent DE2540336: Verfahren zur Abtrennung von 1,3-Dichlorpropen aus Allylchlorid-Destillationssumpfprodukten. Veröffentlicht am 10. September 1975, Anmelder: Dow Chemical Co, Erfinder: John Bruce Ivy, Gordon Grady Willis, Jackson Lake, David Charles Kelsoe.
Einzelnachweise
- Eintrag zu cis-1,3-Dichlorpropen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- Eintrag zu 1,3-Dichlorpropen, Isomerengemisch in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-160.
- Eintrag zu 1,3-dichloropropene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 542-75-6 bzw. 1,3-Dichlorpropen (cis und trans)), abgerufen am 5. Oktober 2019.
- Poisons Information Monograph (PIM) für Dichloropropene, 1,3-, abgerufen am 9. Dezember 2014.
- Häufig nachgewiesene Pestizid-Wirkstoffe und Metabolite (1996–2000) (Memento vom 18. April 2007 im Internet Archive)
- pan-germany.org: Gläserner Pflanzenschutz (PDF; 305 kB)
- BG RCI: Verfahren zur Bestimmung von cis- und trans-1,3-Dichlorpropen, abgerufen am 21. Januar 2023



