β-Sitosterin
β-Sitosterin, auch β-Sitosterol, zählt zur Gruppe der Phytosterine, deren chemische Strukturen Ähnlichkeit mit der von Cholesterin aufweisen. Es ist ein weißer, wachsartiger Stoff.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
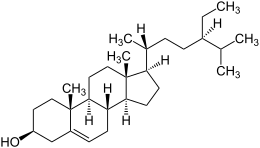 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | β-Sitosterin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C29H50O | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Plättchen[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| Wirkstoffklasse |
Cholesterol-Resorptionshemmer | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 414,69 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Geschichte
Sitosterin wurde zuerst 1897 aus Weizenkeimöl von dem Gründer des Instituts für Medizinische Physiologie in Belgrad, Richard Burian isoliert.[6] Er nannte es nach seiner Herkunft Sitosterin (englisch Sitosterol) (altgriechisch σῖτος, sitos, „Getreide“). Dieses Sitosterin erwies sich nach Arbeiten von Rudolph John Anderson als ein Gemisch mit mindestens fünf Komponenten (α-Sitosterin, β-Sitosterin, γ-Sitosterin, sowie Stigmasterin und Sitostanol). Anderson konnte β-Sitosterin zuerst 1926 aus Maiskeimöl und Weizenkeimöl rein isolieren.[7][8]
Spätere Untersuchungen ergaben, dass Andersons α-Sitosterin ebenfalls ein Gemisch aus drei Komponenten darstellt.[9] In den folgenden Jahren wurde β-Sitosterin dann auch in vielen anderen Pflanzenölen gefunden.[3]
Vorkommen
β-Sitosterin ist im Pflanzenreich weit verbreitet. Anfangs wurde es in Weizenkeimöl, Maiskeimöl, Roggenkeimöl, Baumwollsamenöl, Tallöl, in Sojaöl und Calabarbohnen sowie in Cinchonawachs und -rinde gefunden (daher der Name Cinchol). Es kommt aber unter anderem auch in Pekannüssen, in der Sägepalme (Serenoa repens), in Avocados (Persea americana), Kürbissamen (Cucurbita pepo), Prunus africana (Pygeum africanum), Cashewnüssen, Reiskleie, Sternanis,[10] Sanddorn (Hippophaë rhamnoides) und Bocksdorn- bzw. Gojifrüchten vor.
Phytophage Insekten können kein Cholesterin synthetisieren und decken ihren Bedarf über die Aufnahme von β-Sitosterin oder Campesterin, welche im Insekt dealkyliert werden müssen.[11]
Die höchsten Konzentrationen an β-Sitosterin finden sich in folgenden Pflanzenteilen mit Angabe in parts per million:[12]
- Astrocaryum-vulgare-Samenöl: bis 783.100 ppm
- Opuntia ficus-indica-Samenöl: bis 680.000 ppm
- Kava-Wurzel (Piper methysticum): bis 166.000 ppm
- Mutterkraut-Blattöl (Tanacetum parthenium): bis 16.000 ppm
- Cherimoya-Samen (Annona cherimola MILL.): 10.000–14.000 ppm
- Chinesischer-Bocksdorn-Blüten (Lycium chinense): 10.200 ppm
- Zweigriffliger Weißdorn (Crataegus laevigata (POIR.) DC): 6.500–7.800 ppm in den Blüten; 5.100–6.200 ppm in den Blättern
- Großkelchiger Weißdorn (Crataegus rhipidophylla): 6.500–7.800 ppm in den Blüten; 5.100–6.200 ppm in den Blättern
- Amlabaum-Gewebe (Phyllanthus emblica): bis 5.500 ppm
- Ackerbohnen-Samen (Vicia faba): 950–4.500 ppm
- Sesam-Samen (Sesamum indicum): 4.000–4.430 ppm
- Sonnenblumen-Samen (Helianthus annuus): 3.490–3.510 ppm
- Tamarindenbaum-Früchte (Tamarindus indica): bis 3.350 ppm
- Echter-Schwarzkümmel-Samen (Nigella sativa L.): 3218 ppm
- Gemeine Nachtkerzen-Samen (Oenothera biennis L.): 1186–2528 ppm
- Salbei-Blätter (Salvia officinalis L.): 5–2450 ppm
- Gewürznelken-Früchte (Syzygium aromaticum): bis 2.420 ppm
- Tee-Blätter (Camellia sinensis): 2130–2230 ppm
- Indischer-Wassernabel-Öl (Centella asiatica): 2000 ppm
- Weiße Maulbeere (Morus alba L.): 2000 ppm in den Blättern
- Senna obtusifolia (L.) H.IRWIN & BARNEBY: 1000–2000 ppm in den Samen
- Buchweizen-Samen (Fagopyrum esculentum MOENCH.): 1880 ppm
- Basilikum (Ocimum basilicum L.): Blätter 896–1705 ppm, Blüte 1051 ppm, Wurzel 408 ppm, Sprossen 230 ppm im Stiel des Keimlings
- Mais (Zea mays L.): 1300 ppm in Maisgriffel, in Narbe/Stylus (Maisgriffel)
- Salbei-Stiel (Salvia officinalis L.): 1214 ppm
- Sanddorn-Samen (Hippophae rhamnoides L.): 550–970 ppm
- Sojabohne (Glycine max (L.) MERR.): 900 ppm in den Samen
- Süßholz-Wurzel (Glycyrrhiza glabra L.): 500 ppm in Radix Liquiritiae
- Duftveilchen (Viola odorata L.): 330 ppm in der Pflanze
- Ashwaganda-Wurzel, Schlafbeeren-Wurzel (Withania somnifera (L.) DUNAL): 200 ppm
- Sägepalme-Früchte, Sabalpalme (Serenoa repens (W. BARTRAM) SMALL): 189 ppm
| Quelle | Konzentration in % | typischer Gehalt in % |
|---|---|---|
| Tallöl | 10–20 | 18 |
| Maiskeimöl | 0,5–1,0 | 0,9 |
| Maisfaseröl | 10–20 | 12,5 |
| Kürbissamenöl | 0,2–0,3 | 0,25 |
| Sägepalmenöl | 0,1–0,3 | 0,2 |
| Avocadoöl | 0,4–0,9 | 0,5 |
| Olivenöl | 0,2–0,3 | 0,2 |
| Reiskleieöl | 0,5–0,8 | 0,75 |
Die Auflistung erklärt, weshalb insbesondere eine vegetarische Ernährung reich an Sitosterin sein kann.
Eigenschaften
β-Sitosterin ist chiral. Ein Diastereomer des β-Sitosterins mit (24S)-Konfiguration der Ethylgruppe in der Seitenkette wird als γ-Sitosterin bezeichnet. Der spezifische Drehwert von β-Sitosterin beträgt −37° (c = 2,0 in Chloroform bei 25 °C).[3]
Verwendung
β-Sitosterin wird einigen Margarinesorten in chemisch veränderter Form zugesetzt. Da es in Ölen und Fetten nur eingeschränkt löslich ist (2–3 %) und wegen der Doppelbindung oxidiert werden kann, wird das freie β-Sitosterin hydriert und mit Fettsäuren (üblicherweise dem Fettsäuregemisch aus Rapsöl) verestert. Das Produkt dieser Reaktion wird unter dem Namen Stanolester bis zu 8 % den Streichfetten beigemengt.[13]
Pharmakologische Wirkung
Die tägliche Zufuhr von β-Sitosterin mit der Nahrung beträgt ca. 250–300 mg, wovon im Magen-Darm-Trakt ca. 5 % resorbiert werden.[13]
Wie auch andere Phytosterine verringert β-Sitosterin in höheren Dosen (3–6 Gramm pro Tag)[14] die Resorption von Cholesterin aus dem Magen-Darm-Trakt. Dadurch soll eine Senkung des Blutcholesterinspiegels bewirkt werden.[3][13] Der genaue Wirkmechanismus ist nicht bekannt. β-Sitosterin wird im Rahmen diätetischer Maßnahmen bei Hypercholesterinämie in Form entsprechend angereicherter Lebensmittel (z. B. Margarine, Milchprodukten) verwendet. Eine begleitende arzneiliche Behandlung von erhöhtem Blutcholesterin mit β-Sitosterin, wenn eine fett- und cholesterinarme Diät allein nicht ausreichend ist, hat heute keine Bedeutung mehr.[15]
Überwiegend in Deutschland[16] wird β-Sitosterin als Hauptbestandteil des im Europäischen Arzneibuch monographierten Stoffes „Phytosterol“, zur symptomatischen Behandlung einer beginnenden benignen Prostatahyperplasie (BPH) eingesetzt.[17] Studien zeigten eine Verbesserung der Symptomatik der BPH, das Prostatavolumen hingegen scheint nicht signifikant abzunehmen. β-Sitosterin wirkt schwach antiandrogen über eine Hemmung der Testosteron-5α-Reduktase, wodurch die Umwandlung des Sexualhormons Testosteron in das biologisch wirksame Dihydrotestosteron unterbunden wird.[15] Beschrieben wird auch die Beeinflussung des Prostaglandinstoffwechsels der Prostata durch β-Sitosterin: in vitro wurde eine Unterdrückung der Prostaglandin- und Leukotriensynthese sowie der Arachidonsäurefreisetzung aus Zellmembranen nachgewiesen. Die Gewebe-Biopsie aus dem Prostataadenom zeigte eine Senkung von Prostaglandin-E2 und Prostaglandin-F2α.[14]
Eine kleinere Studie zeigte eine Hemmung der Glatzenbildung bei Männern in Zusammenhang mit Sägepalmenextrakt.[18] In Studien am Weizmann-Institut für Wissenschaften wurde darüber hinaus in Tierversuchen eine Verringerung der Angst von Mäusen bei der Gabe von β-Sitosterin beobachtet. Als pflanzliches Nahrungsergänzungsmittel könne β-Sitosterin daher möglicherweise zur Verringerung von Angstzuständen beim Menschen angewandt werden.[19]
Bei Behandlungen mit Sitosterin ist zu bedenken, dass umfangreiche Untersuchungen zur genetisch bedingten Sitosterolämie vorliegen.[20][21][22] Zum Nachweis der Phytosterine wie z. B. Sitosterin, Campesterin u. a. im Serum steht nach hinreichender Probenvorbereitung die Kopplung der Kapillargaschromatographie mit der Massenspektrometrie zur Verfügung.[23]
Einzelnachweise
- Eintrag zu BETA-SITOSTEROL in der CosIng-Datenbank der EU-Kommission, abgerufen am 16. Februar 2020.
- Eintrag zu β-Sitosterol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.
- The Merck Index. 12th edition Auflage. Merck & Co., Whitehouse Station, New Jersey, USA 1996.
- Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. 58. Auflage. CRC Press, Cleveland, Ohio, USA 1977.
- Datenblatt β-Sitosterol bei Sigma-Aldrich, abgerufen am 7. Februar 2019 (PDF).
- Richard Burián: Über Sitosterin. In: Monatshefte für Chemie. Band 18, Nr. 1, 1. Dezember 1897, S. 551–574, doi:10.1007/BF01518263.
- R. J. Anderson, R. L. Shriner: The Phytosterols of Corn Oil. In: Journal of the American Chemical Society. 48, 1926, S. 2976–2986.
- R. J. Anderson, R. L. Shriner, G. O. Burr: The Phytosterols of Wheat Germ Oil. In: Journal of the American Chemical Society. 48, 1926, S. 2987–2996.
- Everett S. Wallis, E. Fernholz: α-Sitosterol. In: Journal of the American Chemical Society. 58, 1936, S. 2446–2448.
- Jayanta Kumar Patra, Gitishree Das, Sankhadip Bose, Sabyasachi Banerjee, Chethala N. Vishnuprasad, Maria Pilar Rodriguez‐Torres, Han‐Seung Shin: Star anise (Illicium verum): Chemical compounds, antiviral properties, and clinical relevance. In: Phytotherapy Research. Band 34, Nr. 6, Juni 2020, S. 1248–1267, doi:10.1002/ptr.6614.
- Gerald Litwack: Insect Hormones. Gulf Professional Publishing, 2005, ISBN 0-12-709873-9, S. 33 (eingeschränkte Vorschau in der Google-Buchsuche).
- BETA-SITOSTEROL (engl., PDF) In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 17. Juli 2021.
- Laurence Eyres: Phytosterols and Other Functional Lipids in Food. (Memento vom 8. Oktober 2011 im Internet Archive) abgerufen am 25. Juni 2008.
- K. Hardtke u. a. (Hrsg.): Kommentar zum Europäischen Arzneibuch Ph. Eur. 5.0. Phytosterol. Loseblattsammlung, 25. Lieferung, Wissenschaftliche Verlagsgesellschaft Stuttgart 2005.
- T. Dingermann, K. Hiller, G. Schneider, I. Zündorf: Schneider Arzneidrogen. 5. Auflage. Elsevier 2004, ISBN 3-8274-1481-4, S. 238–239.
- E. Mutschler, G. Geisslinger, H. K. Kroemer, P. Ruth, M. Schäfer-Korting: Arzneimittelwirkungen. Lehrbuch der Pharmakologie und Toxikologie. 9. Auflage. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2008, ISBN 978-3-8047-1952-1, S. 710.
- T. Wilt, A. Ishani, R. MacDonald, G. Stark, C. Mulrow, J. Lau: Beta-sitosterols for benign prostatic hyperplasia. In: Cochrane Database Syst Rev. Nr. 2, 2000, S. CD001043, doi:10.1002/14651858.CD001043, PMID 10796740.
- N. Prager, K. Bickett, N. French, G. Marcovici: A randomized, double-blind, placebo-controlled trial to determine the effectiveness of botanically derived inhibitors of 5-alpha-reductase in the treatment of androgenetic alopecia. In: Journal of alternative and complementary medicine. 8, New York 2002, S. 143–152; doi:10.1089/107555302317371433.
- Israeli scientists find natural food supplement that could treat anxiety. The Jerusalem Post, 23. Mai 2021, abgerufen am 26. Mai 2021 (englisch).
- E. G. Yoo: Sitosterolemia: a review and update of pathophysiology, clinical spectrum, diagnosis, and management. In: Ann Pediatr Endocrinol Metab. 21(1), Mar 2016, S. 7–14. PMID 27104173.
- M. D. Shapiro: Rare Genetic Disorders Altering Lipoproteins. In: L. J. De Groot, P. Beck-Peccoz, G. Chrousos, K. Dungan, A. Grossman, J. M. Hershman, C. Koch, R. McLachlan, M. New, R. Rebar, F. Singer, A. Vinik, M. O. Weickert (Hrsg.): Endotext [Internet]. South Dartmouth (MA): MDText.com. Inc.; 2000. PMID 26561704.
- O. Weingärtner, D. Teupser, S. B. Patel: The Atherogenicity of Plant Sterols: The Evidence from Genetics to Clinical Trials. In: J AOAC Int. 98(3), Mai-Jun 2015, S. 742–749, Review. PMID 25942705.
- H. S. Ahmida, P. Bertucci, L. Franzò, R. Massoud, C. Cortese, A. Lala, G. Federici: Simultaneous determination of plasmatic phytosterols and cholesterol precursors using gas chromatography-mass spectrometry (GC-MS) with selective ion monitoring (SIM). In: J Chromatogr B Analyt Technol Biomed Life Sci. 842(1), 14. Sep 2006, S. 43–47. PMID 16807145.