ব্রনস্টেড-লাউরি অম্ল-ক্ষার তত্ত্ব
ব্রনস্টেড-লাউরি তত্ত্ব হলো একটি অম্ল-ক্ষার তত্ত্ব যা ১৯২৩ সালে জোহানেস নিকোলাস ব্রনস্টেড এবং টমাস মার্টিন লাউরি পৃথক পৃথকভাবে প্রকাশ করেন। এ তত্ত্বের মূলকথা হলোঃ যখন অম্ল ক্ষারের সাথে বিক্রিয়া করে তখন একটি প্রোটন (হাইড্রোজেন ক্যাটায়ন বা H+) বিনিময়ের মাধ্যমে অম্ল তার অনুবন্ধী ক্ষার এবং ক্ষার তার অনুবন্ধী অম্ল তৈরি করে। এ তত্ত্বটিকে আরেনিয়াসের তত্ত্বের একটা সাধারণীকরণ বলা চলে।


অম্ল ও ক্ষারের সংজ্ঞা
আরেনিয়াসের তত্ত্বমতে অম্ল হলো সে সকল পদার্থ যারা জলীয় দ্রবণে বিয়োজিত হয়ে H+(হাইড্রোজেন আয়ন) দান করে এবং ক্ষার হলো এমন সব পদার্থ যারা জলীয় দ্রবণে বিয়োজিত হয়ে OH−(হাইড্রক্সাইড আয়ন বা হাইড্রক্সিল) দান করে।[1]
১৯২৩ সালে ভৌত রসায়নবিদ ডেনমার্কের জোহানেস নিকোলাস ব্রনস্টেড এবং ইংল্যান্ডের টমাস মার্টিন লাউরি পৃথক পৃথকভাবে তাদের নামধারী এ তত্ব প্রস্তাব করেন।[2][3][4] ব্রনস্টেড-লাউরি তত্ত্বে অম্ল ও ক্ষারকে সংজ্ঞায়িত করা হয়েছে এদের পারস্পারিক প্রতিক্রিয়ার ভিত্তিতে যা অধিকাংশ ক্ষেত্রেই সত্য। একে সাম্যাবস্থার রাশিমালা দিয়ে প্রকাশ করা হয়ে থাকে:
- অম্ল + ক্ষার
 অনুবন্ধী ক্ষার + অনুবন্ধী অম্ল
অনুবন্ধী ক্ষার + অনুবন্ধী অম্ল
অম্লকে HA ধরে নিলে উক্ত সমীকরণটিকে এভাবে লেখা যায়:
- HA + B
 A−+ HB+
A−+ HB+
এখানে সাম্যাবস্থার চিহ্ন (![]() ) ব্যবহার করা হয়েছে কেননা বিক্রিয়াটি সম্মুখ ও পশ্চাৎ - উভয় দিক থেকেই সংঘটিত হয়। বিক্রিয়াটিতে অম্ল (HA) একটা প্রোটন ত্যাগ করে এর অনুবন্ধী ক্ষার A−তৈরি করতে পারে। একইভাবে ক্ষার (B) একটা প্রোটন গ্রহণ করে এর অনুবন্ধী অম্ল HB+তৈরি করতে পারে। অধিকাংশ অম্ল-ক্ষার বিক্রিয়া এতই দ্রুত সংঘটিত হয় যে, বিক্রিয়ায় উপস্থিত যৌগগুলো একটি গতিময় সাম্যাবস্থার সৃষ্টি করে।[5]
) ব্যবহার করা হয়েছে কেননা বিক্রিয়াটি সম্মুখ ও পশ্চাৎ - উভয় দিক থেকেই সংঘটিত হয়। বিক্রিয়াটিতে অম্ল (HA) একটা প্রোটন ত্যাগ করে এর অনুবন্ধী ক্ষার A−তৈরি করতে পারে। একইভাবে ক্ষার (B) একটা প্রোটন গ্রহণ করে এর অনুবন্ধী অম্ল HB+তৈরি করতে পারে। অধিকাংশ অম্ল-ক্ষার বিক্রিয়া এতই দ্রুত সংঘটিত হয় যে, বিক্রিয়ায় উপস্থিত যৌগগুলো একটি গতিময় সাম্যাবস্থার সৃষ্টি করে।[5]
জলীয় দ্রবণ
নিচের বিক্রিয়াটির কথা চিন্তা করা যাক,
- CH
3COOH + H
2O CH
CH
3COO−
+ H
3O+
অ্যাসিটিক এসিড তথা CH
3COOH হলো একটি অম্ল কারণ এটি পানি (H
2O)-কে একটি প্রোটন (H+) দান করে এবং নিজে অনুবন্ধী ক্ষার তথা অ্যাসিটেট আয়ন (CH
3COO−
)-এ পরিণত হয়। আবার, H
2O একটি ক্ষার কেননা এটি CH
3COOH-এর কাছ থেকে একটি প্রোটন গ্রহণ করে এবং নিজে এর অনুবন্ধী অম্ল তথা হাইড্রোনিয়াম আয়ন (H
3O+
)-এ পরিণত হয়।[6]
অম্ল-ক্ষার বিক্রিয়ার বিপরীতমুখী বিক্রিয়া তথা অনুবন্ধী অম্ল এবং অনুবন্ধী ক্ষারের মধ্যকার বিক্রিয়াটিও একটি অম্ল-ক্ষার বিক্রিয়া। উপরের উদাহরণে, বিপরীতমুখী বিক্রিয়ার ক্ষেত্রে অ্যাসিটেট হলো ক্ষার এবং হাইড্রোনিয়াম হলো অম্ল:
- H
3O+
+ CH
3COO−
 CH
CH
3COOH + H
2O
ব্রনস্টেড-লাউরি তত্ত্বের প্রধান সুবিধা হলো, আরেনিয়াসের তত্ত্বের মতো এ তত্ত্বে জলীয় দ্রবণে অম্লের বিয়োজন জরুরি নয়।
উভমুখী পদার্থ
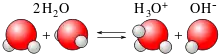
ব্রনস্টেড-লাউরি তত্ত্বের সারকথা হলো, শুধুমাত্র ক্ষারের উপস্থিতিতেই অম্লের অস্তিত্ব থাকে এবং অম্লের উপস্থিতিতেই থাকে ক্ষারের অস্তিত্ব। পানি একটি উভমুখী পদার্থ কেননা এটি অম্ল ও ক্ষার - উভয়ের ন্যায় আচরণ করে। ডান পাশের ছবিতে দেখা যাচ্ছে যে, একটা H2O ক্ষারের মতো আচরণ করে তথা একটা H+গ্রহণ করে H3O+(অনুবন্ধী অম্ল) গঠন করে এবং অপরদিকে একটা H2O অম্লের মতো আচরণ করে তথা H+ত্যাগ করে OH−(অনুবন্ধী ক্ষার) গঠন করে।
অ্যালুমিনিয়াম হাইড্রক্সাইড (Al(OH)3)-এর সাহায্যে আরেকটা উদাহরণ দেয়া যেতে পারে:
- Al(OH)3+ OH−
 Al(OH)4−, অম্লের ন্যায় আচরণ করছে
Al(OH)4−, অম্লের ন্যায় আচরণ করছে - 3H++ Al(OH)3
 3H2O + Al3+(aq), ক্ষারের ন্যায় আচরণ করছে
3H2O + Al3+(aq), ক্ষারের ন্যায় আচরণ করছে
অ-জলীয় দ্রবণ
স্ব-বিয়োজন বিক্রিয়ার দরুন জলীয় দ্রবণে হাইড্রোজেন আয়ন বা হাইড্রোনিয়াম আয়ন একটি ব্রনস্টেড-লাউরি অম্ল এবং হাইড্রক্সাইড আয়ন বা হাইড্রক্সিল আয়ন একটি ক্ষার:
- H2O + H2O
 H3O++ OH−
H3O++ OH−
তরল অ্যামোনিয়াও ঠিক এরকমই একটি বিক্রিয়া দেয়:
- NH3+ NH3
 NH4++ NH2−
NH4++ NH2−
এভাবে তরল অ্যামোনিয়াতে অ্যামোনিয়াম আয়ন (NH4+), পানিতে হাইড্রোনিয়াম আয়নের মতো এবং অ্যামাইড আয়ন (NH2−), হাইড্রক্সাইড আয়নের ন্যায় কাজ করে। অর্থাৎ, অ্যামোনিয়াম লবণ অম্ল এবং অ্যামাইড ক্ষারের ন্যায় আচরণ করে।[7]
কিছু কিছু অ-জলীয় দ্রাবক ক্ষারের ন্যায় কাজ করে যাদের ব্রনস্টেড-লাউরির ভাষায় প্রোটন-গ্রহীতা বলা যেতে পারে:
- HA + S
 A−+ SH+
A−+ SH+
এখানে S দ্বারা কোনো একটি দ্রাবক অণুকে বোঝানো হয়েছে। এ ধরনের কিছু গুরুত্বপূর্ণ দ্রাবক হলো: ডাইমিথাইলসালফক্সাইড (DMSO) এবং অ্যাসিটোনাইট্রাইল (CH3CN)। এ দ্রাবকগুলো জৈব অণুর অম্লের বিয়োজন ধ্রুবক পরিমাপ করতে বহুল ব্যবহৃত হয়। কারণ DMSO H2O-এর চেয়ে বেশি শক্তিশালী প্রোটন-গ্রহীতা। ফলে পানির চেয়ে DMSO দ্রবণে অম্ল অধিক শক্তিশালী হয়।[8] প্রকৃতপক্ষে, এরকম অনেক অণু আছে যারা জলীয় দ্রবণে অম্লের ন্যায় আচরণ করে না কিন্তু অ-জলীয় দ্রবণে অম্লের ন্যায় আচরণ করে। এরকমই একটা চরম ঘটনা কার্বন-এসিডসমূহে ঘটে যেখানে C-H বন্ধন থেকে একটি প্রোটন বের করে আনা হয়।
কিছু অ-জলীয় দ্রাবক অম্লের মতো আচরণ করতে পারে। একটি অম্লীয় দ্রাবক তার মধ্যে দ্রবীভূত পদার্থসমূহের ক্ষারকত্ব বাড়িয়ে দেয়। যেমন, পানিতে অম্লের ন্যায় আচরণ করে বলে CH3C(O)(OH) যৌগটি অ্যাসিটিক এসিড নামে পরিচিত। কিন্তু এটিই আবার অতিরিক্ত অম্লীয় তরল হাইড্রোজেন ক্লোরাইড দ্রাবকে ক্ষারের ন্যায় আচরণ করে।[9]
- HCl + CH3C(O)(OH)
 Cl−+ CH3C(OH)2+
Cl−+ CH3C(OH)2+
লুইস অম্ল-ক্ষার তত্ত্বের সাথে তুলনা
ব্রনস্টেড এবং লাউরি যে সালে তাদের তত্ত্ব প্রকাশ করেন, ঠিক একই সালে জি. এন. লুইস অম্ল-ক্ষার বিক্রিয়ার ক্ষেত্রে একটি বিকল্প তত্ত্ব প্রদান করেন। লুইসের তত্ত্ব ছিল ইলেকট্রনের গঠনের ভিত্তিতে। যে এক জোড়া ইলেকট্রন লুইস অম্লকে দান করতে পারে তাকে লুইস ক্ষার বলা হয় যেখানে লুইস অম্ল হলো এমন একটি যৌগ যা এক জোড়া ইলেকট্রন গ্রহণ করতে পারে।[10][11] লুইসের এ প্রস্তাব ইলেকট্রনের গঠনের ক্ষেত্রে ব্রনস্টেড-লাউরির শ্রেণিবিভাগের একটা সুস্পষ্ট ব্যাখ্যা দাঁড় করায়।
- A-H + B:
 A:−+ B-H+
A:−+ B-H+
উপরের বিক্রিয়াতে ক্ষার (B) ও অনুবন্ধী ক্ষার (A−) - উভয়ই মুক্তজোড় ইলেকট্রন বহন করছে এবং এদের মাঝে একটা প্রোটন বিনিময় হয়েছে যা একটি লুইস অম্ল।

লুইস পরবর্তীকালে লিখেছিলেন:
To restrict the group of acids to those substances that contain hydrogen interferes as seriously with the systematic understanding of chemistry as would the restriction of the term oxidizing agent to substances containing oxygen.[11]
লুইস তত্ত্বে, একটি অম্ল (A) এবং একটি ক্ষার (B) সংযোজিত হয় (AB) যেখানে ইলেকট্রন জোড় A এবং B এর মাঝে একটা ডাইপোলার বন্ধন গঠন করে। এর দৃষ্টান্তস্বরূপ অ্যামোনিয়া ও বোরন ট্রাইফ্লুরাইড থেকে H3N-BF3গঠনের কথা বলা যায়, যে বিক্রিয়া জলীয় দ্রবণে ঘটতে পারে না কারণ বোরন ট্রাইফ্লুরাইড পানির সাথে তীব্রভাবে হাইড্রোলাইসিস বিক্রিয়া ঘটায়।
- BF3+ 3H2O → B(OH)3+ 3HF
- HF
 H++ F−
H++ F−
এই বিক্রিয়াগুলো এটা পরিষ্কার করে যে, লুইস এবং ব্রনস্টেড-লাউরি শ্রেণিবিভাগ - উভয় ক্ষেত্রেই BF3একটি অম্ল এবং এই দুই তত্ত্বের মধ্যে এক ধরনের সামঞ্জস্য বিধান করে।
নিম্নের বিক্রিয়ার দ্বারা বোরিক এসিডকে লুইস অম্ল বলা যায়:
- B(OH)3+ H2O
 B(OH)4−+ H+
B(OH)4−+ H+
এক্ষেত্রে অম্ল বিয়োজিত হয় নি বরং ক্ষার (H2O)-ই বিয়োজিত হয়েছে। কাজেই যেহেতু বিক্রিয়ার পরে হাইড্রোজেন আয়ন মুক্ত হয়েছে, তাই B(OH)3দ্রবণটি হবে অম্লীয়।
লঘু অ্যামোনিয়া দ্রবণে যে নগণ্য পরিমাণে অ্যামোনিয়াম আয়ন বিদ্যমান থাকে সে ব্যাপারে অনেক শক্তিশালী প্রমাণাদি রয়েছে:
- H2O + NH3≠ OH−+ NH4+
আর তাই অ্যামোনিয়া যখন পানিতে দ্রবীভূত হয়, তখন এটি লুইস ক্ষারের মতো আচরণ করে।
লাক্স-ফ্লুড তত্ত্বের সাথে তুলনা
ব্রনস্টেড-লাউরি তত্ত্ব দ্বারা অ-জলীয় মাধ্যমে কতিপয় অক্সাইডসমূহের বিক্রিয়ার ব্যাখ্যা দেয়া সম্ভব হয়নি। যেমন, নিচের বিক্রিয়াটির কথা ধরা যাক:
- 2MgO + SiO2→ Mg2SiO4
উপরের বিক্রিয়াটি ব্রনস্টেড-লাউরির অম্ল-ক্ষারের সংজ্ঞার মধ্যে পড়ে না। বরং ব্রনস্টেড-লাউরি হিসেবে, পানির উপস্থিতিতে MgO হলো ক্ষারীয় এবং SiO2হলো অম্লীয়।
- 2H++ MgO(s) → Mg2+(aq) + 2H2O
- SiO2(s) + 2H2O → SiO44−+ 4H+(≡ Si(OH)4(aq))
লাক্স-ফ্লুড তত্ত্ব ম্যাগনেসিয়াম অক্সাইডকে অ-জলীয় মাধ্যমেও ক্ষার হিসেবেই শ্রেণিভুক্ত করে। এ ধরনের শ্রেণিভুক্তকরণ ভূ-রসায়নের ক্ষেত্রে গুরুত্বপূর্ণ। বিভিন্ন প্রকার খনিজ যেমন, অলিভিন (Mg,Fe)SiO4কে আল্ট্রামাফিক (সামান্য সিলিকাযুক্ত একপ্রকার আগ্নেয়শিলা) হিসেবে চিহ্নিত করা হয়। অলিভিন খুবই সাধারণ একটি অক্সাইড, MgO নিয়ে গঠিত। তবে এর সাথে কিছু অম্লীয় অক্সাইড যেমন, সিলিকা (SiO2)-ও থাকে।
তথ্যসূত্র
- Myers, Richard (২০০৩)। The Basics of Chemistry। Greenwood Publishing Group। পৃষ্ঠা ১৫৭–১৬১। আইএসবিএন 978-0-313-31664-7।
- Masterton, William; Hurley, Cecile; Neth, Edward (২০১১)। Chemistry: Principles and Reactions। Cengage Learning। পৃষ্ঠা 433। আইএসবিএন 1-133-38694-6।
- Ebbing, Darrell; Gammon, Steven D. (২০১০)। General Chemistry, Enhanced Edition। Cengage Learning। পৃষ্ঠা ৬৪৪–৬৪৫। আইএসবিএন 0-538-49752-1।
- Whitten, Kenneth; Davis, Raymond; Peck, Larry; Stanley, George (২০১৩)। Chemistry। Cengage Learning। পৃষ্ঠা 350। আইএসবিএন 1-133-61066-8।
- Lew, Kristi (২০০৯)। Acids and Bases। Infobase Publishing,। আইএসবিএন 9780791097830।
- Patrick, Graham (২০১২)। Instant Notes in Organic Chemistry। Taylor & Francis। পৃষ্ঠা 76। আইএসবিএন 978-1-135-32125-3।
- Holliday, A.K.; Massy, A.G. (১৯৬৫)। Inorganic Chemistry in Non-Aqueous Solvents। Pergamon Press।
- "Bordwell pKa Table (Acidity in DMSO)"। ২০০৮-১০-০৯ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ২০০৮-১১-০২।
- Waddington, T.C. (১৯৬৫)। Non-Aqueous Solvent Systems। New York: Academic Press।
- Miessler, G. L., Tarr, D. A., (১৯৯১) "Inorganic Chemistry" ২য় সংস্করণ, Pearson Prentice-Hall পাতা ১৭০–১৭২
- Hall, Norris F. (মার্চ ১৯৪০)। "Systems of Acids and Bases"। Journal of Chemical Education। ১৭ (3): ১২৪–১২৮। ডিওআই:10.1021/ed017p124। বিবকোড:1940JChEd..17..124H।