Окисланыу дәрәжәһе
Окисланыу дәрәжәһе (әсетмә һаны) — окисланыу һәм окисланыу-ҡайтарылыу реакциялары процестарын яҙыу өсөн ярҙамсы шартлы дәүмәл. Ул молекуланың айырым атомының окисланыу торошон һәм электрондарҙың күсеүен иҫәпләүҙең уңайлы ысулын күрһәтә: был ысул молекулалағы атомдың ысын заряды түгел.
| Окисланыу дәрәжәһе | |
 | |
| Үлсәме | |
|---|---|
| Дәүмәл символы (LaTeX) | |
Элементтарҙың окисланыу дәрәжәһе тураһындағы күҙаллауҙар химик матдәләрҙе классификациялағанда, уларҙың үҙсәнлектәрен тасуирлағанда, берләшмәләрҙең формулаларын һәм уларҙың халыҡ-ара исемдәрен (номенклатуралар) төҙөгәндә нигеҙгә һалына һәм файҙаланыла. Ул окисланыу-ҡайтарылыу реакцияларын өйрәнгәндә айырыуса киң ҡулланыла.
Окисланыу дәрәжәһе төшөнсәһе йыш ҡына валентлыҡ төшөнсәһе урынына органик булмаған химияла ҡулланыла.
Билдәләмә
Атомдың окисланыу дәрәжәһе атомдарҙың электр зарядының һан дәүмәленә тигеҙ. Бәйләнеште барлыҡҡа килтергән электрон парҙар тулыһынса электр тиҫкәрелек бәләкәй булған атомдар яғына күсә (йәғни берләшмәләр иондарҙан ғына тора тигән фараздан сығып). Бер төрлө атомдар араһында ковалент бәйләнеш булған осраҡта электрондарҙы атомдар араһында тигеҙ бүләләр.
Окисланыу дәрәжәһе ыңғай ионға ҡушылып, нейтраль атомға тиклем ҡайтарылырға йәки, уны нейтраль атомға тиклем окислау өсөн кире иондан тартып алырға кәрәк булған электрондар һанына тап килә:
Тасуирлама
Фәнни әҙәбиәттә элементтың окисланыу дәрәжәһен билдәләү өсөн Шток ысулы ҡулланыла.[1] Окисланыу кимәле рим һандары менән атамаһынан йәки элемент символынан һуң түңәрәк йәйәләрҙә күрһәтелә, өҫтәүенә асыусы йәйә алдына буш урын ҡуйылмай: тимер (III), Ni(II).
Окисланыу кимәле шулай уҡ өҫтән элемент символы өҫтөндәге ғәрәп һандары менән билдәләнеүе мөмкин:Ион зарядын күрһәтеүҙән айырмалы рәүештә, окисланыу дәрәжәһе күрһәтелгәндә беренсе билдә ҡуйыла, ә һуңынан һан мәғәнәһе[2] (структурала һәр ваҡыт тиерлек атом/ион заряды күрһәтелә), ә текста — окисланыу дәрәжәһе +2, +3.;формулаларҙа окисланыу дәрәжәһен элемент өҫтөндә яҙыла (алда — беренсе урында), иондар өсөн заряд (ҡатмарлы иондарҙа һәр элемент өсөн түгел!) — юғары индекс менән яҙыла — иондан һуң өҫтән уңда (һандың артындағы билдә):
— окисланыу дәрәжәлре
— зарядтар.
Окисланыу дәрәжәһе (валентлыҡтан айырмалы рәүештә) нуль, кире һәм ыңғай мәғәнәле булыуы мөмкин, улар ғәҙәттә элементтың символы өҫтөнә өҫ яҡлап ҡуйыла:
Окисланыу дәрәжәһен иҫәпләп сығарыу ҡағиҙәләре:
- Төрлө элемент атомының ирекле (ябай матдә) хәлдә окисланыу дәрәжәһе нулгә тигеҙ, мәҫәлән, молекулаларҙағы атомдарҙың окисланыу дәрәжәһе нуль кимәлендә
- Теләһә ниндәй бер атомлы ябай иондың окисланыу дәрәжәһе уның зарядына тап килә. мәҫәлән: Na+ = +1, Ca2+ = +2, Cl− = −1.
- Водородтың ниндәй ҙә булһа ионһыҙ берләшмәһендә окисланыу дәрәжәһе 1-гә тигеҙ. Был ҡағиҙә күпселек водород берләшмәләренә ҡарата ҡулланыла.шундай уҡ H2O, NH3 или CH4.(Электр тиҫкәрелек аша билдәләү ҡайһы бер матдәләргә сикләү бирә:). Ионлы металл гидридтары өсөн, мәҫәлән, NaH, водородтың окисланыу дәрәжәһе −1
- Кислород ябай ковалент барлыҡҡа килтермәгән O—O бәйләнештә уның окисланыу дәрәжәһе берләшмәләрҙә −2 , йәғни күпселек — оксидтарҙа. Мәҫәлән, кислородтың окисланыу дәрәжәһе H2O, H2SO4, NO, CO2 һәм CH3OH −2 тигеҙ, ләкин водород пероксидтарында H2O2 (HO—OH) −1 тигеҙ (башҡа бер сикләнгән ҡағиҙәгә ярашлы, кислород −2 окисланыу дәрәжәһенә эйә шулай уҡ ирекле радикалдар мәҫәлән, ).
- Водород һәм кислород инмәгән металл булмаған берләшмәләрҙең электр тиҫкәрелеге металл булмаған кире зарядлы тип һанала. Бындай металл булмағандарҙың окисланыу дәрәжәһе уның киң таралған кире ионының зарядына тигеҙ ҡарала. Мәҫәлән, CCl4 хлорҙың окисланыу дәрәжәһе −1, углеродтың +4. SF6 фторҙың окисланыу дәрәжәһе −1,.Был, мәҫәлән, CH4 водород окисланыу дәрәжәһенә +1,, көкөрттөң +6, ләкин CS2 көкөрт −2 окисланыу дәрәжәһ, ә углеродтың окисланыу дәрәжәһе +4.
- Нейтрал берләшмә формулаһында бөтә атомдарҙың окисланыу дәрәжәһе алгебраик суммаһы һәр ваҡыт нулгә тигеҙ :
- Комплекслы ионда (катионда йәки анионда) бөтә атомдар дәрәжәһенең алгебраик суммаһы уның дөйөм зарядына тигеҙ булырға тейеш (шулай уҡ ҡара: юғары 2-се пункт). Шулай итеп, NH4 ионында окисланыу дәрәжәһе −3 һәм шуға күрә −3+4=+1 булырға тейеш. SO4 ионында дүрт кислород атомының окисланыу дәрәжәһе суммаһы −8, көкөрттөң окисланыу дәрәжәһе +6 булырға тейеш, сөнки иондың дөйөм заряды −2.
- Химик реакцияларҙа бөтә атомдарҙың окисланыу дәрәжәһенең алгебраик суммаһын һаҡлау ҡағиҙәһе үтәлергә тейеш. Нәҡ ошо ҡағиҙә хәҙерге химияла окисланыу дәрәжәһе төшөнсәһен мөһим итә. Әгәр химик реакция барышында атомдың окисланыу дәрәжәһе күтәрелһә, ул окислана, тиҙәр, атомдың окисланыу дәрәжәһе кәмеһә, кире ҡайтарыла, тиҙәр. Химик реакцияның тулы тигеҙләмәһендә окисланыу һәм ҡайтарылыу процестары бер-береһен компенсацияларға тейеш.
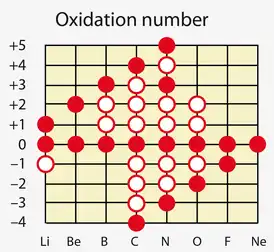
- Элмент окисланыуының максималь ыңғай дәрәжәһе ғәҙәттә һан яғынан уның төркөмөнөң периодик системалағы номеры (графиканың классик ҡыҫҡа варианты) менән тап килә. Элементтың иң юғары кире окисланыу дәрәжәһе −8-гә тигеҙ (мәҫәлән, халькоген S өсөн, иң юғары кире окисланыу дәрәжәһе 6 − 8 = −2). Фтор, кислород, затлы газдар (ксенондан башҡа), шулай уҡ тимер, кобальт, родий һәм никель төркөмсәләре элементтары иҫәпкә алынмай: уларҙың иң юғары окисланыу дәрәжәһе улар ҡараған төркөмдөң һанынан түбәнерәк булған һан менән сағылдырыла.
Иридий иң юғары окисланыу дәрәжәһе +9 эйә[3]. Баҡыр төркөмсәһе элементтарында,, улар I төркөмгә ҡараһа ла, киреһенсә, окисланыуҙың иң юғары дәрәжәһе берәмектән күберәк.. Лантаноидтарҙың окисланыу дәрәжәһе 4-тән артмай (махсус шарттарҙа празеодим өсөн 5 окисланыу дәрәжәһе теркәлгән)[4]); .Лантаноидтарҙа окисланыу дәрәжәһе +4-тән артмай (айырым шарттарҙа празеодим өсөн +5 окисланыу дәрәжәһе теркәлгән); актинидтарҙың окисланыуы +7-гә тиклем. Һигеҙ һаны кислород (R) һәм водород (HR; йәғни ыңғай һәм кире окисланыу дәрәжәһе) өсөн окисланыу дәрәжәһенең абсолют ҡиммәттәре суммаһына тигеҙ тигән ҡағиҙә ПСХЭ таблицаһының IV-V-VI-VII п-элементтары өсөн генә күҙәтелә. - Берләшмәләге элемент-металдар, ғәҙәттә, окисланыуҙың ыңғай дәрәжәһенә эйә. Ләкин металдарҙың окисланыу дәрәжәһе нуль (нейтраль карбонилдар һәм ҡайһы бер башҡа комплекстар) һәм кире (алкалидтар, ауридтар, анион карбонилдар, Цинтль фазалары) булған берләшмәләр осрай)[5]
Окисланыу дәрәжәһе төшөнсәһе ҡулланыу нестехиометрик берләшмәләр өсөн ҡулланырға ярай (КС8, Mo5Si3, Nb3B4 һәм башҡалар.).
Шартлылыҡ
Окисланыу дәрәжәһе физик мәғәнәгә эйә булмаған, ләкин молекулалала атом-ара тәьҫир итешеүҙең химик бәйләнеше барлыҡҡа килеүен сағылдырған шартлы дәүмәл булып тора.
Окисланыу дәрәжәһе ҡайһы бер осраҡтарҙа валентлыҡ менән тап килмәй. Мәҫәлән, органик берләшмәләрҙә, углерод һәр ваҡыт дүрт валентлы, ә метан CH4,, метил спирты CH3OH, , формальдегид кислотаһы HCOH, ҡырмыҫҡа кислотаһы HCOOH һәм CO2 углерод диоксиды шуға ярашлы −4, −2, 0, +2 һәм +4-кә тигеҙ.
Окисланыу дәрәжәһе йыш ҡына бәйләнеш булдырыуҙа ҡатнашҡан электрондарҙың һанына тап килмәй. Ғәҙәттә, был төрлө электрон дефицитлы химик бәйләнешле һәм электрон тығыҙлыҡ эшкәртелгән молекулалар..
Мәҫәлән, азот кислотаһы молекулаһында азоттың үҙәк атомының окисланыу дәрәжәһе 5-кә, ә координацион һаны — 3-кә тигеҙ.
SO2 төҙөлөшө менән оҡшаш булған озон молекулаһында кислород атомдары нуль дәрәжәлә окисланыу хас (йыш ҡына, үҙәк кислород атомының 4 окисланыу дәрәжәһе бар, тиҙәр).
.Окисланыу дәрәжәһе күп осраҡта атомдарҙың электр полярлашыуының фактик характерын һәм дәрәжәһен дә сағылдырмай (эксперименталь рәүештә билдәләнгән атомдарҙың ысын заряды). Мәҫәлән, HCl һәм, NaCl һәм окисланыу дәрәжәһе хлор −1 тигеҙ ҡабул ителә, ул саҡта атом булараҡ, дөрөҫөн полярлашыу (сағыштырма һөҙөмтәле заряд δ−) был берләшмәләр төрлө: δCl(HCl) = заряд берәмек −0,17, δCl(NaCl) = заряд −0,9 берәмек (абсолют электрондың заряд); водород һәм натрий — шуға +0,17 һәм +0,90. Ә ZnS цинк сульфиды кристалдарында цинк һәм көкөрт атомдарының заряды +2 һәм −2 окисланыу дәрәжәһе урынына 0,86 һәм −0,86-ға тигеҙ. .
Аммоний хлориды миҫалында хәҙерге химияла булған төрлө төшөнсәләрҙең киҫелешенә ҡағылыу уңайлы. Шулай итеп,NH4Cl -да, азот атомының окисланыу дәрәжәһе −3, ковалентлыҡ IV , электр валентлығы Льюис буйынса формаль заряд) +1 {аммоний-катион шулай уҡ 1+ зарядҡа эйә), ә дөйөм валентлыҡ((координация номеры дөйөм структуралы) — 5, ә уның эффектлы заряды өсөн −0,45 ҡиммәте тәҡдим ителгән[6].
Проблемалары
Окисланыу дәрәжәһе төшөнсәһен ҡулланыу берләшмәләрҙең түбәндәге кластары өсөн проблемалы булып тора[7]:
- Яҡын электр тиҫкәрелек атомдары араһында ковалент бәйләнештәр булған берләшмәләр, мәҫәлән: PH3, Cl3N. В. Был осраҡта электр тиҫкәрелектең төрлө шкалаларын ҡулланыу төрлө һөҙөмтә бирә. 2014 йылда ИЮПАК Аллен электр тиҫкәрелек шкалаһын ҡулланырға тәҡдим итә, сөнки башҡа шкалаларҙа атомдың валентлыҡ торошон (шартлы ҡиммәтте билдәләүҙе ҡатмарлаштыра) йәки уның окисланыу дәрәжәһе төшөнсәләре ҡулланыла.[8].
- Делокализацияланған ковалент бәйләнештәре булған һәм резонанс структуралары араһында аралаш торған берләшмәләр,өсөн атомдарҙың окисланыу дәрәжәһе төрлөсә. Мәҫәлән, N2O молекулаһында азоттың сикке атомы 1-ҙән 0, уртаһы — 2-нән 3-кә тиклем окисланыу дәрәжәһенә эйә. Структурала бер элементтың атомдары тиң булған осраҡта, улар окисланыу дәрәжәһенең уртаса дәрәжәһен билдәләй, хатта ваҡланған булырға мөмкин. Мәҫәлән: . Окисланыу-ҡайтарылыу реакцияларының тигеҙләмәләрендә, атомдары тигеҙ булмаған хәлдә лә, окисланыу дәрәжәһенең уртаса (шул иҫәптән ваҡланған) ҡиммәттәре йыш ҡулланыла., мәҫәлән (ҡаты билдәләмә буйынса ).
- Тулыһынса делокализацияланған электрондарҙан торған берләшмәләр (металл бәйләнеш). Мәҫәлән, лантан дикарбиде LaC2 иондарҙҙан — La3+, C22 һәм делокализацияланған электрондарҙан тора. C22− иондар берләшмәһе булыуы лантананың окисланыу дәрәжәһен +2-гә тигеҙ тип иҫәпәргә мөмкинлек бирә, икенсе яҡтан, C≡C-тың CaC2 менән сағыштырғанда ҙурыраҡ бәйләнеш оҙонлоғо, делокализацияланған электрондарҙың бәйләүгә ҡаршы орбиталдәр менән үҙ-ара тәьҫир итешеүе арҡаһында, углерод окисланыу торошон −3/2 тип иҫәпләргә мөмкинлек бирә. .Өсөнсө мөмкинлек — электридтар кеүек берләшмәләрҙе ҡарау, йәғни делокализацияланған электрондарҙы атомдарҙың береһенә лә бәйләү түгел. Берләшмәләрҙәге бөтә элементтар металдар булған осраҡта , ғәҙәттә уларҙың окисланыу дәрәжәһе нулгә тиң тип иҫәпләнә.
Окисланыу-ҡайтарылыу реакцияһы тигеҙләмәһен төҙөү миҫалы
Электрондың тигеҙләмәһен төҙөү:
Табылған коэффициенттарҙы тигеҙлек билдәһен алмаштырып, процесс схемаһына ҡуябыҙ:
(йәғни электрон реакцияларҙа (электрон баланс ысулы), окисланыуҙың бер өлөшө булған тимер 3 коэффициент менән генә теркәлә).
Асылда,Fe2+, Fe3+ иондар юҡ, һәм шулай уҡ Fe+8/3,, Cr6+, Mn7+, S6+, ә CrO42−, MnO4−, SO42− иондар бар , ә тигеҙ « аҙ диссоцирланған электролиттар» Fe3O4 (FeO•Fe2O3). тигеҙ. Шуға күрә ярым реакциялар ысулына (ион-электрон ысулдарға) өҫтөнлөк бирергә һәм уны һыуҙағы эретмәләрҙә барған окисланыу-ҡайтарылыу реакцияларының тигеҙләмәһен төҙөгәндә ҡулланыу мөмкин. Йәғни стандарт электрод потенциалының әҙер реакцияһы менән файҙаланыла:
Fe3O4 + 8H+ + 8e− = 3Fe + 4H2O, E° = −0,085 В
Шулай уҡ ҡарағыҙ
- Валентлыҡ
- Координация һаны
Иҫкәрмәләр
- Справочник химика. Под ред. Б. П. Никольского, Л: Химия, 1971. С. 13.
- Эту фиктивную зарядность в молекулах с ковалентными связями правильнее называть степенью окисления элемента, иначе, его окислительным числом. Для отличия от положительной или отрицательной зарядности (например, , ) знаки при степени окисления (окислительном числе) меняют на обратные (например, ). Адекватны этой формуле и изображения: H→F и Hδ+—Fδ−. Агафошин Н.П. Периодический закон и периодическая система хим. элементов Д. И. Менделеева. — 2-е изд. — М.: Просвещение, 1982. — с. 56
- Guanjun Wang, Mingfei Zhou, James T. Goettel, Gary J. Schrobilgen, Jing Su, Jun Li, Tobias Schlöder, Sebastian Riedel Identification of an iridium-containing compound with a formal oxidation state of IX (инг.) // Nature. — 2014. — Vol. 514. — P. 575—577. — DOI:10.1038/nature13795
- Qingnan Zhang, Shu‐Xian Hu, Hui Qu, Jing Su, Guanjun Wang, Jun‐Bo Lu, Mohua Chen, Mingfei Zhou, Jun Li Pentavalent Lanthanide Compounds: Formation and Characterization of Praseodymium(V) Oxides (инг.) // Angewandte Chemie International Edition. — 2016. — Vol. 24. — P. 6896–6900. — ISSN 1521-3773. — DOI:10.1002/anie.201602196
- John E. Ellis Adventures with Substances Containing Metals in Negative Oxidation States (инг.) // Inorganic Chemistry. — 2006. — Vol. 45. — P. 3167—3186. — DOI:10.1021/ic052110i
- Некрасов Б.В. Основы общей химии. — 3-е изд., испр. и доп. — М.: Химия, 1973. — Т. I. — стр. 395
- Pavel Karen, Patrick McArdle, Josef Takats Toward a comprehensive definition of oxidation state (IUPAC Technical Report) (инг.) // Pure and Applied Chemistry. — 2014. — Vol. 86. — № 6. — P. 1017—1081. — ISSN 1365-3075. — DOI:10.1515/pac-2013-0505
- P. Karen, P. McArdle, J. Takats Comprehensive definition of oxidation state (инг.) // Pure Appl. Chem.. — 2015. Архивировано из первоисточника 2 февраль 2017.