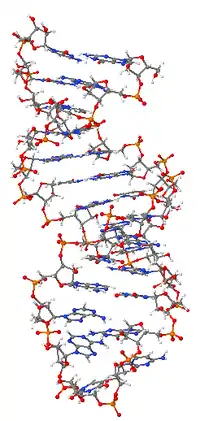
Ribonuklein turşusu
Ribonuklein turşusu, RNT — hüceyrədə informasiyanın genlərdən zülala ötürülməsi yəni transkripsiya və translyasiya proseslərində, eləcə də genetik ifadə prosesinin tənzimlənməsində birbaşa iştirak edən DNT kimi nukelotidlərdən ibarət makromolekul. RNT nuklein turşusu olub əsas üç növə bölünür: t-RNT m-RNT və r-RNT. Əksər canlıların irsi maddəsi DNT olsa da bəzi viruslarınki (retroviruslar) RNT-dir.
Eynilə DNT (deoksiribonuklein turşusu) kimi RNT hər bir keçidin bir nukleotid adlandığı uzun bir zəncirdən ibarətdir. Hər bir nukleotid azot əsasları,riboza şəkər və fosfat qrupundan ibarətdir. Nukleotid ardıcıllığı RNT-yə genetik məlumatları kodlamağa imkan verir. Bütün hüceyrə orqanizmləri protein sintezini proqramlaşdırmaq üçün RNT (MRNT) istifadə edir.
Hüceyrə RNT-ləri transkripsiya adlanan bir proses zamanı meydana gəlir,yəni DNT matrisində RNT sintezi,xüsusi fermentlər — RNT polimerazları tərəfindən həyata keçirilir. Bundan sonra MRNT prosesdə,translyasiya (biologiya) adlanan,iştirakı qəbul edir. Translyasiya — transkripsiya nəticəsində yaranan MRNT-lərdəki koda uyğun olaraq ribosomlarda reallaşdırılan polipeptit sintezi prosesidir. Transkripsiyadan sonra digər RNT-lər kimyəvi dəyişikliklərə məruz qalırlar,ikincili və üçüncülü quruluşların meydana gəlməsindən sonra RNT növündən asılı olaraq funksiyaları yerinə yetirirlər.
Tək qapalı RNT-lərə eyni zəncirin nukleotidlərinin bir hissəsi bir-biri ilə cütləşdiyi müxtəlif məkan quruluşları xarakterikdir. Bəzi yüksək quruluşlu RNTlər hüceyrə zülalı sintezində iştirak edir,məsələn,tRNT-lər genetik kodları tanımaq üçün istifadə olunur və zülal sintezi sahəsinə müvafiq amin turşularının çatdırılması və ribosomal RNT-lər ribosomların struktur və katalitik əsasını təşkil edir.
Ancaq müasir hüceyrələrdəki RNT-nin funksiyaları yalnız translyasiyadakı rolları ilə məhdudlaşmır. Beləliklə, kiçik nüvə RNT-ləri eukariotik MRNT-lərin yayılmasında və digər proseslərdə iştirak edirlər.
RNT molekulların bəzi fermentlərin (məsələn, telomerazın) bir hissəsi olmasına əlavə olaraq, fərdi RNT-nin öz ferment aktivliyi: digər RNT molekullarına daxil olmaq və ya əksinə iki RNT parçasını "bir-birinə yapışdırmaq" qabiliyyəti var. Belə RNT -lərə ribozimlər deyilir.
Bir sıra virusların genomları RNT-dən ibarətdir, yəni onlarda DNT-nin daha yüksək orqanizmlərdə oynadığı rol oynayır. Hüceyrədəki RNT funksiyalarının müxtəlifliyinə əsaslanaraq, RNT-nin prebioloji sistemlərdə özünü çoxalda bilən ilk molekul olması barədə bir fərziyyə irəli sürüldü.
Tədqiqatı tarixi
Nuklein turşuları, nüvədə (lat. nucleus) tapıldığı üçün bu maddələri "nuklein" adlandıran İsveçrə alimi Yohann Friedrix Mişer tərəfindən kəşf edilmişdir.[1] Sonradan məlum oldu ki,nüvəsi olmayan bakteriya hüceyrələrində nuklein turşuları da var. Zülal sintezindəki RNT-nin əhəmiyyəti 1939-cu ildə Torbyorn, Oskar Kasperson,Cin Braş və Cek Şulz tərəfindən irəli sürülmüşdür.[2] Cerard Meyrbaks,dovşan hemoqlobini kodlayan ilk MRNT-ni təcrid etdi və eyni proteininin yumurta hüceyrəyə daxil olduqda meydana gəldiyini göstərdi.[3] 1956–1957-ci illərdə A. Belozerski, A.Spirin, E.Volkin, L.Astraxan RNT hüceyrələrinin tərkibini müəyyənləşdirmək üçün iş apardı, nəticədə hüceyrədəki RNT-nin əsas hissəsi ribosomal RNT-dir.[4] Severo Oçoa, RNT sintezi mexanizmini kəşf etdiyinə görə 1959-cu ildə tibb üzrə Nobel mükafatını aldı.[5]
1961-ci ildə sovet alimləri G.P. Georgiyev və V.L.Mantiyev heyvan hüceyrələrinin nüvələrində nüvə RNT aşkar etmişlər,onlardan MRNT əmələ gəlmişdir.[6]. 1961-ci ilin oktyabrında 145 nömrəli "Ali orqanizmlərin nüvələrində Dezoksiribonuklein turşusu (DNT) (yeni sinif ribonuklein turşusu) sintezi fenomeni" adlı elmi kəşf qeydə alındı.[7] Yüksək orqanizmlərin hüceyrələrinin nüvələrində yeni bir sinif ribonuklein turşusunun meydana gəlməsinin əvvəllər bilinməyən fenomenini — məlumat RNT-nin yüksək molekulyar çəkisi olan hüceyrə zülallarının sintezi üçün genetik məlumat daşıyan nüvə dDNT-ni (DNT-yə bənzər nükleotid tərkibi olan RNT) meydana gətirdilər.
S. cerevisiae mayasının tRNT-lərindan birinin 77 nukleotidinin ardıcıllığı 1965-ci ildə tibb üzrə Nobel mükafatını alan Robert Holli laboratoriyasında müəyyən edilmişdir.[8] 1967-ci ildə Karl Vyoz, RNT-lərin katalitik xüsusiyyətlərə sahib olduğunu irəli sürdü. O, proto-orqanizmlərin RNT-nin də məlumat saxlamaq üçün molekul rolunu oynadığı RNT dünyasının qondarma fərziyyəsini (indi bu rol əsasən DNT tərəfindən yerinə yetirilir) və metabolik reaksiyaları katalizləşdirən molekul (indi fermentlər bunu edirlər) olduğunu irəli sürdü.[9] 1976-cı ildə Volter Faers və Belçikadakı Gent Universitetindəki qrup,RNT tərkibli bir virusun,bakteriofaj MS2-nin ilk ardıcıllığını təyin etdilər.[10] 1990-cı illərin əvvəllərində xarici genlərin bitki genomuna daxil olması oxşar bitki genlərini üstələdiyini aşkar etdi.[11] Eyni zamanda,təxminən 22 əsası olan RNT-nin indi mikroRNT adlandırıldığı C.elegans yumru qurdların ontogenezində tənzimləyici rol oynadığı göstərildi.[12]
Adının mənşəyi
Şəkər kimyasının banisi Emil Fişer,1880-ci illərin sonlarında, gənc həmkarı Oskar Piloti ilə birlikdə əvvəllər bilinməyən bir turşu olan arabinozdan isomerik arabinoz turşusu əldə etdi. Yeni maddənin adını icad edən müəlliflər əvvəlcə orijinal arabinoz turşusunun adını içindəki hərfləri dəyişdirərək "izomerləşdirdilər". Nəticə "raabinoz" idi,amma səslənməsini bəyənmədikləri üçün və aa -nı i ilə əvəz etdilər. Ribon turjusu alındı,yenidən bərpa ilə riboz turjusu əldə edildi. Artıq o, ribonuklein turşusu (RNT) və dezoksiribonuklein turşusu (DNT), ribosom,ribuloza monosaxarid,ribit spirti,ribonuklez fermenti və s. kimi birləşmələrə ad verdi.[13]
Kimyəvi tərkibi və monomerlərin modifikasiyası
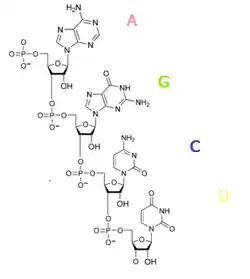
RNT nukleotidləri əsaslardan biri 1' mövqeyində bağlandığı şəkər — ribozdan: adenin,quanin,sitozin və ya urasilindən barətdir. Fosfat qrupu ribozu bir zəncirlə birləşdirir, bir ribozun 3' karbon atomu ilə digərinin 5' mövqeyində əlaqələr meydana gətirir. Fizioloji pH səviyyəsində fosfat qrupları mənfi yüklənir,buna görə RNT — aniondur. RNT dörd əsasdan (adenin (A), quanin (G),urasil(U) və sitozin (C)) olan bir polimer kimi transkripsiyalanmışdır, lakin yetkin RNT-də bir çox dəyişdirilmiş əsas və şəkər vardır.[14] Ümumilikdə, RNT-də təxminən 100 müxtəlif növ dəyişdirilmiş nukleotid var, bunlardan 2'-O-metilriboza ən çox yayılmış şəkər modifikasiyasıdır, psevdouridin isə ən çox yayılmış dəyişdirilmiş əsasdır.[15]
Psevdouridində (Ψ) urasil və riboza arasındakı əlaqə C — N deyil, C — C-dir,bu nukleotid RNT molekullarında fərqli mövqelərdə olur. Xüsusilə, psevdouridin tRNT-nin fəaliyyəti üçün vacibdir.[16] Digər diqqətəlayiq bir dəyişiklik bazası, nükleosid inosin adlandırılan, zərərsizləşdirilmiş adenin olan hipoksantindir. İnosin genetik kodun pozulmasını təmin etmək üçün mühüm rol oynayır.
Bir çox digər modifikasiyanın rolu tam aydın deyil,lakin ribosomal RNT-də bir çox post-transkripsiya dəyişiklikləri ribosomun fəaliyyət göstərməsi üçün vacib olan ərazilərdə yerləşir. Məsələn, ribonukleotidlərdən birində, bir peptit əlaqəsinin meydana gəlməsində iştirak edir.[17]
Quruluşu
RNT tərkibindəki azotlu əsaslar sitozin və quanin arasında, adenin və urasil, həmçinin quanin və urasil arasında hidrogen bağları əmələ gətirə bilər.[18] Ancaq digər qarşılıqlı təsirlər mümkündür, məsələn, bir neçə adenin bir döngə və ya bir cüt adenin — quanin əsasının olduğu dörd nukleotiddən ibarət bir döngə meydana gətirə bilər.[19]

RNT-nin onu DNT-dən fərqləndirən vacib bir quruluş xüsusiyyəti, DNT-də ən çox müşahidə olunan B konformasiyasında deyil, RNT molekulunun A-da olmasına imkan verən ribozun 2' mövqeyində bir hidroksil qrupunun olmasıdır.[20] A formalı dərin və dar böyük şırım və dayaz və geniş kiçik şırım var.[21] 2' hidroksil qrupuna sahib olmağın ikinci nəticəsi,konformativ olaraq plastik olan, yəni ikiqat səpkili meydana gəlmədə iştirak etməyən RNT molekulunun bölmələri kimyəvi olaraq digər fosfat birləşmələrinə hücum edərək onları parçalaya bilər.[22]
Zülallar kimi tək telli RNT molekulunun "işləyən" forması çox vaxt üçüncü quruluşa malikdir. Üçüncü quruluş molekul içərisində hidrogen birləşmələri ilə meydana gələn ikincili quruluşun elementləri əsasında formalaşır. İkinci dərəcəli quruluşun bir neçə növü var — kök döngələr, döngələr və yalançı düyünlər.[23] Baza cütləşməsinin mümkün sayının çox olması səbəbindən, RNT-nin ikincil quruluşunu proqnozlaşdırmaq zülalların ikincil quruluşunu proqnozlaşdırmaqdan daha çətin bir işdir, amma hazırda mfold kimi,effektiv proqramlar var.[24]
RNT molekullarının funksiyasının onların ikincili quruluşundan asılılığına,ribosomanın daxili açılış yerlərini (IRES) misal göstərmək olar. IRES, protein sintezi başlanğıcının adi mexanizmini kənara qoyaraq ribosom bağlamasını təmin edən messencer RNT-nin 5 'sonundakı bir quruluşdur,5'sonunda və protein başlama amillərində xüsusi dəyişdirilmiş bazanın (qapağın) olmasını tələb edir. IRES əvvəlcə viral RNT-lərdə tapıldı,lakin indi mobil mRNT-lərin stress altında IRES-ə bağlı başlanğıc mexanizmindən istifadə etdiyinə dair daha çox dəlil toplanır.[25]
Bir hüceyrədəki bir çox RNT növü, məsələn, mRNt və kiçik-nüvə-RNT, sintez edildikdən və ya (eukariotlarda) nüvədən sitoplazmaya keçdikdən sonra RNT molekulları ilə əlaqəli zülallarla kompleks olaraq fəaliyyət göstərir. Belə RNT protein komplekslərinə ribonukleoprotein kompleksləri və ya ribonukleoproteinlər deyilir.
DNT ilə müqayisəsi
DNT və RNT arasında üç əsas fərq var:
- DNT-də deoksiriboza şəkəri, RNT-də deoksiriboza, hidroksil qrupu ilə müqayisədə əlavə olan riboza var. Bu qrup molekulun hidrolizi ehtimalını artırır, yəni RNT molekulunun sabitliyini azaldır.
- RNT-də adenini tamamlayan nukleotid DNT-də olduğu kimi, timin deyildir və urasil, timin tərkibindəki unmetilated formasıdır.
- DNT, iki ayrı molekuldan ibarət olan ikiqat dezoksiribonuklein turşusu şəklində mövcuddur. RNT molekulları orta hesabla daha qısa və əsasən tək tellidirlər.
Bioloji aktiv RNT molekullarının, o cümlədən tRNT,rRNT,snRNT və zülalları kodlamayan digər molekulların struktur təhlili,onların uzun spiraldan ibarət olmadığını və bir-birinə yaxın yerləşən və zülalın üçüncü quruluşuna bənzər bir şey meydana gətirən çoxsaylı qısa spirallardan ibarət olduğunu göstərdi. Bunun nəticəsində RNT kimyəvi reaksiyaları kataliz edə bilər, məsələn, zülalların peptit bağının meydana gəlməsində iştirak edən ribosomun peptitil transferaz mərkəzi tamamilə RNT-dən ibarətdir.[26][27]
Sintezi
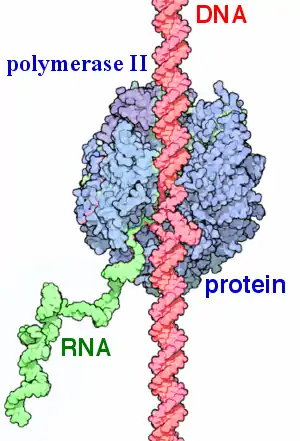
Bir canlı hüceyrədə RNT sintezi ferment — RNT polimeraz tərəfindən həyata keçirilir. Eukariotlarda fərqli RNT növləri fərqli, ixtisaslaşdırılmış RNT polimerazları tərəfindən sintez olunur. Ümumiyyətlə,həm DNT,həm də başqa RNT molekulu bir RNT sintezi matrisi kimi çıxış edə bilər.[28] Məsələn, polioviruslar RNT-dən ibarət olan genetik materiallarını çoxaltmaq üçün RNT-yə bağlı,RNT polimerazından istifadə edirlər. Lakin əvvəllər yalnız viruslara xas,hesab edilən RNT-nin RNT-dən asılı sintezi,hüceyrə orqanizmlərində,sözdə RNT müdaxiləsi prosesində meydana gəlir.[29].
DNT-yə bağlı RNT polimerazında olduğu kimi,RNT-yə bağlı,RNT polimeraz vəziyyətində,ferment promoter ardıcıllığına qoşulur. Matritsa molekulunun ikincil quruluşu polimerazın helikaz aktivliyi ilə əlaqələndirilmir, substrat molekulun 3 '-dən 5' -ə qədər olan istiqamətdə hərəkət edərkən RNT-ni 5 '→ 3' istiqamətində sintez edir. Orijinal molekuldakı transkripsiya terminatoru sintezin sonunu müəyyənləşdirir. Bir çox RNT molekulları "tənzimləmə" — RNT-protein komplekslərindən istifadə edərək lazımsız hissələrin çıxarılması ilə nəticələnən öncül molekullar kimi sintez olunur.[30]
Məsələn,bağırsaq çöplərində rRNT genləri bir operonda yerləşir (rrnB, tənzimləmə qaydası: 16S — tRNAGlu 2–23S-5S) bir uzun molekula kimi oxunur, sonra əvvəlcədən rRNT, sonra isə yetkin rRNT molekullarının meydana gəlməsi ilə bir neçə sahədə parçalanma keçir.[31] Sintezdən sonra RNT-nin nukleotid ardıcıllığının dəyişdirilməsi prosesinə RNT-nin işlənməsi və ya redaktəsi deyilir.
Transkripsiya tamamlandıqdan sonra, RNT tez-tez bu molekulun yerinə yetirdiyi funksiyadan asılı olaraq dəyişikliklərə məruz qalır (yuxarıda bax). Eukariotlarda, RNT-nin "yetişməsi" prosesi, yəni protein sintezi üçün hazırlanması, tez-tez RNT yayılmanı əhatə edir: bir spliceosome ribonukleoproteindən istifadə edərək kodlanmayan protein ardıcıllığının (intronların) çıxarılması aiddir. Daha sonra, eukaryotik pre-mRNT molekulunun 5'ucuna xüsusi dəyişdirilmiş nukleotid (qapaq) əlavə olunur və 3' sonuna "polyA quyruğu" adlandırılan bir neçə adenin əlavə olunur.[30].
RNT növləri
MRNT (məlumat RNT-si)- canlı hüceyrələrdə zülal sintezi üçün lazım olan informasiyanı DNT-dən alaraq ribosoma daşıyan RNT növüdür. MRNT-nin kodlaşdırma ardıcıllığı protein polipeptid zəncirinin amin turşusu ardıcıllığını təyin edir.[32] Bununla birlikdə, RNT-nin böyük əksəriyyəti zülal kodlaşdırmır. Bu kodlaşdırmayan RNT-lər ayrı-ayrı genlərdən (məsələn, ribosomal RNT-lərdən) transkripsiyalana bilər və ya intronlardan əldə edilə bilər.[33] Klassik,yaxşı öyrənilmiş kodlanmayan RNT-lər translyasiya prosesində iştirak edən nəqliyyat RNTləri (tRNT) və rRNT-lərdir.[34] Gen tənzimlənməsi, mRNT emalı və digər rollardan məsul RNT sinifləri də var. Bundan əlavə,RNT molekullarının kəsilməsi və bağlanması kimi kimyəvi reaksiyaları kataliz edə bilən kodlaşdırmayan RNT molekulları var.[35] Kimyəvi reaksiyaları kataliz edə bilən zülallara bənzətməklə — fermentlər, katalitik RNT molekullarına ribozimlər deyilir
Translyasiyada iştirakı
.png.webp)
Protein amin turşusu ardıcıllığı haqqında məlumat mRNT-da yer alır. Üç ardıcıl nukleotid (kodon) bir amin turşusuna uyğundur. Eukariotik hüceyrələrdə, köçürülmüş mRNT öncəsi və ya pre-mRNT yetkin mRNT meydana gətirmək üçün işlənir. Emal,kodlanmayan protein ardıcıllığının (intronların) çıxarılmasını əhatə edir. Bundan sonra mRNT nüvədən sitoplazmaya ixrac olunur,burada amin turşuları ilə əlaqəli Nəqliyyat RNT (nRNT)-ləri istifadə edərək mRNT-ni çevirən ribosomlar bağlanır.
Nüvə hüceyrələrində (bakteriya və arxeya) ribosomlar RNT saytının transkripsiyasından dərhal sonra mRNT-yə qoşula bilər.Və eukariotlarda və prokariotlarda mRNT-nin həyat dövrü ribonukleaz fermentlər tərəfindən idarə olunan məhv ilə başa çatır.[32]
Nəqliyyat (nRNT) — kiçik, təxminən 80 nukleotiddən,mühafizəkar üçüncü quruluşa malik molekullardan ibarətdir. Xüsusi amin turşularını ribosomdakı peptit əlaqəsinin sintezi yerinə köçürürlər. Hər bir nRNT tanınması və mRNT kodonlarına qoşulması üçün,bir amin turşusu bağlama yeri və antikodon daşıyır. Antikodon, nRNT-ni meydana gələn peptidin son amin turşusu ilə nRNT-yə bağlı olan amin turşusu arasında bir peptiy əlaqəsinin meydana gəlməsini təşviq edən vəziyyətə gətirən kodon ilə hidrogen rabitəsi meydana gətirir.[33]
Ribosomal RNT (rRNA) ribosomların katalitik tərkib hissəsidir. Eukariotik ribosomlarda dörd növ rRNT molekulu var: 18S, 5.8S, 28S və 5S. Dörd növ rRNT-nin üçü nüvədə sintez olunur. Sitoplazmada ribosomal RNT-lər ribosomal zülallarla birləşir və ribosoma adlanan nukleoprotein meydana gətirirlər.[32] Ribosom mRNT-yə bağlanır və zülal sintez edir. rRNT bir eukariotik hüceyrənin sitoplazmasında olan RNT-nin 80% -ə qədərini təşkil edir.[36]
NRNT və mRNT (nmRNT) kimi fəaliyyət göstərən qeyri-adi bir RNT növü, bir çox bakteriya və plastiddə olur. Ribosoma,defolt kodonları olmadan qüsurlu mRNT-lər üzərində dayandıqda,nmRNT zülalın pozulmasına yönəldən kiçik bir peptid bağlayır.[37].
Gen tənzimlənməsində iştirakı
Tamamlayıcı MRNT və ya genin özü ilə,gen ifadəsini azalda biləcək canlı hüceyrələrdə bir neçə RNT növü aşkar edilmişdir. Eukariotlarda olan mikro RNT (uzunluğu 21–22 nukleotidlər) və RNT müdaxilə mexanizmi ilə təsir göstərir. Bu vəziyyətdə mikro-RNT və fermentlər kompleksi genin fəaliyyətini azaltmaq üçün bir siqnal kimi xidmət edən genin təbliğatçısının DNT-də nukleotidlərin metilizasiyasına səbəb ola bilər. Başqa bir tənzimləmə növündən istifadə edərkən, mikro-RNT-ni tamamlayan mRNT pozulur.[38] Ancaq gen ifadəsini azaltmaq əvəzinə artan mikro-RNT-lər var.[39] Kiçik müdaxilə edən RNT-lər (mikro-RNT-lər, 20–25 nukleotidlər) tez-tez viral RNT-nin parçalanması nəticəsində əmələ gəlir,lakin endogen hüceyrəli mikro-RNT-də var.[40] Kiçik müdaxilə edən RNT-lər də RNT müdaxiləsi ilə mikro-RNT-yə bənzər bir şəkildə hərəkət edirlər.[41] Heyvanlarda, Piwi (heyvan hüceyrələrində ifadə edilən kiçik kodlanmayan RNT-lərin ən böyük sinfi,29–30 nukleotidlər) ilə qarşılıqlı təsir göstərən, mikrob hüceyrələrində transposon nüsxələrinin sayının artmasına qarşı çıxan və qamet meydana gəlməsində rol oynayan RNT-lər aşkar edilmişdir.[42][43] Bundan əlavə, piRNT-lər epigenetik olaraq ana xətti ilə miras qala bilər, nəsillərənə transposon ifadəsinin maneə törətmək qabiliyyətini ötürə bilər.[44].
Antisense RNT-lər bakteriyalarda geniş yayılmışdır, bir çoxları gen ifadəsini basdırır, lakin bəziləri ifadəni aktivləşdirir.[45] Antisense RNT-lər mRNT-yə qoşularaq fermentlər tərəfindən pozulmuş ikiqat telli RNT molekullarının meydana gəlməsinə səbəb olur.[46] Eukariotlarda yüksək molekulyar çəkidə, zülalları kodlamayan mRNt-yə bənzər RNT molekulları aşkar edilmişdir.[47] Bu molekullar gen ifadəsini də tənzimləyir. Buna misal olaraq,məməlilərdə iki X-xromosomundan birini birləşdirən və aktivləşdirən Xistdir.[48]
Genlərin tənzimlənməsində fərdi molekulların rolundan əlavə, tənzimləyici elementlər mRNT-nin 5' və 3' köçürülməmiş bölgələrində meydana gələ bilər. Bu elementlər müstəqil şəkildə hərəkət edə bilər,translyasiyanın başlanmasına mane olur və ya zülallar, məsələn, ferritin və ya kiçik molekullar, məsələn, biotin əlavə edə bilər.[49]
RNT emalı
Bir çox RNT digər RNT-lərin modifikasiyasında iştirak edir. İntronlar,zülallara əlavə olaraq bir neçə kiçik-nüvə-RNT (snRNA) qoruyan pre-mRNT-dən spliceosomes tərəfindən çıxarılır.[34] Bundan əlavə, intronlar öz eksizasiyasını kataliz edə bilər.[50] Transkripsiya ilə sintez olunan RNT kimyəvi cəhətdən dəyişdirilə bilər.[33] Eukariotlarda RNT nukleotidlərinin kimyəvi dəyişiklikləri, məsələn, onların metilasiyası kiçik nüvə RNT-ləri (snRNT, 60–300 nukleotidlər) tərəfindən həyata keçirilir. Bu tip RNT nüvə və Kajal cəsədlərində lokallaşdırılmışdır. Kiçik-nüvə-RNT fermentlərlə birləşməsindən sonra kiçik-nüvə-RNT iki molekulun əsasları arasında cütləşərək hədəf RNT-yə bağlanır və fermentlər hədəf RNT-nin nukleotidlərini dəyişdirirlər. Ribosomal və nəqliyyat RNT-ləri bir çox oxşar dəyişiklikləri qoruyur,onların mövqeyi tez-tez təkamül zamanı qorunur. Kiçik-nüvə- RNT-lərin özü də dəyişdirilə bilər.[51][52] Bələdçi RNT-lər protist kinetoplastidlərin (məsələn, tripanosomların) xüsusi mitoxondrial yeri olan kinetoplastda RNT tənzimləmə prosesini həyata keçirirlər.
RNT genomu

DNT kimi RNT də bioloji proseslər haqqında məlumat saxlaya bilir. RNT virusların və virus kimi hissəciklərin genomu kimi istifadə edilə bilər. RNT genomları ara DNT mərhələsi olmayanlara və bunlara bölünə bilər,reproduksiya üçün DNT nüsxəsinə və yenidən RNT-yə (retroviruslar) köçürülür.
RNT virusları
Bütün mərhələlərdə qrip virusu kimi bir çox virus yalnız RNT-dən ibarət bir genom daşıyır. RNT ümumiyyətlə protein qatında olur və içərisində kodlanmış RNT-yə bağlı RNT polimerazlarından istifadə edərək çoxalır. RNT-dən ibarət olan viral genomlar bölünür
- həm MRNT,həm də genom olaraq istifadə edilən "+ RNT zənciri" daşıyır;
- Yalnız bir genom olaraq xidmət edən və tamamlayan molekul M-RNT olaraq istifadə edilən "- RNT zənciri";
- cüt telli viruslar.
Viroidlər — RNT genomunu daşıyan və zülal olmayan başqa bir patogen qrupdur. Viroid 246 – 467 nukleotiddən ibarət birzəncirli qapalı RNT molekulundan ibarət olur.[53] Onlar ev sahibi RNT polimerazları tərəfindən təkrarlanır.[54]
Retroviruslar və retrotransposonlar
Digər virusların həyat dövrünün yalnız birində RNT genomu var. Sözdə retrovirusların virionlarında ana hüceyrələrə daxil olduqda DNT nüsxəsinin sintezi üçün bir matris kimi xidmət edən RNT molekulları var. Öz növbəsində RNT geni DNT matrisindən oxunur. Viruslardan əlavə tərs transkripsiya da genomun mobil elementləri sinfi — retrotransposonlar tərəfindən istifadə olunur.[55]
RNT-dünyası hipotezi
RNA Dünya — DNT və zülalların təkamülündən əvvəl çoxalmış RNT molekullarının çoxaldığı Yerdəki həyatın təkamül tarixində hipotetik bir mərhələdir.
RNA dünyası anlayışı 1962-ci ildə Aleksandr Riç[56] tərəfindən irəli sürülmüş,termin 1986-cı ildə Valter Gilbert tərəfindən tərtib edilmişdir.[57] RNT dünyası ilə yanaşı,[58] həyatın ortaya çıxması üçün digər kimyəvi yollar təklif edilmişdir və RNT əsaslı həyat ilk ola bilməzdi.[57][59] Bununla birlikdə, RNT dünyasının mövcud olmasına dair kifayət qədər sübut tapıldı, buna görə də fərziyyə geniş şəkildə tanındı.[56][60][61]
DNT kimi RNT də genetik məlumatları fermentlər — ribozimlər şəklində saxlaya və təkrarlaya bilər, həyatın mövcudluğu üçün vacib olan kimyəvi reaksiyaları kataliz edə bilər (işə salır və ya sürətləndirir).[62]. Bir hüceyrənin ən vacib komponentlərindən biri olan ribosomlar əsasən RNT-dən ibarətdir. Asetil-CoA,Nikotinamid adenin dinukleotid,Flavin adenin dinukleotid və Koenzim F420 kimi bir çox koenzimlərdə olan ribonukleotid parçaları, uzun müddətdir RNT dünyasında kovalent əlaqəli koenzimlərin sağ qalıqları hesab edilmişdir.[63]
RNA dünyası olsaydı, ehtimal ki,öz növbəsində DNT və daha uzun zülallara miras qalmış ribonukleoproteinlərin (RNP dünyası)[64] təkamül mərhələsini izlərdilər. DNT-nin genetik məlumatların saxlanması üçün üstünlük təşkil edən bir molekul olmasının səbəbi,bunun RNT-dən daha sabit və davamlı olması ilə əlaqəli ola bilərdi. Protein fermentləri RNT əsaslı ribozimləri biokatalizator kimi əvəz edə bilər, çünki monomerlərin (amin turşuları) müxtəlifliyi onları daha çox yönləndirir. Bəzi əmsallar həm nukleotid, həm də amin turşusu xüsusiyyətlərini saxladığından,bəlkə amin turşuları, peptitlər və nəhayət,zülallar ribozimlərin ilkin əlaqəli faktorları idi.[63]
Həmçinin bax
İstinadlar
- Dahm R. Friedrich Miescher and the discovery of DNA // Developmental Biology . 278 (journal) (ingilis). № 2. 2005. 274—288. PMID 15680349.
- Nierhaus KH, Wilson DN. Protein Synthesis and Ribosome Structure. Wiley-VCH. 2004. 3. ISBN 3-527-30638-2.
- Carlier M. "L'ADN, cette «simple» molécule". Esprit libre. 2003-06. 2011-08-23 tarixində arxivləşdirilib. İstifadə tarixi: ???.
- А. С. Спирин. Биоорганическая химия. М.: Высшая школа. 1986. 10.
- Ochoa S. "Enzymatic synthesis of ribonucleic acid" (PDF). Nobel Lecture. 1959. 2011-08-23 tarixində arxivləşdirilib (PDF). İstifadə tarixi: ???.
- "Георгиев Георгий Павлович — Мегаэнциклопедия Кирилла и Мефодия — статья" (rus). Энциклопедия Кирилла и Мефодия. 2017-12-17 tarixində arxivləşdirilib. İstifadə tarixi: 2019-02-08.
- "Научное открытие № 145 Явление синтеза ДРНК (рибонуклеиновой кислоты нового класса) в ядрах клеток высших организмов". ross-nauka.narod.ru. 2019-01-28 tarixində arxivləşdirilib. İstifadə tarixi: 2019-02-08.
- Holley RW; və b. Structure of a ribonucleic acid // Science . 147 (ingilis). № 1664. 1965. 1462–65. doi:10.1126/science.147.3664.1462. (#explicit_et_al)
- (сейчас это делают в основном ферменты)>Szathmáry E. The origin of the genetic code: amino acids as cofactors in an RNA world // Trends Genet . 15. № 6. 1999. doi:10.1016/S0168-9525(99)01730-8.
- Fiers W; və b. Complete nucleotide-sequence of bacteriophage MS2-RNA: primary and secondary structure of replicase gene // Nature . 260 (ingilis). 1976. 500–7. (#explicit_et_al)
- Napoli C, Lemieux C, Jorgensen R. Introduction of a chimeric chalcone synthase gene into petunia results in reversible co-suppression of homologous genes in trans // Plant Cell . 2. № 4. 1990. PMID 12354959.
- Ruvkun G. Glimpses of a tiny RNA world // Science . 294 (ingilis). № 5543. 2001. 797–99. doi:10.1126/science.1066315.
- Илья Леенсон. Язык химии. Этимология химических названий. АСТ. 2016. ISBN 978-5-17-095739-2.
- Jankowski JAZ, Polak J. M. Clinical gene analysis and manipulation: tools, techniques and troubleshooting. Cambridge University Press. 1996. 14. ISBN 0521478960.
- Kiss T. Small nucleolar RNA-guided post-transcriptional modification of cellular RNAs // The EMBO Journal . 20 (journal) (ingilis). 2001. 3617—3622. doi:10.1093/emboj/20.14.3617.
- Yu Q., Morrow C. D. Identification of critical elements in the tRNA acceptor stem and TΨC loop necessary for human immunodeficiency virus type 1 infectivity // J Virol. . 75 (journal) (ingilis). № 10. 2001. 4902—4906. doi:10.1128/JVI.75.10.4902-4906.2001.
- King T. H., Liu B., McCully R. R., Fournier M. J. Ribosome structure and activity are altered in cells lacking snoRNPs that form pseudouridines in the peptidyl transferase center // Molecular Cell . 11 (journal) (ingilis). № 2. 2002. 425—435. doi:10.1016/S1097-2765(03)00040-6.
- Barciszewski J., Frederic B., Clark C. RNA biochemistry and biotechnology. Springer. 1999. 73–87. ISBN 0792358627.
- Lee J. C., Gutell R. R. Diversity of base-pair conformations and their occurrence in rRNA structure and RNA structural motifs // J. Mol. Biol. . 344 (journal) (ingilis). № 5. 2004. 1225—1249. doi:10.1016/j.jmb.2004.09.072. PMID 15561141.
- Salazar M., Fedoroff O. Y., Miller J. M., Ribeiro N. S., Reid B. R. The DNA strand in DNAoRNA hybrid duplexes is neither B-form nor A-form in solution // Biochemistry . 1993 (journal) (ingilis). № 32. 1992. 4207—4215. PMID 7682844.
- Hermann T., Patel D. J. RNA bulges as architectural and recognition motifs // Structure . 8 (naməlum dil). № 3. 2000. R47—R54. doi:10.1016/S0969-2126(00)00110-6.
- Mikkola S., Nurmi K., Yousefi-Salakdeh E., Strömberg R., Lönnberg H. The mechanism of the metal ion promoted cleavage of RNA phosphodiester bonds involves a general acid catalysis by the metal aquo ion on the departure of the leaving group // Perkin transactions 2 (journal) (ingilis). 1999. 1619—1626. doi:10.1039/a903691a.
- Mathews D. H., Disney M. D., Childs J. L., Schroeder S. J., Zuker M., Turner D. H. Incorporating chemical modification constraints into a dynamic programming algorithm for prediction of RNA secondary structure // Proceedings of the National Academy of Sciences of the United States of America . 101 (journal) (ingilis). № 19. 2004. 7287—7292. doi:10.1073/pnas.0401799101.
- "Redirect". 2007-08-20 tarixində arxivləşdirilib. İstifadə tarixi: 2008-04-05.
- Spriggs K. A., Stoneley M., Bushell M., Willis AE. Re-programming of translation following cell stress allows IRES-mediated translation to predominate // Biol Cell . 100 (journal) (ingilis). № 1. 2008. 27—38.
- Higgs P. G. RNA secondary structure: physical and computational aspects // Quarterly Reviews of Biophysics . 33 (journal) (ingilis). 2000. 199—253. doi:10.1017/S0033583500003620.
- Nissen P., Hansen J., Ban N., Moore P. B., Steitz T. A. The structural basis of ribosome activity in peptide bond synthesis // Science . 289 (journal) (ingilis). № 5481. 2000. 920—930. doi:10.1126/science.289.5481.920.
- Jeffrey L Hansen, Alexander M Long, Steve C Schultz. Structure of the RNA-dependent RNA polymerase of poliovirus // Structure . 5 (journal) (ingilis). № 8. 1997. 1109—1122. doi:10.1016/S0969-2126(97)00261-X.
- Ahlquist P. RNA-Dependent RNA Polymerases, Viruses, and RNA Silencing // Science . 296 (journal) (ingilis). № 5571. 2002. 1270—1273. doi:10.1126/science.1069132.
- Alberts, Bruce; Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, and Peter Walters. Molecular Biology of the Cell; Fourth Edition. New York and London: Garland Science. 2002. 302–303.
- Wagner R., Theissen G., Zacharias. Regulation of Ribosomal RNA synthesis and Control of ribosome Formation in E.coli. 1993. 119–129.
- Cooper G. C., Hausman R. E. The Cell: A Molecular Approach (3rd edition). Sinauer. 2004. 261–276. ISBN 0-87893-214-3.
- Wirta W. Mining the transcriptome – methods and applications (PDF). 2006. ISBN 91-7178-436-5.
- Berg J. M., Tymoczko J. L., Stryer L. Biochemistry (5th edition). WH Freeman and Company. 2002. 118–119. ISBN 0-7167-4684-0.
- Rossi J. J. Ribozyme diagnostics comes of age // Chemistry & Biology . 11 (naməlum dil). № 7. 2004. 894—895. doi:10.1016/j.chembiol.2004.07.002.
- Kampers T., Friedhoff P., Biernat J., Mandelkow E-M, Mandelkow E. RNA stimulates aggregation of microtubule-associated protein tau into Alzheimer-like paired helical filaments // FEBS Letters . 399 (journal) (ingilis). 1996. 98—100, 344—49. PMID 8985176.
- Gueneau de Novoa P., Williams K. P. The tmRNA website: reductive evolution of tmRNA in plastids and other endosymbionts // Nucleic Acids Res. . 32 (journal) (ingilis). № Database issue. 2004. D104—8. doi:10.1093/nar/gkh102. PMID 14681369.
- Matzke M. A., Matzke AJM. Planting the seeds of a new paradigm // PLOS Biology . 2 (journal) (ingilis). № 5. 2004. e133. doi:10.1371/journal.pbio.0020133. PMID 15138502.
- Check E. RNA interference: hitting the on switch // Nature . 448 (ingilis). № 7156. 2007. 855—858. doi:10.1038/448855a. PMID 17713502.
- Vazquez F., Vaucheret H., Rajagopalan R., Lepers C., Gasciolli V., Mallory A. C., Hilbert J., Bartel D. P., Crété P. Endogenous trans-acting siRNAs regulate the accumulation of Arabidopsis mRNAs // Molecular Cell . 16 (journal) (ingilis). № 1. 2004. 69—79. doi:10.1016/j.molcel.2004.09.028. PMID 15469823.
- Doran G. RNAi – Is one suffix sufficient? // Journal of RNAi and Gene Silencing . 3 (naməlum dil). № 1. 2007. 217—219. 2007-07-16 tarixində arxivləşdirilib. İstifadə tarixi: 2008-05-03.
- Horwich M. D., Li C Matranga C., Vagin V., Farley G., Wang P., Zamore P. D. The Drosophila RNA methyltransferase, DmHen1, modifies germline piRNAs and single-stranded siRNAs in RISC // Current Biology . 17 (journal) (ingilis). Cell Press. 2007. 1265—1272. doi:10.1016/j.cub.2007.06.030. PMID 17604629.
- Girard A., Sachidanandam R., Hannon G. J., Carmell M. A. A germline-specific class of small RNAs binds mammalian Piwi proteins // Nature . 442 (journal) (ingilis). 2006. 199—202. doi:10.1038/nature04917. PMID 16751776.
- Brennecke J., Malone C. D., Aravin A. A., Sachidanandam R., Stark A., Hannon G. J. An epigenetic role for maternally inherited piRNAs in transposon silencing // Science . 322 (journal) (ingilis). № 5906. — 2008. noyabr. — 1387—1392. doi:10.1126/science.1165171. PMID 19039138.
- Wagner E. G., Altuvia S., Romby P. Antisense RNAs in bacteria and their genetic elements // Adv Genet . 46 (journal) (ingilis). 2002. 361—398. PMID 11931231.
- Gilbert S. F. Developmental Biology (7th ed). Sinauer. 2003. 101–103. ISBN 0878932585.
- Hüttenhofer A., Schattner P., Polacek N. Non-coding RNAs: hope or hype? // Trends Genet. . 21 (journal) (ingilis). № 5. 2005. 289—297. doi:10.1016/j.tig.2005.03.007. PMID 15851066.
- Heard E., Mongelard F., Arnaud D., Chureau C., Vourc'h C., Avner P. Human XIST yeast artificial chromosome transgenes show partial X inactivation center function in mouse embryonic stem cells // Proceedings of the National Academy of Sciences . 96 (journal) (ingilis). № 12. 1999. 6841—6846. doi:10.1073/pnas.96.12.6841. PMID 10359800.
- Batey R. T. Structures of regulatory elements in mRNAs // Curr. Opin. Struct. Biol . 16 (ingilis). № 3. 2006. 299—306. doi:10.1016/j.sbi.2006.05.001. PMID 16707260.
- Steitz T. A., Steitz J. A. A general two-metal-ion mechanism for catalytic RNA // Proceedings of the National Academy of Sciences of the United States of America . 90 (journal) (ingilis). № 14. 1993. 6498—6502. doi:10.1073/pnas.90.14.6498. PMID 8341661.
- Covello P. S., Gray M. W. RNA editing in plant mitochondria // Nature . 341 (ingilis). 1989. 662—666. doi:10.1038/341662a0. PMID 2552326.
- Omer A. D., Ziesche S., Decatur W. A., Fournier M. J., Dennis P. P. RNA-modifying machines in archaea // Molecular Microbiology . 48 (naməlum dil). № 3. 2003. 617—629. doi:10.1046/j.1365-2958.2003.03483.x. PMID 12694609.
- "Aləm: Viroidlər". Archived from the original on 2021-05-08. İstifadə tarixi: 2020-05-15.
- Daròs J. A., Elena S. F., Flores R. Viroids: an Ariadne's thread into the RNA labyrinth // EMBO Rep. . 7 (journal) (ingilis). № 6. 2006. 593—598. doi:10.1038/sj.embor.7400706. PMID 16741503.
- Kalendar R., Vicient C. M., Peleg O., Anamthawat-Jonsson K., Bolshoy A., Schulman A. H. Large retrotransposon derivatives: abundant, conserved but nonautonomous retroelements of barley and related genomes // Genetics . 166 (journal) (ingilis). № 3. 2004. D339. doi:10.1534/genetics.166.3.1437. PMID 15082561.
- Neveu M., Kim H. J., Benner S. A. The "strong" RNA world hypothesis: fifty years old // Astrobiology . 13 (naməlum dil). № 4. — 2013. aprel. — 391—403. Bibcode:2013AsBio..13..391N. doi:10.1089/ast.2012.0868. PMID 23551238.
- Cech T. R. The RNA worlds in context // Cold Spring Harbor Perspectives in Biology . 4 (naməlum dil). № 7. — 2012. iyul. — a006742. doi:10.1101/cshperspect.a006742. PMID 21441585.
- Patel B. H., Percivalle C., Ritson D. J., Duffy C. D., Sutherland J. D. Common origins of RNA, protein and lipid precursors in a cyanosulfidic protometabolism // Nature Chemistry . 7 (journal) (ingilis). № 4. — 2015. aprel. — 301—307. Bibcode:2015NatCh...7..301P. doi:10.1038/nchem.2202. PMID 25803468.
- Robertson M. P., Joyce G. F. The origins of the RNA world // Cold Spring Harbor Perspectives in Biology . 4 (naməlum dil). № 5. — 2012. may. — a003608. doi:10.1101/cshperspect.a003608. PMID 20739415.
- "Making Sense of the Chemistry That Led to Life on Earth". New York Times. 2015-05-04. 2017-07-09 tarixində arxivləşdirilib. İstifadə tarixi: 2015-05-10.
- Copley S. D., Smith E., Morowitz H. J. The origin of the RNA world: co-evolution of genes and metabolism // Bioorganic Chemistry . 35 (journal) (ingilis). № 6. — 2007. dekabr. — 430—443. doi:10.1016/j.bioorg.2007.08.001. PMID 17897696.
- "A Tiny Emissary from the Ancient Past". New York Times. 2014-09-25. 2014-09-27 tarixində arxivləşdirilib. İstifadə tarixi: 2014-09-26.
- Shen, Liang.; Hong-Fang, Ji. Small Cofactors May Assist Protein Emergence from RNA World: Clues from RNA-Protein Complexes // PLOS One . 6 (journal) (ingilis). 2011. e22494. doi:10.1371/journal.pone.0022494. PMID 21789260.
- Garwood, Russell J. Patterns In Palaeontology: The first 3 billion years of evolution // Palaeontology Online . 2 (journal) (ingilis). № 11. 2012. 1—14. 2015-06-26 tarixində arxivləşdirilib. İstifadə tarixi: 2015-06-25.
Ədəbiyyat
- Альбертс Б.; Брей Д.; Льюис Дж. и др. Молекулярная биология клетки в 3-х томах. — М.: Мир, 1994. — 1558 с. — ISBN 5-03-001986-3
- История биологии с начала XX века до наших дней. — М.: Наука, 1975. — 660 с.
- Льюин Б. Гены. — М.: Мир, 1987. — 544 с.
- Спирин А. С. Биосинтез белков, мир РНК и происхождение жизни
- Molecular Biology Of The Cell, 4-е издание, 2002 г. — учебник по молекулярной биологии на английском языке