| Propileno | |
|---|---|
 | |
| Xeneral | |
| Estructura química |
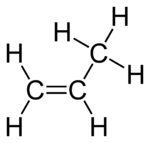 |
| Fórmula química | C₃H₆ |
| SMILES canónicu | modelu 2D |
| MolView | modelu 3D |
| Propiedaes físiques | |
| Masa | 42,04695 unidá de masa atómica |
| Puntu de fusión | −185,25 grau Celsius |
| Puntu d'ebullición | −47,69 grau Celsius |
| Enerxía d'ionización | 9,73 electrón-voltiu |
| Propiedaes termoquímiques | |
| Peligrosidá | |
| Identificadores | |
El propileno o propeno (H2C=CH–CH3) ye un hidrocarburu perteneciente a los alquenos, incoloru y ensin golor. Ye un homólogu del etilenu. Como tolos alquenos presenta'l doble enllace como grupu funcional. Ye'l segundu compuestu más utilizáu na industria químico en tol mundu.[1]
Propiedaes fisioquímicas
- Fórmula: C3H6
- Masa molecular: 42,1 g/mol
- Puntu de fusión: –185,3 °C
- Puntu de ebullición: –48 °C
- Temperatura de autoignición: 460 °C
- Presión de vapor a 20 °C: 10.200 hPa
- NᵘCAS: 115-07-1
- NᵘICSC: 0559
- NᵘRTECS: UC6740000
- NᵘCE: 601-011-00-9
- Concentración máxima dexada nos llugares de trabayu: 500 ppm (VLA-ED, ACGIH-2008).
- Llendes de explosividad: 2,0 - 11,1% de propeno nel aire.
Síntesis
El propeno ye unu de los productos de la termólisis del petroleu. Dixebrar de los demás productos como'l etilenu por destilación a baxa temperatura.
Aplicaciones
El propeno ye'l productu de partida na síntesis del polipropileno.
La adición d'agua en condiciones polares da iso-propanol que puede ser aferruñáu a l'acetona. En condiciones radicalarias llógrase n-propanol.
L'ácidu acrílico produzse anguaño utilizando'l procesu d'oxidación selectiva del propeno en dos etapes. El propeno ye tamién un compuestu entemediu na oxidación selectiva nuna etapa de propanu a ácidu acrílico. Esti últimu procesu investígase intensivamente porque'l propanu ye significativamente más baratu en comparanza col propeno.[2][3][4][5]
Reacciones
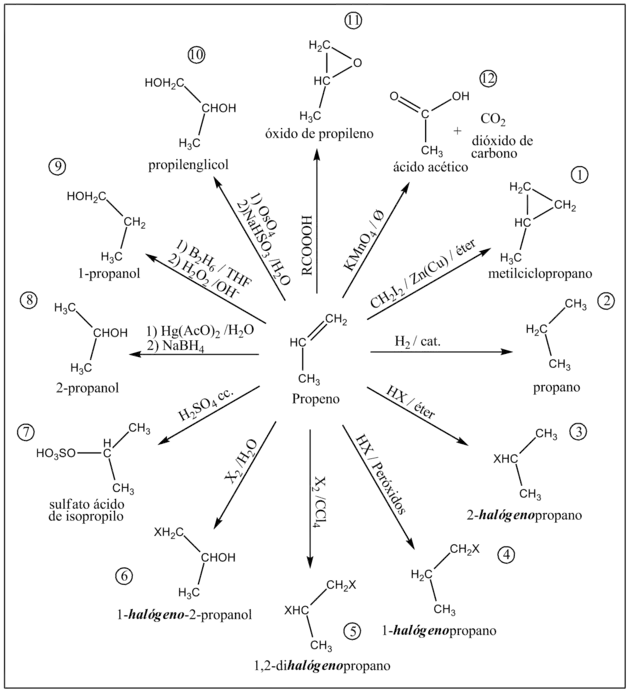
1) Reacción de Simmons-Smith
El diyodometano nuna aleación de cinc y cobre forma'l carbenoide yoduro de yodometil cinc (CH2IZnI).[6] Por aciu un mecanismu de cicloadición amiéstase un grupu metilu al propeno produciéndose'l metilciclopropano (como amiestu racémica R y S). La reacción asocede con bonos rendimientos.[6]
2) Hidrogenación
El propeno en presencies hidróxenu y de un catalizador (comúnmente Pd/C o PtO2 llamáu catalizador de Adams) s'amenorga dafechu a propanu.[6] L'adición electrofílica asocede con estereoquímica syn.[6]
3) Hidrohalogenación
La hidrohalogenación asocede al faer burbuyar un halogenuro d'hidróxenu nun recipiente conteniendo propeno n'éter.[6] Como productu principal de la reacción llograráse'l 2-halógenopropano (P.Ej: utilizando HBr llógrase'l 2-bromopropano).
4) Hidrohalogenación en presencia de peróxidos
Cuando la hidrohalogenación del propeno asocede la presencia de peróxidos la regioselectividad de la reacción inviértese dando como principal productu'l 1-halógenopropano (P.Ej: utilizadando HCl llógrase'l 1-cloropropano).[6]
5) Halogenación
Al fai reaccionar el propeno con un halóxenu en tetraclorometano como solvente produzse'l 1,2-dihalógenopropano (P.Ej: utilizando I2 llógrase'l 1,2-diyodopropano).[6]
6) Formación de halohidrinas
Cuando la halogenación producir en presencia d'agua produzse'l 1-halóxenu-2-propanol (P.Ej: utilizando Br2 como halóxenu produzse'l 1-bromu-2-propanol).[6]
7) Adición d'ácidu sulfúrico
El ácidu sulfúrico concentráu amestar al propeno por un mecanismu d'adición electrofílica produciendo'l sulfatu acedu de isopropilo.
8) Llogru d'alcoholes por oximercuración
Al tratase con acetato de mercuriu (II) en tetrahidrofurano (THF) y agua y darréu con borohidruro de sodiu (NaBH4) produzse'l 2-propanol con altu rendimientu.[6]
9) Hidroboración
Por aciu el tratamientu con diborano y posterior hidrólisis oxidativa con peróxidu d'hidróxenu (H2O2) el mediu alcalín llógrase'l alcohol Antimarkovnikov 1-propanol.[6]
10) Dihidroxilación syn
La oxidación con tetróxidu d'osmiu (OSU4) siguíu del tratamientu con bisulfito de sodiu y agua produz propilenglicol (como entemez racémica R y S).[6] Tamién se va producir la reacción de dihidroxilación syn utilizando KMnO4 esleíu en mediu aguacientu básicu a baxa temperatura.[6]
11) Llogru de epóxidos
La peroxidación del propeno con un peroxiácido (RCO3H) a temperatura ambiente produz el óxidu de propileno (como entemez racémica R y S) por aciu la reacción de Prileschajew.[7][8]
Industrialmente producir por oxidación con osíxenu en presencia d'un catalizador d'óxidu de plata (Ag2O) a altes temperatures (300 °C).[7]
12) Clivaje oxidativo
La oxidación violenta del propeno con KMnO4 caliente produz por clivaje oxidativo acedu acético y dióxidu de carbonu.[6] Tamién se llograríen los mesmos productos por ozonólisis con ozonu (O3) a baxes temperatures (-78 °C) y posterior clivaje oxidativo con peróxidu d'hidróxenu (H2O2) en mediu alcalín.[6]
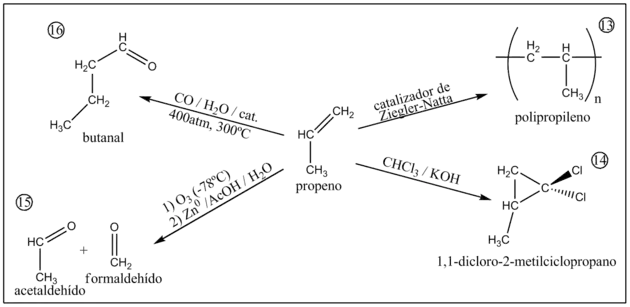
13) Polimerización
La polimerización del propilenu a polipropilenu puede llevase a cabu de forma radicalaria anque na polimerización catalítica llógrense productos con meyores calidaes qu'amás son meyor controlables. Los catalizadores emplegaos yeren orixinalmente del tipu Ziegler-Natta. Na actualidá tán sustituyéndose por otros sistemes basaos en zirconocenos.
14) Adición de diclorocarbeno
Al tratar el propeno con cloroformu y con una base fuerte como KOH llógrase 1,1-dicloro-2-metilciclopropano (como amiestu racémica R y S).[6]
15) Ozonólisis con clivaje reductivo
Por Ozonólisis con posterior clivaje oxidativo llógrase como productos formaldehídu y acetaldehídu.[6]
16) Hidroformilación
La hidroformilación del propeno con monóxidu de carbonu, agua y un catalizador de Co a altes presiones y temperatures produz butanal como principal productu.[9]
Referencies
- ↑ «Propylene Production from Methanol». by Intratec, ISBN 978-0-615-64811-8.
- ↑ «The reaction network in propane oxidation over phase-pure MoVTeNb M1 aferruñe catalysts». Journal of Catalysis 311: páxs. 369-385. 2014. doi:. http://pubman.mpdl.mpg.de/pubman/item/escidoc:1896844:6/component/escidoc:1896843/JCAT-13-716_revised_06Dec2013.pdf.
- ↑ (2011) to-berlin.de/bitstream/11303/3269/1/Dokument_8.pdf Kinetic studies of propane oxidation on Mo and V based mixed aferruñe catalysts (n'inglés).
- ↑ «Surface chemistry of phase-pure M1 MoVTeNb aferruñe during operation in selective oxidation of propane to acrylic acid». Journal of Catalysis 285: páxs. 48-60. 2012. doi:. http://pubman.mpdl.mpg.de/pubman/item/escidoc:1108560:8/component/escidoc:1402724/1108560.pdf.
- ↑ «Multifunctionality of Crystalline MoV(TeNb) M1 Aferruñe Catalysts in Selective Oxidation of Propane and Benzyl Alcohol». ACS Catalysis 3 (6): páxs. 1103-1113. 2013. doi:. https://www.researchgate.net/publication/278196177_Multifunctionality_of_Crystalline_MoVTeNb_M1_Aferruñe_Catalysts_in_Selective_Oxidation_of_Propane_and_Benzyl_Alcohol.
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 McMurry, John (2004). «Alquenos: reacciones y síntesis», Química Orgánica, sesta, Thompson, páx. 208-237. ISBN 970-686-354-0.
- 1 2 McMurry, John (2004). Química Orgánica, sesta, Thompson, páx. 648-649. ISBN 970-686-354-0.
- ↑ Beyer, Walter (1987). «Compuestos alinfáticos», Manual de química orgánica, 19º, Reverté, páx. 79. ISBN 84-291-7066-9.
- ↑ Yúfera, Eduardo Primu (1996). Química orgánica básica y aplicada:de la molécula a la industria (Volume 1). Reveté, páx. 158-159. ISBN 84-291-7953-4.
Error de Lua en Módulu:Control_d'autoridaes na llinia 522: attempt to index field 'datavalue' (a nil value).