Fuercia intermolecular referir a les interaiciones qu'esisten ente les molécules conforme a la so naturaleza. Xeneralmente, la clasificación ye fecha d'alcuerdu a la polaridá de les molécules que tán interaccionando, o sobre la base de la naturaleza de les molécules, de los elementos que lu conformen.[1]
Un enllaz químicu, son les fuercies que caltienen a los átomos xuníos formando les molécules. Esisten dos tipos d'enllaces químicos, los enllaces covalentes (onde los átomos comparten electrones) y les interaiciones débiles non covalentes (interaiciones débiles ente iones, molécules y partes de molécules).
Les interaiciones débiles non covalentes llámase-yos "débiles" porque representen la enerxía que caltienen xuníes a les especies moleculares y que son considerablemente más débiles que los enllaces covalentes. Les interaiciones non covalentes fundamentales son:
- El enllaz d'hidróxenu (d'antiguo conocíu como enllaz per ponte d'hidróxenu)
- Les fuercies de Van der Waals, que podemos clasificar de la mesma en:
- ion-dipolo.
- dipolo - dipolo.
- dipolo - dipolo inducíu.
- Fuercies de dispersión de London conocíes como dipolo instantáneu-dipolo inducíu.
Historia
En 1967 el químicu francés Jean-Marie Lehnn desenvolvió la química supramolecular per primer vegada, que ta enfocada al estudiu y emplegu d'enllaces moleculares xuníos al traviés d'interaiciones non covalentes, como pontes d'hidróxenu y fuercies de Van der Waals. Esta área puede trate como una estensión de la química clásica del enllaz covalente, que xune átomos pa formar molécules, a una química del enllaz non-covalente, que xune molécules, y con frecuencia etiquetar, siguiendo a J.-M. Lehn, cenciellamente como “química más allá de la molécula”.[2]
En comparanza colos enllaces covalentes, les interaiciones intermoleculares son débiles y tradicionalmente atraen l'atención de los químicos en rellación con procesos nos cualos participen grandes cantidaes d'especies; por casu, solvatación, fenómenos superficiales, comportamientu físicu de gases a alta presión, etcétera. Sicasí, analizando dellos sistemes biolóxicos, vemos que dellos procesos fundamentales como la replicación, les interaiciones anticuerpu-antígeno, la catálisis enzimática, realizar con estelante eficiencia por cuenta de una aición perbién entamada de les fuercies intermoleculares ente namái dos molécules. El desenvolvimientu de la química supramolecular ta fuertemente amestáu a los estudios de sistemes biolóxicos, que se reflexa tamién na terminoloxía usada nesta área. El descubrimientu de la importancia de les interaiciones non-covalentes pal caltenimientu d'estructures de molécules biolóxiques, y pal so funcionamientu, aguiyó los estudios sobre la naturaleza d'estes interaiciones y, per otru llau, intentos de reproducir dellos procesos biolóxicos; por casu, el tresporte iónicu al traviés de membranes celulares o catálisis enzimática, en sistemes químicos, llevaron al desenvolvimientu de nuevos principios de diseñu de reactivos analíticos, catalizadores, fármacos, etcétera.
Enllaz d'hidróxenu
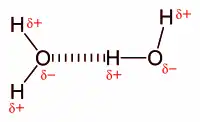
El enllaz d'hidróxenu asocede cuando un átomu d'hidróxenu ye enllazáu a un átomu fuertemente electronegativu como'l nitróxenu, el osíxenu o'l flúor.[3]L'átomu d'hidróxenu tien una carga positiva parcial y puede interactuar con otros átomos electronegativos n'otra molécula (nuevamente, con N, O o F). Asina mesmu, produzse un ciertu solapamiento ente'l H y l'átomu con que s'enllaza (N, O o F) dáu'l pequeñu tamañu d'estes especies. Per otra parte, cuanto mayor seya la diferencia de electronegatividá ente'l H y l'átomu interactuante, más fuerte va ser l'enllaz. Frutu d'estos presupuestos llogramos un orde creciente d'intensidá del enllaz d'hidróxenu: el formáu col F va ser de mayor intensidá que'l formáu col O, y ésti de la mesma va ser más intensu que'l formáu col N. Estos fenómenos resulten nuna interaición estabilizante que caltién dambes molécules xuníes. Un exemplu claru del enllaz d'hidróxenu ye l'agua:
Los enllaces d'hidróxenu atópase en tola naturaleza. Aproven a l'agua de les sos propiedaes particulares, que dexen el desenvolvimientu de la vida na Tierra. Los enllaces d'hidróxenu aproven tamién la fuercia intermolecular que caltién xuníes dambes hebras nuna molécula d'ADN.
Ye un tipu especial d'interaición dipolo-dipolo ente l'átomu d'hidróxenu que ta formando un enllaz polar, tal como N—H, O—H, ó F—H, y un átomu electronegativu como O, N ó F. Esta interaición representar de la siguiente forma:
A—H•••B A—H•••A
A y B representen O, ó F; A—H ye una molécula o parte d'una molécula y B ye parte d'otra. La llinia de puntos representa l'enllaz d'hidróxenu.
La enerxía media d'un enllaz d'hidróxenu ye abondo grande pa ser una interaición dipolo-dipolo (mayor de 40 KJ/mol). Esto fai que l'enllaz d'hidróxenu seya una de gran importancia a la de l'adopción de determinaes estructures y nes propiedaes de munchos compuestos.
Les primeres evidencies de la esistencia d'esti tipu d'interaición vinieron del estudiu de los puntos de ebullición. De normal, los puntos de ebullición de compuestos que contienen a elementos del mesmu grupu aumenten col pesu molecular. Pero, como puede reparase na figura, los compuestos de los elementos de los Grupos 15, 16 y 17 nun siguen esta norma. Pa cada unu de los grupos, los compuestos de menos pesu molecular (NH3, H2O, HF) tienen el puntu de bullidura más altu, en contra de lo que podría esperase en principiu. Ello ye por cuenta de qu'esiste dalgún tipu d'interaición ente les molécules n'estáu líquidu que s'opón al pasu al estáu de vapor. Esa interaición ye l'enllaz d'hidróxenu, y afecta a los primeros miembros de la serie pos son los más electronegativos, y por ello l'enllaz X-H ye'l más polarizáu, lo qu'induz la mayor interaición por ponte d'hidróxenu. Les pontes d'hidróxenu son especialmente fuertes ente les molécules d'agua y son la causa de munches de les singulares propiedaes d'esta sustancia. Los compuestos d'hidróxenu d'elementos vecín al osíxenu y de los miembros de la so familia na tabla periódica, son gases a la temperatura ambiente: CH4, NH3, H2S, H2Te, PH3, HCl. Sicasí, el H2O ye líquida a la temperatura ambiente, lo qu'indica un altu grau d'atraición intermolecular. Na figura puede vese que'l puntu de bullidura de l'agua ye 100 °C más altu de lo que cabría predicir si nun hubiera pontes d'hidróxenu. Les pontes d'hidróxenu xueguen tamién un papel crucial na estructura del ADN, la molécula qu'almacena la heriedu xenéticu de tolos seres vivos.{{cita riquida}
Fuercia de Van der Waals
Tamién conocíes como fuercies de dispersión, de London o fuercies dipolo-transitives, correspuenden a les interaiciones ente molécules con enllaces covalentes apolares por cuenta de fenómenos de polarización temporal. Estes fuercies esplicar de la siguiente forma: como les molécules nun tienen carga llétrica neta, en ciertos momentos, puede producise una distribución na qu'hai mayor densidá d'electrones nuna rexón que n'otra, polo qu'apaez un dipolo momentaneu.
Cuando dos d'estes molécules polarizaes y empobinaes convenientemente avérense lo suficiente ente dambes, puede asoceder que les fuercies llétriques curioses sían lo bastante intenses como pa crear uniones intermoleculares. Estes fuercies son bien débiles y amóntense col tamañu de les molécules.
[dipolo permanente] H-O-H----Cl-Cl [dipolo transitivu]
Un exemplu del segundu casu atópase na molécula de cloru:
(+) (-) (+) (-)
[dipolo transitivu] Cl-Cl----Cl-Cl [dipolo transitivu]
Atraiciones dipolo-dipolo
Una atraición dipolo-dipolo ye una interaición non covalente ente dos molécules polares o dos grupos polares de la mesma molécula si esta ye grande. Les molécules que son dipolos atraer ente sigo cuando la rexón positiva d'una ta cerca de la rexón negativa de la otra.
El so orixe ye electrostático y pueden entendese en función de la Llei de Coulomb. A mayor momentu dipolar mayor va ser la fuercia.[4]
Les atraiciones dipolo-dipolo, tamién conocíes como Keeson, por Willem Hendrik Keesom, quien produció la so primer descripción matemática en 1921, son les fuercies qu'asoceden ente dos molécules con dipolos permanentes. Estes funcionen de forma similar a les interaiciones ióniques, pero son más débiles por cuenta de que tienen solamente cargues parciales. Un exemplu d'esto pue ser vistu nel ácidu clorhídrico:
![]() tamién pueden dase ente una molécula con dipolo negativu y positivu coles mesmes, más un átomu normal ensin carga.
tamién pueden dase ente una molécula con dipolo negativu y positivu coles mesmes, más un átomu normal ensin carga.
Interaiciones ióniques
Son interaiciones qu'asoceden a nivel de catión-anión, ente distintes molécules cargaes, y que por lo mesmo van tender a formar una unión electrostática ente los estremos de cargues opuestes por cuenta de la atraición ente elles.
Un exemplu claru d'esto ye lo qu'asocede ente los estremos carboxilo y amino d'un aminoácidu, péptidu, polipéptidu o proteína con otru.
Fuercies de Maxwell o de dispersión
Les fuercies de Maxwell presentar en toles sustancies moleculares. Son la resultancia de l'atraición ente los estremos positivu y negativu de dipolos inducíos en molécules axacentes.
Inclusive los átomos de los gases nobles, les molécules de gases diatómicos como'l osíxenu, el nitróxenu y el cloru (que tienen de ser non polares) y les molécules d'hidrocarburos non polares como'l CH4, C2H6 tienen tales dipolos instantáneos.
La intensidá de les fuercies de Maxwell depende de la facilidá con que se polarizan los electrones d'una molécula, y eso depende del númberu d'electrones na molécula y de la fuercia con que los suxetar l'atraición nuclear. Polo xeneral, cuantos más electrones haya nuna molécula más fácilmente va poder polarizase. Asina, les molécules más grandes con munchos electrones son relativamente polarizables. En contraste, les molécules más pequeñes son menos polarizables porque tienen menos electrones. Les fuercies de Maxwell varien aproximao ente 0.05 y 40 kJ/mol.
Cuando esaminamos los puntos de ebullición de dellos grupos de molécules non polares llueu se fai evidente l'efeutu del númberu d'electrones. Esti efeutu tamién se correlaciona cola masa molar: cuanto más pesáu ye un átomu o molécula, más electrones tien: resulta interesante que la forma molecular tamién desempeña un papel na formación de les fuercies de Maxwell.
Dos de los isómeros del pentano –el pentano de cadena llinial y el 2,2-dimetilpropano (dambos cola fórmula molecular C5H12)- difieren na so puntu de bullidura en 27 °C. La molécula de n-pentano, pola so linealidad, dexa un contautu estrechu coles molécules axacentes, ente que la molécula de 2,2-dimetilpropano, más esférica nun dexa esi contautu.
Tabla 2. Efeutu del númberu d'electrones sobre'l puntu de bullidura de sustancies non polares
Gases nobles Halóxenos Hidrocarburos NºElec P.A P.E.°C NºElec P.M P.E.°C NºElec P.M P.E.°C He 2 4 -269 F2 18 38 -188 CH4 10 16 -161 Ne 10 20 -246 Cl2 34 71 -34 C2H6 18 30 -88 Ar 18 40 -186 Br2 70 160 59 C3H8 26 44 -42 Kr 36 84 -152 I2 106 254 184 C4H10 34 58 0
Fuercies ion-dipolo
Estes son interaiciones qu'asoceden ente especies con carga. Les cargues similares se repelen, ente que les opuestes atráense.
Ye la fuercia qu'esiste ente un ion y una molécula polar neutra que tien un momentu dipolar permanente. Les molécules polares son dipolos (tienen un estremu positivu y un estremu negativu). Los iones positivos son atraíos al estremu negativu d'un dipolo, en cuantes que los iones negativos son atraíos al estremu positivu, estes tienen enllaces ente sigo.
Les cargues de los cationes (carga llétrica positiva) tán más concentraes porque estos iones suelen ser más pequeños que los aniones(carga llétrica negativa). Arriendes d'ello, con una carga d'igual magnitú, un catión esperimenta una interaición más fuerte colos dipolos qu'un anión.[4]
La enerxía de la interaición depende de la carga sobre'l ion (Q), el momentu dipolar del dipolo (µ), y de la distancia del centru del ion al puntu mediu del dipolo (d).
Les fuercies ion-dipolo son importantes nes soluciones de les sustancies ióniques.
Un exemplu d'interaición ion-dipolo ye la hidratación. El calor de la hidratación ye la resultancia de la interaición favorable ente los cationes y aniones d'un compuestu iónicu cola agua.[4]
Efeutu de les fuercies intermoleculares en propiedaes físiques y químiques
Puesto que les fuercies intermoleculares esisten ente millones de molécules; esti modelu sirve pa esplicar de forma cualitativa como difieren les propiedaes físiques y químiques de distintes compuestos.[5]
- Estáu d'agregamientu
- Puntu y entalpía de fusión
- Puntu y entalpía de ebullición
- Solubilidá
- Densidá
- Mafa
Aportaciones
La ciencia buscó formes p'ampliar y facilitar la vida de les persones, ente estes formes atopóse que les interaiciones intermoleculares na estructuración de les proteínes son útiles pal desenvolvimientu de teunoloxíes médiques, como la creación de célules madres pa les terapies y l'estudiu d'enfermedaes, la manipulación de les proteínes pa torgar eczemas, la creación de les proteínes cuasi perfectes como secretu pa la llonxevidá y les nueves formes artificiales per mediu del xenoma humanu.
Llogru de célules madre
El Scripps Research Institute de San Diego afayó'l llogru de célules madres, que podría esaniciar la necesidá de destruyir embriones pa llograles y tener d'esa forma un métodu pa crear célules madre específiques por paciente usándoles en terapies y estudios d'enfermedaes como tumores, anemies, trestornos metabólicos conxénitos y defectos del sistema inmunolóxicu.
Dichu afayu consiste n'inxertar proteínes nes célules, faciendo que les interaiciones intermoleculares formen célules que vuelvan al so estáu primitivu y que puedan ser usaes como distintes célules del cuerpu. “Amás, el procesu, que foi probáu en célules de mures, nun implica la destrucción d'embriones nin óvulos, que ye lo que faía que les investigaciones con célules madre d'embriones provocara tanto discutiniu” (Pera, 2012).[6]
Manipulación de proteínes pa torgar eczemas
Deducióse que la proteína IL-21 puede conducir a tratamientos preventivos pal picor y la doliosa condición de la piel nel desenvolvimientu d'eczemas. El doctor Raif Geha, xefe de la división pediátrica d'alerxa ya inmunoloxía del Hospital Infantil de Boston y la Escuela Médica de Harvard, confirma la posibilidá de la manipulación d'estes proteínes pa torgar eczemas, ufiertando una prueba de que la IL-21 ye importante na formación de la enfermedá y podría abrir el camín de futuros tratamientos. Sicasí, una llimitación ye que al esperimentar con mures dalgunos d'estos nun desenvolvieron efeutos secundarios, polo tanto nun se sabe si pueda tener efeutos adversos nos seres humanos. “A pesar de los inconvenientes que surdieron, sigue esperimentándose por que a los manipoliar la estructura d'ésta proteína llógrese atopar la fórmula que pueda trepar colos eczemas” (Rockman, 2011).[7]
Les proteínes
Atopóse que'l secretu de la llonxevidá atopar nel usu de les proteínes cuasi perfectes. Nun artículu publicáu en Proceedings of the National Academy of Sciences, los investigadores Vera Gorbunova y Andrei Seluanov describen el descubrimientu de proteínes práuticamente perfectes, centrándose nos ribosomas de los aguarones topu, afayando que les hebras rRNA estremar en dos llugares específicos y refuguen el segmentu entemediu, en llugar de llexar fora pola so cuenta, los dos pieces restantes de cada filamentu permanecen cerca una de la otra y actúen como un andamiu sobre'l que se ensamblan les proteínes ribosomales pa crear un ribosoma. Cuando'l ribosoma coneuta los aminoácidos pa crear una proteína, produzse de xemes en cuando un error cuando s'enserta un aminoácidu incorrecto. Gorbunova y Seluanov afayaron que les proteínes producíes poles célules de los aguarones topu tienen hasta 40 vegaes menos de probabilidaes de contener errores que les proteínes producíes poles célules d'otros modelos, "Esto ye importante porque les proteínes ensin aberraciones ayuden al organismu a funcionar de manera más eficiente. Sicasí, entá falta enforma camino que percorrer por que a los momentu d'estremar el rRNA n'otros modelos esperimentales puédase modular la síntesis de les proteínes", (Seluanov, 2012).[8]
Nueves formes artificiales
La creación de nueves formes artificiales ye una nueva propuesta de teunoloxía que surde cola ideal de rediseñar la vida, esto ye, poder llegar a alteriar los xenomes de les persones dende cero tando entá nel úteru maternu y realizar cambeos y a forzar la maquinaria celular d'una bacteria o un lleldu por que sintetice aminoácidos artificiales y añader a les sos proteínes.
Amás, caltién la posibilidá de crear nueves formes vivientes nun curtiu plazu de tiempu, esto llega cola Bioloxía Sintética, que nun se conforma con namái aisllar, secuenciar, alteriar y tresplantar xenes d'una especie a otra, sinón qu'aspira a la construcción a gran escala de los sos propios sistemes biolóxicos artificiales que funcionen per mediu de circuitos y mecanismos biolóxicos.
El biólogu Drew Endy, líder del Grupu de Bioloxía sintética del Institutu Teunolóxicu de Massachusetts, afirma que pueden llegar a surdir col usu de les fuercies intermoleculares diseñando y edificando sistemes vivos que se porten de manera predecible y qu'operen con un códigu xenéticu espandíu artificialmente. Sicasí, Juan Valcárcel, Investigador del Llaboratoriu Européu de Bioloxía Molecular (EMBL) de Heidelberg, ta d'alcuerdu y cree que va ser posible intervenir na información xenética d'un embrión o sobre célules d'una persona pa correxir defectos xenéticos que dean llugar a enfermedaes hereditaries, como la fibrosis quística o l'atrofia espinal muscular, pero que va ser más difícil correxir defectos xenéticos que surden mientres la vida del organismu, como'l cáncer, yá que xeneralmente nun se da nun únicu xen.[9]
Biolóxiques
La diferencia ente un enllaz covalente ya interaiciones débiles non covalentes ye que los enllaces covalentes son los responsables de les estructures primaries, definen la composición ya identidá de cada biopolímero y les "configuraciones" qu'adopta cada grupu molecular, ente que les interaiciones débiles non covalentes son les responsables de la complexidá de les conformances que caractericen l'arquiteutura molecular de les macromolécules biolóxiques y los complexos supraestructurales, esto ye, les interaiciones intramoleculares (átomos o grupos moleculares dientro de les macromolécules) ya intermoleculares, polo que son fundamentales pa les funciones biolóxiques,[10] pero puede ser mayor la molécula.
Ver tamién
- Conceutos allegaos:
- Fuercies de cohesión: fuercies d'atraición ente molécules congruentes.
- Fuercies d'adhesión: fuercies d'atraición ente molécules distintes.
- Fuercies d'estensión o humectación: fuercies de dispersión d'unes molécules sobre una superficie.
- Enllaz intermolecular
- Enllaz químicu
- Llei del Octeto
- Química supramolecular
Referencies
- ↑ Rayner, R. (1995) Pump users handbook, 4th ed., Kidlington, Oxford, England: Elsevier Advanced Technology. ISBN 9781856172165.
- ↑ La Enciclopedia de les Ciencies y Teunoloxía en Méxicu (13 d'ochobre de 2009). «Química Supramolecular». Consultáu'l 22 de payares de 2013.
- ↑ Enllaz d'Hidróxenu.
- 1 2 3 Chang, Raymond (2007) Química, 10a ed., Méxicu: McGraw-Hill, páx. 494. ISBN 978-607-15-0307-7.
- ↑ Ortega, James Y. Huheey, Ellen A. Keiter y Richard L. Keiter ; traducción María Teresa Aguilar (1981) Química inorgánica : principios d'estructura y reactividá, 4. ed., Mexico: Harla. ISBN 9789706131621.
- ↑ Ding, S. (2012). «Les Proteínes: Llogru de Célules Madre». Consultáu'l 22 de payares de 2013.
- ↑ Geha, R. (2011). «Les proteínes: Manipulación de Proteínes pa torgar eczemas». Consultáu'l 22 de payares de 2013.
- ↑ El Médicu Interactivo (2012). «secretu-de-la llonxevidá La creación de proteínes cuasi perfectes pue ser el secretu de la llonxevidá». Consultáu'l 22 de payares de 2013.
- ↑ Coperías, Y. M. (2005). . Consultáu'l 22 de payares de 2013.
- ↑ Universidad de Granada. «Fuercies inter ya intramoleculares que determinen les estructures de les Macromolécules Biolóxiques». Consultáu'l 22 de payares de 2013.