Nun procesu químicu, el equilibriu químicu ye l'estáu nel que les actividaes químiques o les concentraciones de los reactivos y los productos nun tienen nengún cambéu netu nel tiempu. De normal, este sería l'estáu que se produz cuando una reaición reversible evoluciona escontra alantre na mesma proporción que la so reaición inversa. La velocidá de reaición de les reaiciones direuta ya inversa polo xeneral nun son cero, pero, si dambes son iguales, nun hai cambeos netos en cualesquier de les concentraciones de los reactivos o productos. Esti procesu denominar equilibriu dinámicu.[1][2]

Introducción
Nuna reaición química, cuando los reactivos entemecer nun recipiente de reaición (con calefaición, si ye necesariu), nun se converten en productos la totalidá de los reactivos. Dempués d'un tiempu (que depende de los compuestos que constitúin l'amiestu), les reaiciones opuestes, pueden algamar iguales velocidaes de reaición, creando un equilibriu dinámicu nel que la rellación ente los reactivos y productos va ser fixa.
El conceutu d'equilibriu químicu foi desenvueltu dempués de que Berthollet (1803) atopara que delles reaiciones químiques son reversibles. Por que una reaición, tal como
pueda tar n'equilibriu, les velocidaes de reaición direuta ya inversa tienen que ser iguales. Nesta ecuación química, con fleches apuntando en dambes direiciones pa indicar l'equilibriu, y son les especies químiques que reaccionen y son les especies productos, y , , y son los coeficientes estequiométricos de los reactivos y los productos. La posición d'equilibriu de la reaición dizse que ta bien movida a la derecha, si, nel equilibriu, cuasi tolos reactivos utilizóse y a la izquierda si solamente fórmase daqué de productu a partir de los reactivos.
Guldberg y Waage (1864), basándose nes idees de Berthollet, propunxeron la llei d'aición de mases:
Velocidá de reaición direuta:
Velocidá de reaición inversa:
onde , , y son mases actives y y son les constantes de velocidá. Cuando les velocidaes de la reaición direuta ya inversa son iguales:
y la rellación ente les constantes de velocidá ye tamién una constante, conocida agora como constante d'equilibriu.
Por conveniu, los productos constitúin el numberador. Sicasí, la llei d'aición de mases ye válida namái pa reaiciones que trescurren nuna etapa que dan en traviés d'un estáu de transición únicu y nun ye válidu, polo xeneral, porque les ecuaciones de velocidá siguen, polo xeneral, la estequiometría de la reaición como Guldberg y Waage propunxeron (vease, por casu, la sustitución nucleofílica alifática por SN1 o la reaición del hidróxenu y del bromu pa formar bromuru d'hidróxenu). La igualdá de les velocidaes de la reaición direuta y de la inversa, ye una condición necesaria pal equilibriu químicu, anque nun ye abondu pa esplicar por qué produz l'equilibriu. A pesar del fracasu d'esta derivación, la constante d'equilibriu pa una reaición ye de fechu una constante, independiente de les actividaes de les distintes especies arreyaes, anque depende de la temperatura, como s'aprecia pola ecuación de van't Hoff. La adición d'un catalizador afecta de la mesma forma tanto a la reaición direuta como a la reaición inversa y nun va tener un efeutu sobre la constante d'equilibriu. El catalizador acelera la velocidá de dambes reaiciones colo qu'aumenta la velocidá a la que s'algamar l'equilibriu.[3][4]
Anque les concentraciones d'equilibriu macroscópico son constantes nel tiempu les reaiciones producir nel nivel molecular. Por casu, nel casu d'acedu acético disueltu na agua y la formación d'acetato ya iones hidronio,
un protón puede saltar d'una molécula d'acedu acético a una molécula d'agua y depués a un ion acetato pa formar otra molécula d'acedu acético, dexando'l númberu de molécules d'acedu acético ensin cambeos. Este ye un exemplu d'equilibriu dinámicu. Los equilibrios, como'l restu de la termodinámica, son fenómenos estadísticos, los permedios del comportamientu microscópicu.
El principiu de Le Châtelier (1884) ye un útil principiu que da una idea cualitativa de la respuesta d'un sistema d'equilibriu ante cambeos nes condiciones de reaición. Si un equilibriu dinámicu ye alteriáu por camudar les condiciones, la posición d'equilibriu treslladar pa compensar el cambéu. Por casu, al añader más S dende l'esterior, va producise un escesu de productos, y el sistema va tratar de compensar esti cambéu aumentando la reaición inversa y emburriando el puntu d'equilibriu escontra tras (anque la constante d'equilibriu va siguir siendo la mesma).
Si amiéstase un ácidu mineral al amiestu d'acedu acético, l'aumentu de la concentración del ion hidronio, la disociación tien de menguar a midida que la reaición mover escontra a la izquierda, de conformidá con esti principiu. Esto tamién puede deducise de la espresión de la constante d'equilibriu pa la reaición:
si {H3O+} aumenta {CH3CO2H} tien d'aumentar y {CH3CO2−} tien de menguar.
El H2O se queda fuera yá que ye un líquidu puro y la so concentración nun ta definida.
Una versión cuantitativa vien dada pol cociente de reaición.
J.W. Gibbs suxurió en 1873 que l'equilibriu algámase cuando la enerxía de Gibbs del sistema ta nel so valor mínimu (suponiendo que la reaición llevar a cabu a presión constante). Lo qu'esto significa ye que la derivada de la enerxía de Gibbs con al respective de la coordenada de reaición (una midida de la estensión en que se produció la reaición, que van dende cero pa tolos reactivos a un máximu pa tolos productos) esmorezse, señalando un puntu estacionariu. Esta derivada suelse llamar, por ciertes razones téuniques, el cambéu d'enerxía de Gibbs.[5] Esti criteriu ye al empar necesariu y abondu. Si un amiestu nun ta n'equilibriu, la lliberación de la enerxía de Gibbs por demás (o la enerxía de Helmholtz nes reaiciones a volume constante) ye'l "motor" que camuda la composición del amiestu hasta que s'algamar l'equilibriu. La constante d'equilibriu puede rellacionase col cambéu de la enerxía llibre de Gibbs estándar de la enerxía pa la reaición per mediu de la ecuación:
onde ye la constante universal de los gases y la temperatura.
Cuando los reactivos tán eslleíos nun mediu d'alta fuercia iónico el cociente de los coeficientes d'actividá puede tomase como una constante. Nesti casu, el cociente de concentraciones ye, ,
onde ye la concentración de , etc, ye independiente de la concentración analítica de los reactivos. Por esta razón, les constantes d'equilibriu pa les soluciones suelen determinase en medios de fuercia iónico d'alta. varia cola fuercia iónico, temperatura y presión (o volume). Coles mesmes pa los gases depende de la presión parcial. Estes constantes son más fáciles de midir y atópense en cursos de química cimera.
Termodinámica
La rellación ente la enerxía de Gibbs y la constante d'equilibriu puede topase considerando potenciales químicos.[6] A temperatura y presión constantes, la enerxía llibre de Gibbs de la reaición namái depende de la estensión de la reaición (), y namái puede menguar acordies cola segunda llei de la termodinámica. Esto significa que la derivada de en función de tien de ser negativa si asocede la reaición. Nel equilibriu, la derivada ye igual a cero.
A volume constante, tien de considerase la enerxía llibre de Helmholtz pa la reaición: A.
Nesti artículu namái se considera'l casu de presión constante. El casu de volume constante ye importante en xeoquímica y química atmosférica, onde les variaciones de presión son importantes. Tenga en cuenta que, si los reactivos y los productos tán nel so tao estándar (dafechu pura), entós nun habría nengún reversibilidad y equilibriu. L'amiestu de los productos y reactivos contribúi con una gran entropía (conocida como entropía d'amiestu) a estaos que contienen amiestos a partes iguales de los productos y reactivos. La combinación del cambéu de la enerxía de Gibbs estándar y la enerxía de Gibbs d'amiestu determina l'estáu d'equilibriu.[7]
Polo xeneral, un sistema n'equilibriu defínese escribiendo una ecuación d'equilibriu pa la reaición
Col fin de cumplir la condición d'equilibriu termodinámicu, la enerxía de Gibbs tien de ser estacionariu, lo que significa que la derivada de G con al respective de la coordenada de reaición: 'ξ', ten de ser cero. Puede demostrase que nesti casu, la suma de los potenciales químicos de los productos ye igual a la suma de los correspondientes a los reactivos. Poro, la suma de les enerxíes de Gibbs de los reactivos tien de ser igual a la suma de les enerxíes de Gibbs de los productos:
onde μ ye nesti casu una enerxía molar parcial de Gibbs, un potencial químicu. El potencial químicu del reactivu A ye una función de l'actividá, {A} d'esi reactivu.
- ,
onde ye'l potencial químicu estándar.
Substituyendo espresiones como esta na ecuación de la enerxía de Gibbs:
nel casu d'un sistema zarráu.
O
- ,
onde:
- correspuende al coeficiente estequiométrico.
- ye'l diferencial d'una función diferencial de la coordenada de reaición.
A presión y temperatura constante llógrase:
que correspuende al cambéu de la enerxía llibre de Gibbs pa la reaición.
Resulta en:
Sustituyendo los potenciales químicos:
La rellación convertir en:
Onde:
que ye'l cambéu d'energía estándar de Gibbs de la reaición. Ye una constante a una temperatura determinao, que puede calculase utilizando tables termodinámiques.
Onde ye'l cociente de reaición cuando'l sistema nun ta n'equilibriu. Polo tanto:
Nel equilibriu:
Entós:
el cociente de reaición ye igual a la constante d'equilibriu. Esto conduz a:
y

Cambeos nel equilibriu cola adición de reactivos () o productos ()
Pa un sistema reaccionante n'equilibriu:
Si se valor de la constante d'equilibriu: modifiquen les actividaes de los componentes. Entós:
Polo tanto:
y
entós
Sabiendo que:
Entós:
- Si l'actividá d'un reactivu aumenta, el cociente de reaición mengua:
y
La reaición va movese a la derecha (esto ye, na direición de la reaición direuta, y polo tanto va formase mayor cantidá de productos.
- Si l'actividá d'un productu aumenta, entós:
y
La reaición va movese a la izquierda (esto ye, na direición de la reaición inversa, y polo tanto va formase menor cantidá de productos. Nótese que les actividaes y les constantes d'equilibriu son los númberos adimensionales.
Tratamientu de l'actividá
La espresión de la constante d'equilibriu puede escribise como'l productu d'un cociente de concentraciones y un cociente de coeficientes d'actividá, .
Onde ye la concentración d'un reactivu A. Ye posible, en principiu, llograr los valores de los coeficientes d'actividá (). Pa ello, pueden utilizase ecuaciones, como la ecuación de Debye-Hückel o estensiones como la ecuación de Davies,[8] o les ecuaciones de Pitzer,[9] Software (embaxo). Sicasí, esto non siempres ye posible. Ye una práutica común suponer que ye una constante, y utilizar el cociente de concentraciones nel llugar de la constante d'equilibriu termodinámica. Tamién ye una práutica xeneral utilizar el términu constante d'equilibriu” en llugar del más precisu de “cociente de concentraciones”. Esta práutica va siguise equí.
Pa les reaiciones en fase gaseosa, utilízase la presión parcial en llugar de la concentración y el coeficiente de fugacidad en vegada del coeficiente d'actividá. Nel mundu real, por casu, al fabricar l'amoniacu na industria, tienen de tenese en cuenta los coeficientes de fugacidad. La fugacidad, , ye'l productu de la presión parcial y el coeficiente de fugacidad. El potencial químicu d'una especie na fase gaseosa vien dau por ecuación|
- }}
polo que la espresión xeneral que define la constante d'equilibriu ye válida tantu pa les fases de solución y de gas.
Xustificación pal usu de los cocientes de concentración
En disolución aguacienta, les constantes d'equilibriu determinar xeneralmente en presencia d'un electrolitu “inerte” tal como'l nitratu de sodiu NaNO3 o'l perclorato de potasiu KClO4. La fuercia iónico, ”I”, d'una solución que contién un sal disuelto, X+Y-, vien dada por:
onde “c” representa la concentración, z representa la carga iónica y el sumatorio estender a toles especies n'equilibriu. Cuando la concentración de sal disuelto ye enforma mayor que les concentraciones d'analises de los reactivos, la fuercia iónico ye efeutivamente constante. Puesto que los coeficientes d'actividá dependen de la fuercia iónico los coeficientes d'actividá de les especies son efeutivamente independiente de la concentración. Con éses el camientu de que Γ ye constante, ta xustificada. El cociente de concentración ye un múltiplu simple de la constante d'equilibriu.[10]
Sicasí, Kc va variar cola fuercia iónico. Si midir nuna serie de distintes fuercies ióniques el valor de la fuercia iónico pue ser extrapolado a cero. El cociente de concentraciones llográu d'esta manera ye conocíu, paradóxicamente, como una constante d'equilibriu termodinámica. Pa utilizar un valor publicáu d'una constante d'equilibriu en condiciones de fuercia iónico distinta de les condiciones aplicaes na so determinación, el valor tien d'afaese Software (embaxo).
Amiestos metaestables
Un amiestu puede paecer que nun tien enclín a camudar, anque nun tea n'equilibriu. Por casu, un amiestu de SO2 y O2 ye metaestable yá que hai una Enerxía d'activación barrera cinética a la formación del productu, SO3.
- 2SO2 + O2 2SO3
La barrera puede superase cuando tamién hai un catalizador presente nel amiestu, como nel métodu de contautu, pero'l catalizador nun afecta a les concentraciones d'equilibriu. De la mesma, la formación de bicarbonatu a partir de dióxidu de carbonu y l'agua ye una reaición bien lenta en condiciones normales
- CO2 + 2H2O HCO3- +H3O+
pero cuasi instantánea en presencia de la enzima anhidrasa carbónica.
Compuestos puros n'equilibriu
Cuando les sustancies pures (líquidos o sólidos) tán implicaos nos equilibrios, elles nun apaecen na ecuación d'equilibriu.[11] Aplicando la fórmula xeneral pa una constante d'equilibriu nel casu específicu del ácidu acético llógrase
Puede suponese que la concentración d'agua ye constante. Esta hipótesis ye válida pa toles soluciones salvo les bien concentraes. La espresión de la constante d'equilibriu escríbese, poro, de normal como
onde agora ye un factor constante incorporáu a la constante d'equilibriu. Un casu particular ye l'auto-ionización de l'agua
La constante d'auto-ionización de l'agua defínese como:
Ye perfectamente llexítimu escribir [H+] pa la concentración d'ion hidróxenu, una y bones l'estáu de solvatación del protón ye constante (nes soluciones esleíes) y asina nun afecta a les concentraciones d'equilibriu. Kw varia cola variación na fuercia iónico y/o la temperatura. Les concentraciones de H+ y OH- nun son cantidaes independientes. La mayor parte de les vegaes [OH-] sustituyir por Kw[H+]-1 nes espresiones de la constante d'equilibriu que contienten hidróxidu. Los sólidos tampoco apaecen na ecuación de la constante d'equilibriu. Un exemplu ye la reaición Boudouard:[11]
pa la que la ecuación de la constante d'equilibriu (ensin carbonu sólido) escríbese como
Equilibrios múltiples
Consideremos el casu d'un ácidu dibásico H2. Cuando s'esllee na agua, l'amiestu va contener H2A, HAI- y A2-. Esti equilibriu puede estremase en dos pasos en cada unu de los cualos llibérase un protón.
K1 y K2 son exemplos de constantes d'equilibriu socesives”. La constante d'equilibriu global”, , ye'l productu de les constantes socesives
Tenga en cuenta qu'estes constantes son constantes de disociación porque los productos nel llau derechu de la espresión d'equilibriu son los productos de disociación. En munchos sistemes, ye preferible utilizar constantes d'asociación
y son exemplos de constantes d'asociación. Rescampla que y ; y .[12] Pa los sistemes d'equilibriu múltiple, vease tamién: teoría de les reaiciones de respuesta.
L'efeutu del cambéu de temperatura na constante d'equilibriu
L'efeutu d'un cambéu de temperatura na constante d'equilibriu vien dada pola ecuación de Van't Hoff
Asina, para reaiciones exotérmicas (), mengua col aumentu de la temperatura, pero, para reaiciones endotérmicas (), aumenta con un aumentu de la temperatura. Una formulación alternativa ye : A la primer vista esto paez ufiertar un mediu pa llograr la entalpía molar estándar de la reaición por aciu l'estudiu de la variación de cola temperatura. Na práutica, sicasí, el métodu ye pocu fiable, por cuenta del espardimientu d'errores, y cuasi siempres se llogren errores bien grandes nos valores calculaos d'esta manera.
Tipos d'equilibriu y de delles aplicaciones
- Na fase de gas. Motores cohete[13]
- En resume industrial, tal como'l amoniacu nel procesu Haber-Bosch que se lleva a cabu al traviés d'una socesión d'etapes d'equilibriu, incluyendo procesos d'absorción.
- Química de l'atmósfera
- L'agua de mar y otres agües naturales: Oceanografía química
- Distribución ente dos fases
- Coeficiente de distribución LogD: Importante pa la industria farmacéutico, onde la lipofilia ye una propiedá importante d'una droga ##
Estraición líquidu-líquidu, Intercambiu iónicu, Cromatografía
- producto Solubilidá
- Captación y lliberación d'osíxenu pola hemoglobina en sangrar
- Equilibriu acedu/base: constante de disociación aceda, hidrólisis, [[solución
tampón|soluciones tampón]], Indicadores, Homeostasis acedu-base
- Complejación metal-amestando: axentes quelantes, terapia de quelación, reactivos de contraste pa RM, equilibriu Schlenk
- Formación de aductos: química Host-guest, química supramolecular, reconocencia molecular, tetróxido de dinitrógeno
- En delles reaiciones trémboles, l'aproximamientu al equilibriu nun ye asintóticamente, sinón en forma d'una oscilación amortiguada.[11]
- La conocida ecuación de Nernst n'electroquímica da la diferencia de potencial d'electrodu como una función de les concentraciones redox.
- Cuando les molécules a cada llau del equilibriu son capaces de reaccionar irreversiblemente en reaiciones secundaries, la proporción del productu final determinar d'alcuerdu al principiu de Curtin-Hammett.
Nestes aplicaciones, utilícense términos como constante d'estabilidá, constante de formación, constante d'enllaz, constante d'afinidá, constante d'asociación/disociación.
Composición d'un amiestu n'equilibriu
Cuando l'únicu equilibriu ye'l de la formación de aductos de 1:1 como la composición d'un amiestu, hai delles formes en que puede calculase la composición del amiestu. Por casu, vease tabla ICE pa un métodu tradicional de calcular el pH d'una solución d'un ácidu débil. Hai tres métodos pal cálculu xeneral de la composición d'un amiestu n'equilibriu.
- L'enfoque más básicu consiste en manipoliar les distintes constantes d'equilibriu hasta que les concentraciones deseyaes espresar en términos de les constantes d'equilibriu midíes (equivalente a la midida de los potenciales químicos) y les condiciones iniciales.
- Embrivir la enerxía de Gibbs del sistema.[14]
- Satisfaer la ecuación de balance de masa. Les ecuaciones de balance de masa son a cencielles ecuaciones que demuestren que la concentración total de cada reactivu tien de ser constante según la llei de caltenimientu de la masa.
Resolviendo les ecuaciones de balance de masa
Polo xeneral, los cálculos son bastante complicaos. Por casu, nel casu d'un ácidu dibásico, H2A disueltu n'agua los dos reactivos pueden especificase como la base conxugada, A2- y como'l protón, H+. Les siguientes ecuaciones de balance de masa podríen aplicase igualmente a una base como la 1,2-diaminoetano, y nesi casu la base mesma ye designada como reactivu A.
Con TA como la concentración total d'especies A. Tengase en cuenta que ye costume omitir les cargues ióniques al escribir y utilizar estes ecuaciones. Cuando les constantes d'equilibriu son conocíos y les concentraciones totales tán especificaes hai dos ecuaciones con incógnites, les "concentraciones llibres" y . Esto deduzse del fechu de que , y .
asina les concentraciones de los "complexos" calcular a partir de les concentraciones llibres y de les constantes d'equilibriu. Espresiones xenerales aplicables a tolos sistemes con dos reactivos, A y B podríen ser
Ye fácil ver cómo esto se puede estender a trés o más reactivos.
Composición d'ácidos polibásicos como una función del pH
La composición de soluciones que contienen los reactivos A y H ye bono de calcular como una función del pH. Cuando se conoz la [H], la concentración llibre [A] calcular a partir de la ecuación de balance de masa n'A. Equí hai un exemplu de los resultaos que pueden llograse.
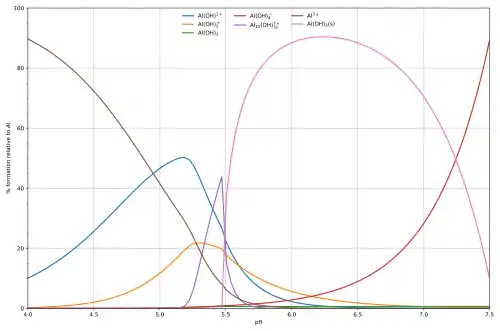
Esta diagrama, pa la hidrólisis del ácidu de Lewis aluminiu Al3+(ac)[15] amuesa les concentraciones de les especies pa una solución de 5×10-6M d'un sal d'aluminiu como una función del pH. Cada concentración amuésase como un porcentaxe del total d'aluminiu.
Equilibrios en solución con precipitación
La diagrama anterior ilustra'l puntu en que se forma un precipitáu que nun ye una de les principales especies nel equilibriu en solución. A pH per debaxo de 5,5 les principales especies presentes nuna solución 5 μM d'Al3+ son hidróxido d'aluminiu, Al(OH)2+, Al(OH)2+ y Al13(OH)327+, pero al alzar el pH bastia Al(OH)3 de la solución. Esto debe a que'l Al(OH)3 tien una enerxía de rede bien grande. A midida que el pH álzase más y más, l'Al(OH)3 sale de la solución. Este ye un exemplu del principiu de Le Châtelier n'aición: Un aumentu de la concentración de ion hidróxidu [OH- causa que más hidróxidu d'aluminiu bastie, esaniciando hidróxidu de la solución. Cuando la concentración d'hidróxidu vuélvese lo suficientemente alta fórmase aluminato soluble, Al(OH)4-. Otru exemplu común ye aquel en que la precipitación produzse cuando un catión metálicu interactúa con un amestando aniónico pa formar un complexu eléctricamente neutru. Si'l complexu ye hidrofóbicu, bastia fora de l'agua. Esto asocede col ion níquel Ni2+ y dimetilglioxima, (dmgH2): nesti casu la enerxía de rede del sólidu nun ye particularmente grande, pero entepasa llargamente la enerxía de solvatación de la molécula de Ni(dmgH)2.
Minimización de la enerxía de Gibbs
Nel equilibriu, ye un mínimu:
pa un sistema zarráu, ensin partícules que puedan entrar o salir, anque puedan combinase de delles maneres. El númberu total d'átomos de cada elementu va permanecer constante. Esto significa que l'amenorgamientu al mínimu anterior ta sometida a restricciones:
ónde ye'l númberu d'átomos del elementu i na molécula j y 'bi0 ye'l númberu total d'átomos del elementui, que ye constante, una y bones el sistema ye zarráu. Si hai un total de k tipos d'átomos nel sistema, entós va haber k ecuaciones d'estes. Este ye un problema estándar n'optimización, conocíu como minimización acutada. El métodu más común de resolvelo ye por aciu el métodu de los multiplicadores de Lagrange, tamién conocíu como de los multiplicadores indeterminaos (anque tamién pueden utilizase otros métodos). Define:
onde son los multiplicadores de Lagrange, unu pa cada elementu. Esto dexa que cada unu de los seya tratáu de forma independiente, y puede demostrase por aciu les ferramientes del cálculu multivariante que la condición d'equilibriu vieneá dada por:
- y
(P'afondar ver multiplicadores de Lagrange). Este ye un conxuntu de (m + k) ecuaciones con "(m + k) incógnites ( and the ) y puede, por tanto, resolvese pa les concentraciones d'equilibriu siempres y cuando los potenciales químicos sían conocíos como funciones de les concentraciones a la temperatura y presión daes. (Vease bases de datos termodinámiques pa sustancies pures). Esti métodu de cálculu de les concentraciones químiques d'equilibriu ye útil pa los sistemes con un gran númberu de molécules distintes. L'usu de kecuaciones de caltenimientu del elementu atómicu pa la restricción de la masa ye senciella, y sustitúi l'usu de les ecuaciones de coeficiente estequiométrico.[13]
Espontaneidá
Pa determinar si un procesu ye o non bonal, hai que tomar en considerancia la variación de la entalpía y de la entropía, yá que delles vegaes contradícense. Per un sitiu, la entalpía diznos qu'un procesu tiende a la espontaneidá, ente que la entropía manifiesta lo contrario. Asina, ye necesariu evaluar a dambes pa establecer si un procesu definitivamente ye o non bonal en ciertes condiciones.
La enerxía llibre de Gibbs, , ye la enerxía lliberada por un sistema pa realizar trabayu útil a presión constante. Considera dambos cambeos de tala forma que:
La variación de la enerxía llibre , ye una función d'estáu y tien unidaes d'enerxía. Asina, si nuna reaición química llibérase trabayu útil ensin importar lo qu'asoceda nel universu'l ye negativu y polo tanto va ser una reaición bonal, yá que considera la dispersión de la enerxía y la dispersión de la materia nel sistema.
D'esta manera, si una reaición asocede a baxes temperatures con un cambéu pequeñu d'entropía, entós el términu va ser insignificante y va depender principalmente de .
Les reaiciones endotérmicas asoceden solamente si ye grande. La temperatura tien que ser alta o tien qu'haber aumentu grande na entropía por que predomine esti términu y seya el que determine'l valor del .
Si:
La reaición ye bonal nel sentíu establecíu.
La reaición nun ye bonal nel sentíu establecíu.
El sistema ta n'equilibriu.
La enerxía estándar de reaición, ye'l cambéu de la enerxía estándar de productos menos el cambéu de la enerxía estándar de reactivos
Onde:
- ye'l coeficiente estequiométrico de los productos.
- ye la variación d'enerxía llibre estándar de productos.
- ye'l coeficiente estequiométrico de los reactivos.
- ye la variación d'enerxía llibre estándar de reactivos.
Considerar pa los elementos na so forma más estable en condiciones estándares .[17]
Ver tamién
- Constante d'equilibriu
- Determinación de constantes d'equilibriu
- Principiu de Le Châtelier
- Ecuación de Henderson-Hasselbalch
- Cinética de Michaelis-Menten
- Equilibriu redox
- Base de datos termodinámicos pa sustancies pures
- Reaiciones autocatalíticas y orde de reaición
- Sobre l'equilibriu de les sustancies heteroxénees
Referencies
- ↑ Atkins & Jones, 2001
- ↑ Gold Book definition Link
- ↑ Chemistry: Matter and Its Changes James Y. Brady, Fred Senese 4th Ed. ISBN 0-471-21517-1
- ↑ Chemical Principles: The Quest for Insight Peter Atkins, Loretta Jones 2nd Ed. ISBN 0716757010
- ↑ Physical Chemistry by Atkins and De Paula, 7th Ed. ISBN 978-0-7167-3539-7
- ↑ P.W. Atkins, Physical Chemistry, third edition, Oxford University Press, 1985.
- ↑ a) Mary Jane Schultz. Why Equilibrium? Understanding the Role of Entropy of Mixing. Journal of Chemical Education 1999, 76, 1391. b) Clugston, Michael J. A mathematical verification of the second law of thermodynamics from the entropy of mixing. Journal of Chemical Education 1990, 67, 203.
- ↑ C.W. Davies, Ion Association,Butterworths, 1962
- ↑ I. Grenthe and H. Wanner, Guidelines for the extrapolation to zero ionic strength, http://www.nea.fr/html/dbtdb/guidelines/tdb2.pdf
- ↑ F.J,C. Rossotti and H. Rossotti, The Determination of Stability Constants, McGraw-Hill, 1961
- 1 2 3 Concise Encyclopedia Chemistry 1994 ISBN 0-89925-457-8
- ↑ M.T. Beck, Chemistry of Complex Equilibria, Van Nostrand, 1970. 2nd. Edition by M.T. Beck and I Nagypál, Akadémiai Kaidó, Budapest, 1990.
- 1 2 NASA Reference publication 1311, Computer Program for Calculation of Complex Chemical Equilibrium Compositions and Applications
- ↑ Esti enfoque describir en detalle nel W. R. Smith and R. W. Missen, Chemical Reaction Equilibrium Analysis: Theory and Algorithms,, Krieger Publishing, Malabar, Fla, 1991 (una reimpresión, con correiciones, del mesmu títulu por John Wiley & Sons, 1982). Un tratamientu integral de la teoría de los equilibrios de les reaiciones químiques y el so cálculu. Detalles en http://www.mathtrek.com/
- ↑ La diagrama creáu col programa HySS
- ↑ «Proyeutu INFOCAB SB 202507». Consultáu'l 9 de marzu de 2016.
- ↑ Solsvik, Jannike; Haug-Warberg, Tore; Jakobsen, Hugo A. (2 de febreru de 2016). «Implementation of chemical reaction equilibrium by Gibbs and Helmholtz energies in tubular reactor models: Application to the steam–methane reforming process». Chemical Engineering Science 140: páxs. 261–278. doi:. http://www.sciencedirect.com/science/article/pii/S0009250915006776. Consultáu'l 9 de marzu de 2016.
Pa lleer más
- F. Van Zeggeren and S.H. Storei
, The Computation of Chemical Equilibria, Cambridge University Press, 1970. Mainly concerníi with gas-phase equilibria.
- D. J. Leggett (editor), Computational Methods for the Determination of Formation Constants, Plenum Press, 1985.
- A.Y. Martell and R.J. Motekaitis, The Determination and Use of Stability Constants, Wiley-VCH, 1992.
- P. Gans, Stability Constants: Determination and Uses, an interactive CD, Protonic Software (Leeds), 2004
Programes d'ordenador pal cálculu de les concentraciones de les especies
Hai "n" ecuaciones de balance de mases con Nconcentraciones desconocíes llibres. Esto constitúi un conxuntu d'ecuaciones non lliniales que tien de ser resueltu por un métodu d'aproximamientos socesivos. El métodu más comúnmente utilizáu ye'l métodu de Newton-Raphson, que foi oxetu de numberoses publicaciones. Dellos programes informáticos xenerales figuren nesta llista.
- HySS Simulación de valoraciones y cálculos d'especies.
- EQS4WIN Un programa d'ordenador potente desenvueltu orixinalmente pal equilibriu en fase gaseosa, pero darréu estendíu a aplicaciones én xeneral. Utiliza l'enfoque de minimización d'enerxía de Gibbs.
- CHEMEQL Un programa informáticu integral pal cálculu de les concentraciones d'equilibriu termodinámicu d'especies en sistemes homoxéneos y heteroxéneos. Munches aplicaciones xeoquímiques.
- WinSGW Una versión de Windows del programa informáticu SOLGASWATER.
- Visual MINTEQ Una versión de Windows de MINTEQA2 (ver 4.0). MINTEQA2 ye un modelu d'equilibriu químicu pal cálculu de la especiación de metales, etc Equilibrios de solubilidá de les agües naturales.
- MINEQL+ Un sistema modelu d'equilibriu químicu pa sistemes aguacientos. Remana una amplia gama d'escenarios de pH, redox, solubilidá y absorción.
Software pal equilibriu químicu
- Aqua solution software Un conxuntu de seis programes informáticos específicos para:
- Teoría de la interaición específica. Una base de datos de los parámetros editables SIT publicaos, **
Estimación de parámetros SIT y l'axuste de les constantes d'estabilidá pa cambeos na fuercia iónico, ** Cálculu de los coeficientes d'actividá d'electrolitos, coeficientes d'actividá iónica, coeficientes osmóticos, ** Cálculu de los equilibrios acedu-base en soluciones d'electrolitos y agua de mar, ** Cálculu de la solubilidá d'O2 n'agua, soluciones d'electrolitos, fluyíos naturales, y agua de mar en función de la temperatura, concentración, salín, altitú, presión esterna, mugor, y ** Predicción de la dependencia de la temperatura de los valores de LgK utilizando distintos modelos termodinámicos
- JESS: Una poderosa ferramienta d'investigación pa la ellaboración de modelos termodinámicos y cinéticos de la especiación química en redolaes aguacientes complexos.
- Calculadora d'equilibriu químicu
- Misión a Marte - Un tutorial de química pa estudiantes de secundaria
Enllaces esternos