تيلوريوم
التيلوريوم (ملاحظة 1) عنصر كيميائي في الجدول الدوري، رمزه Te، وله العدد الذري 52.[3][4][5] وهو من أشباه المعادن، هش، ذو لون رمادي فضي، وهو يشبه القصدير. التيلوريوم عنصر هش، قليل السمية، ونادر، هو شبه فلز أبيض فضي. يرتبط التيلوريوم كيميائيًا بالسيلينيوم والكبريت، وكلها ثلاثة مواد كالكوجينية. يوجد أحيانًا في شكل أصلي كبلورات عنصرية. يعتبر التيلوريوم أكثر شيوعًا في الكون ككل منه على الأرض. ترجع ندرته الشديدة في قشرة الأرض، التي يمكن مقارنتها مع البلاتين، جزئيًا إلى تكوينه لهيدريد متطاير تسبب في فقد التيلوريوم في الفضاء كغاز أثناء تكوين السديم الساخن للأرض.[6]
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المظهر | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
رمادي فضي لمّاع | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص العامة | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الاسم، العدد، الرمز | تيلوريوم، 52، Te | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| تصنيف العنصر | شبه فلز | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 16، 5، p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكتلة الذرية | 127.60 غ·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع إلكتروني | Kr]؛ 4d10 5s2 5p4] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 8, 18, 18, 6 (صورة) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الفيزيائية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الطور | صلب | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | 6.24 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| كثافة السائل عند نقطة الانصهار | 5.70 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الانصهار | 722.66 ك، 449.51 °س، 841.12 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الغليان | 1261 ك، 988 °س، 1810 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة الانصهار | 17.49 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة التبخر | 114.1 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | 25.73 جول·مول−1·كلفن−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ضغط البخار | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الذرية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| أرقام الأكسدة | 6, 5, 4, 2, -2 (أكاسيده حمضية ضعيفة) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكهرسلبية | 2.1 (مقياس باولنغ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| طاقات التأين | الأول: 869.3 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثاني: 1790 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثالث: 2698 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر ذري | 140 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر تساهمي | 4±138 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر فان دير فالس | 206 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| خواص أخرى | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| البنية البلورية | نظام بلوري سداسي[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المغناطيسية | مغناطيسية معاكسة[2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الناقلية الحرارية | (1.97–3.38) واط·متر−1·كلفن−1 (300 كلفن) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سرعة الصوت (سلك رفيع) | 2610 متر/ثانية (20 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل يونغ | 43 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل القص | 16 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل الحجم | 65 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة موس | 2.25 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة برينل | 180 ميغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رقم CAS | 13494-80-9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر التيلوريوم | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
تم اكتشاف المركبات الحاملة للتيلوريوم لأول مرة في عام 1782 في منجم ذهب في كلاينشلاتن، ترانسيلفانيا (الآن زلاتنا، رومانيا) بواسطة عالم المعادن النمساوي فرانز جوزيف مولر فون رايشنشتاين، على الرغم من أن مارتن هاينريش كلابروث هو الذي أطلق على العنصر الجديد في عام 1798 بعد الكلمة اللاتينية عن «الأرض»، تيلوس . تعد معادن تيلورايد الذهب من أبرز مركبات الذهب الطبيعي. ومع ذلك، فهي ليست مصدرًا مهمًا تجاريًا للتيلوريوم نفسه، والذي يتم استخراجه عادةً كمنتج ثانوي لإنتاج النحاس والرصاص.
من الناحية التجارية، فإن الاستخدام الأساسي للتيلوريوم هو النحاس (نحاس التيلوريوم) وسبائك الفولاذ، حيث يحسن من إمكانية التشغيل الآلي. تستهلك التطبيقات في الألواح الشمسية CdTe وأشباه موصلات الكادميوم تيلورايد أيضًا جزءًا كبيرًا من إنتاج التيلوريوم. يعتبر التيلوريوم عنصرًا حيويًا من الناحية التكنولوجية.
التيلوريوم لا يوجد لديه وظيفة بيولوجية، على الرغم من الفطريات يمكن استخدامه بدلا من الكبريت والسيلينيوم في الأحماض الأمينية مثل تيلوروسيستين ونظائر التيلوريوم.[7] في البشر، يتم استقلاب التيلوريوم جزئيًا إلى ثنائي ميثيل تيلورايد، (CH 3) 2 Te، وهو غاز برائحة تشبه رائحة الثوم يتم استنشاقه في أنفاس ضحايا التعرض للتيلوريوم أو التسمم.
مميزات
الخصائص الفيزيائية
يحتوي التيلوريوم على نوعين من التآصل، بلوري وغير متبلور. عندما يكون التيلوريوم متبلورًا، يكون أبيض فضي مع بريق معدني. البلورات هي ثلاثي الزوايا ومراوان (مجموعة الفضاء 152 أو 154 حسب شرليتي)، مثل النموذج الرمادي من السيلينيوم. إنه معدن هش وسهل المسحوق. التيلوريوم غير المتبلور عبارة عن مسحوق أسود بني محضر عن طريق ترسبه من محلول حمض التيلوريك أو حمض التيلوريك (Te (OH) 6).[8] التيلوريوم هو أشباه موصلات تُظهر موصلية كهربائية أكبر في اتجاهات معينة اعتمادًا على المحاذاة الذرية ؛ تزداد الموصلية قليلاً عند تعرضها للضوء (الموصلية الضوئية).[9] عندما يذوب، يكون التيلوريوم مادة أكالة للنحاس والحديد والفولاذ المقاوم للصدأ. من بين الكالكوجينات (عناصر عائلة الأكسجين)، يحتوي التيلوريوم على أعلى نقاط انصهار وغليان، عند 722.66 ك (449.51 °م) و 1,261 ك (988 °م)، على التوالي.[10]
الخواص الكيميائية
يتكون التيلوريوم البلوري من سلاسل حلزونية متوازية من ذرات Te، مع ثلاث ذرات في كل منعطف. هذه المادة الرمادية تقاوم الأكسدة عن طريق الهواء وهي غير متطايرة.
النظائر
يتكون التيلوريوم بشكل طبيعي من ثمانية نظائر. ستة من هذه النظائر، 120 Te، 122 Te، 123 Te، 124 Te، 125 Te، و 126 Te، مستقرة. الاثنان الآخران، 128 Te و 130 Te، وجد أنهما مشعان قليلاً، [11][12][13] مع نصف عمر طويل للغاية، بما في ذلك 2.2 × 10 و 24 سنة مقابل 128 Tr . هذا هو أطول نصف عمر معروف بين جميع النويدات المشعة [14] ويبلغ حوالي 160 تريليون (10 12) ضعف عمر الكون المعروف. تشتمل النظائر المستقرة على 33.2٪ فقط من التيلوريوم الطبيعي.
ومن المعروف أن هناك 31 نظيرًا مشعًا اصطناعيًا من التيلوريوم، بكتل ذرية تتراوح من 104 إلى 142 وبعمر نصف يبلغ 19 يومًا أو أقل. أيضًا، هناك 17 أيزومرًا نوويًا معروفًا، مع فترات نصف عمر تصل إلى 154 يومًا. باستثناء البريليوم -8 وفروع انبعاث ألفا المتأخرة بيتا في بعض النويدات الأخف، فإن التيلوريوم (من 104 Te 109 - Te) هو العنصر الأخف وزناً الذي يحتوي على نظائر معروف أنها تخضع لاضمحلال ألفا.[11]
الكتلة الذرية للتيلوريوم (127.60) يتجاوز اليود (126.90)، العنصر التالي في الجدول الدوري.[15]
حقيقة
مع وجود وفرة في قشرة الأرض مماثلة لتلك الموجودة في البلاتين (حوالي 1 ميكروغرام / كغ)، التيلوريوم هو أحد أندر العناصر الصلبة الثابتة.[16] بالمقارنة، حتى الثوليوم، وهو أندر اللانثانيدات المستقرة، لديه وفرة قشرية تبلغ 500 ميكروغرام / كغ (انظر وفرة العناصر الكيميائية).[17]
إن ندرة التيلوريوم في قشرة الأرض ليست انعكاسًا لوفرة الكون. التيلوريوم أكثر وفرة من الروبيديوم في الكون، على الرغم من أن الروبيديوم أكثر وفرة بـ 10000 مرة في القشرة الأرضية. يُعتقد أن ندرة التيلوريوم على الأرض ناتجة عن ظروف أثناء الفرز المسبق في السديم الشمسي، عندما تم التحكم في الشكل المستقر لعناصر معينة، في غياب الأكسجين والماء، بواسطة القوة الاختزالية للهيدروجين الحر. في ظل هذا السيناريو، تم استنفاد بعض العناصر التي تشكل هيدرات متطايرة، مثل التيلوريوم، بشدة من خلال تبخر هذه الهيدرات. يعتبر التيلوريوم والسيلينيوم من العناصر الثقيلة الأكثر استنفادًا من خلال هذه العملية.[6]
وجدت تيليريوم أحيانا في شكله الأصلي (أي عنصر)، ولكن في كثير من الأحيان وجدت مثل تيلوريدس من الذهب مثل كالافريت وكرينيريت (مختلفين الكريات البيضاء من AuTe 2)، بيتزيت، Ag3AuTe2 وسلفانيت، AgAuTe 4 . تم تسمية بلدة تيلورايد بولاية كولورادو على أمل حدوث إضراب من تيلورايد الذهب (الذي لم يتحقق أبدًا، على الرغم من العثور على خام المعدن الذهبي). عادة ما يتم العثور على الذهب نفسه غير مرتبط، ولكن عندما يتم العثور عليه كمركب كيميائي، فإنه غالبًا ما يتم دمجه مع التيلوريوم.
على الرغم من وجود التيلوريوم مع الذهب في كثير من الأحيان أكثر منه في شكل غير مجمع، إلا أنه تم العثور عليه في كثير من الأحيان على شكل تيلورايد للمعادن الأكثر شيوعًا (مثل الميلونيت، النيكل 2). الطبيعية تيلوريت وتيلورات تحدث المعادن أيضا، التي شكلتها أكسدة تيلوريدس بالقرب من سطح الأرض. على عكس السيلينيوم، لا يحل التيلوريوم عادة محل الكبريت في المعادن بسبب الاختلاف الكبير في نصف قطر الأيونات. وهكذا، تحتوي العديد من معادن الكبريتيد الشائعة على كميات كبيرة من السيلينيوم وآثار من التيلوريوم فقط.[18]
في اندفاع الذهب عام 1893، نبذ عمال المناجم في كالغورلي مادة بيريتية أثناء بحثهم عن الذهب الخالص، واستخدمت لملء الحفر وبناء الأرصفة. في عام 1896، تم اكتشاف أن المخلفات عبارة عن كالافريت، تيلورايد من الذهب، وأثارت اندفاعًا ثانيًا للذهب شمل التعدين في الشوارع.[19]
تاريخ

تم اكتشاف التيلوريوم (تيلوس اللاتيني الذي يعني «الأرض») في القرن الثامن عشر في خام الذهب من المناجم في كلاينشلاتن (زلاتنا اليوم)، بالقرب من مدينة ألبا يوليا اليوم، رومانيا. كان يُعرف هذا الخام باسم «خام الذهب الورقي الأبيض من فازباخا» (بالألمانية: Faczebajer weißes blättriges Golderz، الاسم الألماني لـ Facebánya، والآن Fața Băii في مقاطعة ألبا) أو بيريت الذهب المضاد للدم (بالألمانية:antimonalischer Goldkies).[20][21] في عام 1782، خلص فرانز جوزيف مولر فون رايشنشتاين، الذي كان يشغل منصب كبير المفتشين النمساويين للمناجم في ترانسيلفانيا، إلى أن الخام لا يحتوي على الأنتيمون ولكنه يحتوي على كبريتيد البزموت.[22] في العام التالي، ذكر أن هذا كان خاطئًا وأن الخام يحتوي في الغالب على ذهب ومعدن غير معروف يشبه إلى حد بعيد الأنتيمون. بعد تحقيق شامل استمر ثلاث سنوات وشمل أكثر من خمسين اختبارًا، حدد مولر الثقل النوعي للمعادن ولاحظ أنه عند تسخينه، يصدر المعدن الجديد دخانًا أبيض برائحة تشبه الفجل ؛ أنه يضفي لونًا أحمر على حامض الكبريتيك؛ وأنه عندما يتم تخفيف هذا المحلول بالماء، يكون له ترسبات سوداء. ومع ذلك، لم يكن قادرًا على تحديد هذا المعدن وأعطاه الاسمين متناقض الذهب (aurum paradoxum) ومشكلة المعدن (metallum problematicum)، لأنه لم يُظهر الخصائص المتوقعة للأنتيمون.[23][24][25]
في عام 1789، اكتشف العالم المجري بال كيتايبيل العنصر بشكل مستقل في خام من دويتش بيلسن كان يُنظر إليه على أنه موليبدينيت أرجنتيفيول، لكنه أعطى الفضل لاحقًا لمولر. في عام 1798، تم تسميته من قبل مارتن هاينريش كلابروث، الذي كان قد عزله في وقت سابق عن الكالافيريت المعدني.[24][25][25][26]
جلبت الستينيات من القرن الماضي زيادة في التطبيقات الكهروحرارية للتيلوريوم (مثل البزموت تيلورايد)، وفي سبائك الصلب الخالية من الآلات، والتي أصبحت الاستخدام المهيمن.[27]
إنتاج
يتم الحصول على معظم Te (و Se) من رواسب النحاس السماقي، حيث يحدث بكميات ضئيلة.[28] يتم استرداد العنصر من حمأة الأنود من التنقية الإلكتروليتية للنحاس المنفّط. وهو أحد مكونات الغبار من أفران تكرير الرصاص. عادةً ما ينتج عن معالجة 1000 طن من خام النحاس 1 كيلوغرام (2.2 رطل) من التيلوريوم.
تحتوي حمأة الأنود على سيلينيدات وتيلورايد للمعادن النبيلة في مركبات لها الصيغة M 2 Se أو M 2 Te (M = Cu، Ag، Au). عند درجات حرارة 500 درجة مئوية، يتم تحميص حمأة الأنود مع كربونات الصوديوم تحت الهواء. يتم تقليل أيونات المعادن إلى المعادن، بينما يتم تحويل التيلورايد إلى تيلوريت الصوديوم.[29]
يمكن ترشيح التيلوريت من الخليط بالماء وعادة ما تكون موجودة على شكل هيدرووتيلوريت HTeO 3 - في محلول. تتشكل السيلينيت أيضًا أثناء هذه العملية، ولكن يمكن فصلها عن طريق إضافة حمض الكبريتيك. يتم تحويل الهيدروتيل لوريت إلى ثاني أكسيد التيلوريوم غير القابل للذوبان بينما تبقى السيلانيت في المحلول.[29]
ينتج المعدن من الأكسيد (المختزل) إما عن طريق التحليل الكهربائي أو عن طريق تفاعل ثاني أكسيد التيلوريوم مع ثاني أكسيد الكبريت في حمض الكبريتيك.[29]
عادةً ما يتم تسويق التيلوريوم التجاري كمسحوق 200 شبكة ولكنه متاح أيضًا على شكل ألواح أو سبائك أو عصي أو كتل. كان سعر نهاية العام للتيلوريوم في عام 2000 هو 14 دولارًا أمريكيًا للرطل. في السنوات الأخيرة، ارتفع سعر التيلوريوم بسبب زيادة الطلب والعرض المحدود، حيث وصل إلى 100 دولار أمريكي للرطل في عام 2006.[30][31] على الرغم من التوقعات بأن أساليب الإنتاج المحسنة ستضاعف الإنتاج، إلا أن وزارة الطاقة الأمريكية (DoE) تتوقع نقصًا في المعروض من التيلوريوم بحلول عام 2025.[32]
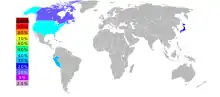
يتم إنتاج التيلوريوم بشكل رئيسي في الولايات المتحدة وبيرو واليابان وكندا.[33] تعطي هيئة المسح الجيولوجي البريطانية أرقام الإنتاج التالية لعام 2009: الولايات المتحدة 50 t، بيرو 7 t، اليابان 40 t وكندا 16 t.[34]
مركبات
ينتمي التيلوريوم إلى عائلة عناصر الكالكوجين (المجموعة 16) في الجدول الدوري، والتي تشمل أيضًا الأكسجين والكبريت والسيلينيوم والبولونيوم: مركبات التيلوريوم والسيلينيوم متشابهة. يعرض التيلوريوم حالات الأكسدة −2 و +2 و +4 و +6، مع كون +4 أكثر شيوعًا.[8]
تيلوريدس
الحد من الشركة المصرية للاتصالات المعادن تنتج تلوريد وبولي تيلورايد، تي ن 2-. يتم عرض حالة الأكسدة −2 في مركبات ثنائية تحتوي على العديد من المعادن، مثل تيلورايد الزنك، ZnTe، الناتج عن تسخين التيلوريوم بالزنك.[35] ZnTe عن تحلل ZnTe مع حمض الهيدروكلوريك تيلوريد الهيدروجين (H2Te)، نظير غير مستقر للغاية لهيدرات الكالكوجين الأخرى H2O، H2S وH2Se :
H2Te غير مستقر، بينما أملاح قاعدته المترافقة [TeH] - مستقرة.
هاليدات
يتم عرض حالة الأكسدة +2 بواسطة ثنائي الهاليدات، TeCl2، TeBr2 و TeI2. لم يتم الحصول على ثنائي الهاليدات في شكل نقي، [36] :274على الرغم من أنها منتجات تحلل معروفة لرباعي الهاليدات في المذيبات العضوية، إلا أن مركبات رباعي الهالوتيل المشتقة تتميز جيدًا:
حيث X هي Cl، Br، أو I. هذه الأنيونات مستوية في الهندسة.[36] :281توجد أيضًا أنواع أنيونية متعددة النوى، مثل Te
2 I62− ، [36] :283والأسود Te
4 I142− .[36] :285
مع الفلور تشكل Te2F4 التكافؤ المختلط وTeF6 . في حالة الأكسدة +6، فإن –OTeF5 مجموعة هيكلية تحدث في عدد من المركبات مثل HOTeF5 ، B(OTeF5)3، Xe(OTeF5)2، Te(OTeF5)4 و Te(OTeF5)6 .[37] أنيون مربع مضاد TeF82− هو أيضا يشهد.[29] لا تشكل الهالوجينات الأخرى هاليدات مع التيلوريوم في حالة الأكسدة +6، ولكن فقط رباعي الهاليدات (TeCl4 ، TeBr4 وTeI4) في حالة +4، والهاليدات السفلية الأخرى (Te3Cl2، Te2Cl2، Te2Br2 ، Te2I من TeI). في حالة الأكسدة +4، تُعرف الأنيونات هالوتيلورات، مثل TeCl62− و Te2Cl102− . تم توثيق كاتيونات هالوتيلوريوم أيضًا، بما في ذلك TeI3+، وجدت في TeI3AsF6.[38]
المركبات المؤكسدة

تم الإبلاغ عن أول أكسيد التيلوريوم لأول مرة في عام 1883 كمادة صلبة سوداء غير متبلورة تكونت من التحلل الحراري لـ TeSO3 TeSO3 في الفراغ، غير متناسب في ثاني أكسيد التيلوريوم، TeO2 وعنصر التيلوريوم عند التسخين.[39][40] منذ ذلك الحين، ومع ذلك، فإن الوجود في الطور الصلب مشكوك فيه ومتنازع عليه، على الرغم من أنه يُعرف باسم جزء بخار؛ قد تكون المادة الصلبة السوداء مجرد خليط متساوي المولي من عنصر التيلوريوم وثاني أكسيد التيلوريوم.[41]
يتكون ثاني أكسيد التيلوريوم عن طريق تسخين التيلوريوم في الهواء، حيث يحترق بلهب أزرق.[35] ثالث أكسيد التيلوريوم، β- TeO3 ، يتم الحصول عليها عن طريق التحلل الحراري لـ Te(OH)6 . تم العثور على الشكلين الآخرين لثالث أكسيد المذكورة في الأدبيات، α- و γ-، ليسا أكاسيد حقيقية للتيلوريوم في حالة الأكسدة +6، ولكن خليط من Te4+، OH- و O2- .[42] يعرض التيلوريوم أيضًا أكاسيد التكافؤ المختلط، Te2O5 و Te4O9 .[42]
تشكل أكاسيد التيلوريوم وأكاسيد الماء سلسلة من الأحماض، بما في ذلك حمض التيلوريوم (H2TeO3)، حمض أورثوتيلوريك (Te(OH)6) وحمض الميتاتيلوريك ((H2TeO4)n).[41] شكلان من حمض التيلوريك يشكلان أملاح تيلورات تحتوي على TeO
4
4 و TeO
6
6 الأنيونات، على التوالي. أشكال حمض تيلوريت والأملاح التي تحتوي على تيو أنيون TeO2−
3
زنتل كاتيونات
عند معالجة التيلوريوم بحمض الكبريتيك المركز، تكون النتيجة محلول أحمر من Zintl ion، Te42+ .[43] أكسدة التيلوريوم بواسطة AsF5 في سائل SO2 ينتج نفس الموجبة المستوية المربعة، بالإضافة إلى المنشور ثلاثي الزوايا، الأصفر البرتقالي Te64+ :[29]

تشمل كاتيونات التيلوريوم Zintl الأخرى البوليمر Te72+ والأزرق والأسود Te82+ ، تتكون من حلقتين من التيلوريوم المصهور من 5 أعضاء. يتكون الكاتيون الأخير من تفاعل التيلوريوم مع سداسي كلوريد التنجستن:[29]
توجد أيضًا الكاتيونات إنتركالكوجين، مثل Te2Se62+ (هندسة مكعب مشوهة) و Te2Se82+ . تتشكل هذه بواسطة خليط مؤكسد من التيلوريوم والسيلينيوم مع AsF5 أو SbF5.[29]
مركبات اللوريوم العضوية
لا يشكل التيلوريوم بسهولة نظائرها للكحولات والثيول، مع المجموعة الوظيفية –TeH، والتي تسمى تيلورولس. تُنسب المجموعة الوظيفية –TeH أيضًا باستخدام البادئة.[44] مثل H 2 Te، هذه الأنواع غير مستقرة فيما يتعلق بفقدان الهيدروجين. تعتبر (R – Te – R) أكثر استقرارًا، وكذلك التيلوروكسيدات.
التطبيقات
أكبر مستهلك للتيلوريوم هو علم المعادن في الحديد والفولاذ المقاوم للصدأ والنحاس وسبائك الرصاص. تؤدي إضافة الفولاذ والنحاس إلى إنتاج سبيكة أكثر قابلية للمعالجة من غير ذلك. يتم تحويله إلى سبائك الحديد الزهر لتعزيز البرودة من أجل التحليل الطيفي، حيث يميل وجود الجرافيت الحر الموصل كهربائيًا إلى التداخل مع نتائج اختبار انبعاث الشرارة. في الرصاص، يحسن التيلوريوم القوة والمتانة، ويقلل من تأثير حامض الكبريتيك المسبب للتآكل.[27][45]
الحفز غير المتجانس
أكاسيد التيلوريوم هي مكونات محفزات الأكسدة التجارية. المحفزات المحتوية على Te تُستخدم لطريق الأموكسدة إلى الأكريلونيتريل (CH 2 = CH – C≡N):[46]
تُستخدم المحفزات ذات الصلة في إنتاج رباعي ميثيلين جلايكول:
إستخدامات
- يُظهر المطاط الصناعي المفلكن بالتيلوريوم خصائص ميكانيكية وحرارية تتفوق في بعض النواحي على المواد المفلكنة بالكبريت. [46][47]
- مركبات التيلوريوم هي أصباغ متخصصة للسيراميك.[48]
- تزيد السيلينيدات والتيلورايد بشكل كبير من الانكسار البصري للزجاج المستخدم على نطاق واسع في الألياف الزجاجية الضوئية للاتصالات.[49][50]
- تُستخدم مخاليط السيلينيوم والتيلوريوم مع بيروكسيد الباريوم كمؤكسد في مسحوق التأخير لأغطية التفجير الكهربائية.[51]
- يعتبر القصف النيوتروني للتيلوريوم الطريقة الأكثر شيوعًا لإنتاج اليود 131 .[52] يستخدم هذا بدوره لعلاج بعض حالات الغدة الدرقية، وكمركب تتبع في التكسير الهيدروليكي، من بين تطبيقات أخرى.
أشباه الموصلات والإلكترونية
نظرًا لانخفاض سلبيته الكهربية، يشكل التيلوريوم مجموعة متنوعة من المواد ذات فجوات صغيرة في النطاق، والتي يمكن معالجتها عن طريق الضوء ذي الطول الموجي الطويل نسبيًا. هذه الميزة هي أساس التطبيقات المحتملة في المواد الموصلة الضوئية والخلايا الشمسية وأجهزة الكشف عن الأشعة تحت الحمراء. الشاغل الرئيسي الذي يعيق بعض التطبيقات هو الاستقرار المتواضع لهذه المواد والمخاوف بشأن التأثير البيئي.
تُظهر الألواح الشمسية الكادميوم تيلورايد (CdTe) بعضًا من أكبر الكفاءات لمولدات الطاقة الكهربائية للخلايا الشمسية.[53]
(Cd، Zn) تم إثبات أجهزة الكشف عن الأشعة السينية القائمة على Te.[54]
الزئبق الكادميوم تيلورايد هو مادة شبه موصلة حساسة للأشعة تحت الحمراء.[55]
مركبات اللوريوم العضوية
تعتبر مركبات اللوريوم العضوي ذات أهمية رئيسية في سياق البحث. تم فحص العديد منها مثل السلائف لنمو في طور البخار العضوي لأشباه الموصلات المركبة II-VI. تشتمل مركبات السلائف هذه على ثنائي ميثيل تيلورايد وثنائي إيثيل تيلورايد وثنائي أيزوبروبيل تيلورايد وديالليل تيلورايد وميثيل أليل تيلورايد.[56] يعتبر ثنائي أيزوبروبيل تيلورايد (DIPTe) هو السالف المفضل لنمو درجات الحرارة المنخفضة لـ (CdHgTe) بواسطة (MOVPE).[57] يتم استخدام المواد العضوية الأكثر نقاءً لكل من السيلينيوم والتيلوريوم في هذه العمليات. يتم تحضير مركبات صناعة أشباه الموصلات عن طريق تنقية المقربة.[58][59]
يتم استخدام أكسيد التيلوريوم الفرعي في طبقة الوسائط للأقراص الضوئية القابلة لإعادة الكتابة، بما في ذلك الأقراص المضغوطة القابلة لإعادة الكتابة (CD-RW) وأقراص الفيديو الرقمية القابلة لإعادة الكتابة (DVD-RW) وأقراص Blu-ray القابلة لإعادة الكتابة.[60][61]
يستخدم ثاني أكسيد التيلوريوم لإنشاء مُعدِّلات صوتية بصرية (AOTFs و AOBSs) للفحص المجهري متحد البؤر.
يستخدم التيلوريوم في رقائق ذاكرة تغيير الطور [62] التي طورتها شركة إنتل.[63] يعتبر البزموت تيلورايد (Bi 2 Te 3) وتيلورايد الرصاص عناصر عاملة في الأجهزة الكهروحرارية. تعد معارض تيلورايد الرصاص في كاشفات الأشعة تحت الحمراء البعيدة.
فوتوكاثودات
يظهر التيلوريوم في عدد من الكاثودات الضوئية المستخدمة في أنابيب مضاعفة الطاقة الشمسية العمياء[64] وللحاقنات الضوئية عالية السطوع التي تقود مسرعات الجسيمات الحديثة. يحتوي كاثود ضوئي Cs-Te، وهو في الغالب Cs2Te، على عتبة انبعاث ضوئي تبلغ 3.5 فولت ويظهر مزيجًا غير شائع من الكفاءة الكمية العالية (> 10٪) والمتانة العالية في بيئات الفراغ السيئة (تدوم لأشهر قيد الاستخدام في مسدسات الإلكترون الراديوية). وقد جعلها هذا الخيار المفضل لبنادق الإلكترون ذات الانبعاث الضوئي المستخدمة في قيادة ليزر الإلكترون الحر.[65][66] في هذا التطبيق، يتم تشغيله عادةً عند الطول الموجي 267 نانومتر وهو التوافقي الثالث لليزر Ti-الياقوت الأكثر استخدامًا. نمت المزيد من Te المحتوية على كاثودات ضوئية باستخدام معادن قلوية أخرى مثل الروبيديوم والبوتاسيوم والصوديوم، لكنها لم تجد نفس الشعبية التي تتمتع بها Cs-Te.[67][68]
الدور البيولوجي
وقد التيلوريوم لا يعرف ظيفة بيولوجية، وعلى الرغم من أن الفطريات يمكن أن يتضمن ذلك بدلا من الكبريت والسيلينيوم في الأحماض الأمينية مثل تيلورو- السيستين وتيلورو- ميثيونين.[7][69] أظهرت الكائنات الحية تسامحًا متغيرًا بدرجة عالية لمركبات التيلوريوم. العديد من البكتيريا، مثل الزائفة الزنجارية (بالإنجليزية: Pseudomonas aeruginosa)، تأخذ التيلوريت وتختزله إلى عنصر التيلوريوم، والذي يتراكم ويسبب سوادًا مميزًا وغالبًا ما يكون مثيرًا للخلايا.[70] في الخميرة، يتم التوسط في هذا التخفيض عن طريق مسار امتصاص الكبريتات.[71] يبدو أن تراكم التيلوريوم مسؤول عن جزء كبير من تأثيرات السمية. تستقلب العديد من الكائنات الحية أيضًا التيلوريوم جزئيًا لتكوين ثنائي ميثيل تيلورايد، على الرغم من أن بعض الأنواع تتكون أيضًا من ثنائي ميثيل ديتيلوريد. لوحظ ثنائي ميثيل تيلورايد في الينابيع الساخنة بتركيزات منخفضة للغاية.[72][73]
يستخدم أجار التيلوريت للتعرف على أعضاء جنس الوتديات، وغالبًا ما تكون الوتدية الخناق، الممرض المسؤول عن الدفتيريا.[74]يستخدم أجار التيلوريت للتعرف على أعضاء جنس الوتديات، وغالبًا ما تكون الوتدية الخناق، الممرض المسؤول عن الدفتيريا.[74]
الاحتياطات
| تيلوريوم | |
|---|---|
| المخاطر | |
| رمز الخطر وفق GHS |    |
| وصف الخطر وفق GHS | خطر |
| بيانات الخطر وفق GHS | H317, H332, H360, H412[75] |
| بيانات وقائية وفق GHS | P201, P261, P280, P308+313[76] |
| NFPA 704 |
0
2
0
|
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
تعتبر مركبات التيلوريوم والتيلوريوم شديدة السمية وتحتاج إلى التعامل معها بحذر، على الرغم من ندرة حالات التسمم الحاد.[77] يصعب علاج تسمم التيلوريوم بشكل خاص حيث أن العديد من عوامل الاستخلاب المستخدمة في علاج التسمم المعدني ستزيد من سمية التيلوريوم. لم يتم الإبلاغ عن مادة التيلوريوم مادة مسرطنة.[77]
تعرض البشر إلى أقل من 0.01 ملغم / م 3 أو أقل في الهواء تنضح برائحة كريهة تشبه رائحة الثوم تُعرف باسم «التنفس التيلوريوم».[48][78] يحدث هذا بسبب تحويل الجسم للتيلوريوم من أي حالة أكسدة إلى ثنائي ميثيل تيلورايد، (CH 3 ) 2 Te. هذا مركب متطاير برائحة نفاذة تشبه رائحة الثوم. على الرغم من أن المسارات الأيضية للتيلوريوم غير معروفة، إلا أنه يُفترض عمومًا أنها تشبه تلك الموجودة في السيلينيوم المدروسة على نطاق واسع لأن المنتجات الأيضية الميثيلية النهائية للعنصرين متشابهة.[79][80][81]
يمكن أن يتعرض الناس للتيلوريوم في مكان العمل عن طريق الاستنشاق والابتلاع وملامسة الجلد والاتصال بالعين. حدود إدارة السلامة والصحة المهنية (OSHA) ( حد التعرض المسموح به ) التعرض للتيلوريوم في مكان العمل إلى 0.1 مجم / م 3 خلال يوم عمل مدته ثماني ساعات. حدد المعهد الوطني للسلامة والصحة المهنية (NIOSH) حد التعرض الموصى به (REL) عند 0.1 مجم / م 3 خلال يوم عمل مدته ثماني ساعات. بتركيز 25 ملغم / م 3، التيلوريوم يشكل خطرا على الحياة والصحة على الفور .[82]
الأكتشاف
ولقد اكتشف التيلوريوم في عام 1782 من قبل فرانز يوزف مولر فون رايشنشتاين
انظر أيضًا
المراجع
- Tellurium, mindat.org
- Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- "معلومات عن تيلوريوم على موقع chem.nlm.nih.gov". chem.nlm.nih.gov. مؤرشف من الأصل في 2019-12-15.
- "معلومات عن تيلوريوم على موقع psh.techlib.cz". psh.techlib.cz. مؤرشف من الأصل في 2019-12-14.
- "معلومات عن تيلوريوم على موقع omegawiki.org". omegawiki.org. مؤرشف من الأصل في 2019-12-15.
- Anderson, Don L.; "Chemical Composition of the Mantle" in Theory of the Earth, pp. 147-175 (ردمك 0865421234)
- Ramadan، Shadia E.؛ Razak، A. A.؛ Ragab، A. M.؛ El-Meleigy، M. (1989). "Incorporation of tellurium into amino acids and proteins in a tellurium-tolerant fungi". Biological Trace Element Research. ج. 20 ع. 3: 225–32. DOI:10.1007/BF02917437. PMID:2484755.
- Leddicotte، G. W. (1961). "The radiochemistry of tellurium" (PDF). Subcommittee on Radiochemistry, National Academy of Sciences-National Research Council. Nuclear science series ع. 3038: 5. مؤرشف من الأصل (PDF) في 2021-11-06.
- Berger، Lev Isaakovich (1997). "Tellurium". Semiconductor materials. CRC Press. ص. 89–91. ISBN:978-0-8493-8912-2. مؤرشف من الأصل في 2021-04-10.
- Periodic Table. ptable.com نسخة محفوظة 2021-12-18 على موقع واي باك مشين.
- Audi، G.؛ Bersillon، O.؛ Blachot، J.؛ Wapstra، A. H. (2003). "The NUBASE Evaluation of Nuclear and Decay Properties". Atomic Mass Data Center. ج. 729 ع. 1: 3–128. Bibcode:2003NuPhA.729....3A. DOI:10.1016/j.nuclphysa.2003.11.001. مؤرشف من الأصل في 2021-11-04.
- "WWW Table of Radioactive Isotopes: Tellurium". Nuclear Science Division, Lawrence Berkeley National Laboratory. 2008. مؤرشف من الأصل في 2010-02-05. اطلع عليه بتاريخ 2010-01-16.
- Alessandrello، A.؛ Arnaboldi، C.؛ Brofferio، C.؛ Capelli، S.؛ Cremonesi، O.؛ Fiorini، E.؛ Nucciotti، A.؛ Pavan، M.؛ Pessina، G. (2003). "New limits on naturally occurring electron capture of 123Te". Physical Review C. ج. 67 ع. 1: 014323. arXiv:hep-ex/0211015. Bibcode:2003PhRvC..67a4323A. DOI:10.1103/PhysRevC.67.014323.
- "Noble Gas Research". Laboratory for Space Sciences, Washington University in St. Louis. 2008. مؤرشف من الأصل في 2011-09-28. اطلع عليه بتاريخ 2013-01-10.
- Emsley، John (2003). "Tellurium". Nature's building blocks: an A-Z guide to the elements. Oxford University Press. ص. 426–429. ISBN:978-0-19-850340-8. مؤرشف من الأصل في 2022-06-27.
- Ayres، Robert U.؛ Ayres، Leslie (2002). A handbook of industrial ecology. Edward Elgar Publishing. ص. 396. ISBN:1-84064-506-7. مؤرشف من الأصل في 2021-12-04.
- Suess، Hans؛ Urey، Harold (1956). "Abundances of the Elements". Reviews of Modern Physics. ج. 28 ع. 1: 53–74. Bibcode:1956RvMP...28...53S. DOI:10.1103/RevModPhys.28.53.
- Nekrasov، I. Y. (1996). "Phase Relations in the Selenide Telluride Systems". Geochemistry, mineralogy and genesis of gold deposits. Taylor & Francis. ص. 217–256. ISBN:978-90-5410-723-1.
- Fortey، Richard (2004). The Earth: An Intimate History. Harper Perennial. ص. 230. ISBN:978-0-00-257011-4. مؤرشف من الأصل في 2022-06-29.
- v.
- Rupprecht, von، A. (1783). "Über den vermeintlichen siebenbürgischen natürlichen Spiessglaskönig" [On the supposedly native antimony of Transylvania]. Physikalische Arbeiten der Einträchtigen Freunde in Wien. ج. 1 ع. 1: 70–74. مؤرشف من الأصل في 2021-04-28.
- Müller، F. J. (1783). "Über den vermeintlichen natürlichen Spiessglaskönig". Physikalische Arbeiten der Einträchtigen Freunde in Wien. ج. 1 ع. 1: 57–59. مؤرشف من الأصل في 2021-11-09.
- von Reichenstein، F. J. M. (1783). "Versuche mit dem in der Grube Mariahilf in dem Gebirge Fazebay bey Zalathna vorkommenden vermeinten gediegenen Spiesglaskönig" [Experiments with supposedly native antimony occurring in the Mariahilf mine in the Fazeby mountains near Zalathna]. Physikalische Arbeiten der Einträchtigen Freunde in Wien. ج. 1783 ع. 1.Quartal: 63–69. مؤرشف من الأصل في 2021-11-09.
- Diemann، Ekkehard؛ Müller, Achim؛ Barbu, Horia (2002). "Die spannende Entdeckungsgeschichte des Tellurs (1782–1798) Bedeutung und Komplexität von Elemententdeckungen". Chemie in unserer Zeit. ج. 36 ع. 5: 334–337. DOI:10.1002/1521-3781(200210)36:5<334::AID-CIUZ334>3.0.CO;2-1.
- Weeks، Mary Elvira (1932). "The discovery of the elements. VI. Tellurium and selenium". Journal of Chemical Education. ج. 9 ع. 3: 474–485. Bibcode:1932JChEd...9..474W. DOI:10.1021/ed009p474.
- Klaproth (1798) "Ueber die siebenbürgischen Golderze, und das in selbigen enthaltene neue Metall" (On the Transylvanian gold ore, and the new metal contained in it), Chemische Annalen für die Freunde der Naturlehre, Arzneygelahrtheit, Haushaltungskunst und Manufacturen (Chemical Annals for the Friends of Science, Medicine, Economics, and Manufacturing), 1 : 91–104. نسخة محفوظة 2021-11-09 على موقع واي باك مشين.
- George، Micheal W. (2007). "Mineral Yearbook 2007: Selenium and Tellurium". United States geological Survey. مؤرشف من الأصل (PDF) في 2021-11-14.
- John، D. A.؛ Taylor، R. D. (2016). "Chapter 7: By-Products of Porphyry Copper and Molybdenum Deposits". في Philip L. Verplanck and Murray W. Hitzman (المحرر). Rare earth and critical elements in ore deposits. ج. 18. ص. 137–164. مؤرشف من الأصل في 2021-11-09.
- Wiberg، Egon؛ Holleman، Arnold Frederick (2001). Nils Wiberg (المحرر). Inorganic chemistry. translated by Mary Eagleson. Academic Press. ص. 588. ISBN:0-12-352651-5.
- "An Arizona tellurium rush?". arizonageology.blogspot.com. 21 مايو 2007. مؤرشف من الأصل في 2021-11-09. اطلع عليه بتاريخ 2009-08-08.
- "Byproducts Part I: Is There a Tellurium Rush in the Making?". resourceinvestor.com. 19 أبريل 2007. مؤرشف من الأصل في 2017-06-25. اطلع عليه بتاريخ 2009-08-08.
- Crow، James Mitchell (2011). "13 elements you can't live without". New Scientist. ج. 210 ع. 2817: 39. Bibcode:2011NewSc.210...36C. DOI:10.1016/S0262-4079(11)61452-8.
- Addicks، Lawrence (2008). "By-Products". Copper Refining. Read books. ص. 111–114. ISBN:978-1-4437-3230-7.
- Brown، T. J. (2011). World mineral statistics British Geological Survey. Keyworth, Nottingham. ص. 95. ISBN:978-0-85272-677-8. مؤرشف من الأصل في 2021-11-09.
{{استشهاد بكتاب}}: صيانة الاستشهاد: مكان بدون ناشر (link) - Roscoe، Henry Enfield؛ Schorlemmer، Carl (1878). A treatise on chemistry. Appleton. ج. 1. ص. 367–368.
- Emeleus، H. J. (1990). A. G. Sykes (المحرر). Advances in Inorganic Chemistry. Academic Press. ج. 35. ISBN:0-12-023635-4.
- Holloway، John H.؛ Laycock، David (1983). "Preparations and Reactions of Inorganic Main-Group Oxide-Fluorides". في Harry Julius Emeléus؛ A. G. Sharpe (المحررون). Advances in inorganic chemistry and radiochemistry. Serial Publication Series. Academic Press. ج. 27. ص. 174. ISBN:0-12-023627-3.
- Xu، Zhengtao (2007). "Recent developments in binary halogen-chalcogen compounds, polyanions and polycations". في Francesco A. Devillanova (المحرر). Handbook of chalcogen chemistry: new perspectives in sulfur, selenium and tellurium. Royal Society of Chemistry. ص. 457–466. ISBN:978-0-85404-366-8. مؤرشف من الأصل في 2022-03-11.
-
{{استشهاد بموسوعة}}: استشهاد فارغ! (مساعدة) - Divers، Edward؛ Shimosé، M. (1883). "On a new oxide of tellurium". Journal of the Chemical Society. ج. 43: 319–323. DOI:10.1039/CT8834300319. مؤرشف من الأصل في 2021-11-04.
- Dutton، W. A.؛ Cooper، W. Charles (1966). "The Oxides and Oxyacids of Tellurium". Chemical Reviews. ج. 66 ع. 6: 657–675. DOI:10.1021/cr60244a003.
- Wickleder، Mathias S. (2007). "Chalcogen-Oxygen Chemistry". في Francesco A. Devillanova (المحرر). Handbook of chalcogen chemistry: new perspectives in sulfur, selenium and tellurium. Royal Society of Chemistry. ص. 348–350. ISBN:978-0-85404-366-8. مؤرشف من الأصل في 2022-03-11.
- Molnar, Arpad؛ Olah, George Andrew؛ Surya Prakash, G. K.؛ Sommer, Jean (2009). Superacid Chemistry (ط. 2nd). Wiley-Interscience. ص. 444–445. ISBN:978-0-471-59668-4. مؤرشف من الأصل في 2022-06-28.
- Sadekov، I. D.؛ Zakharov، A. V. (1999). "Stable tellurols and their metal derivatives". Russian Chemical Reviews. ج. 68 ع. 11: 909–923. Bibcode:1999RuCRv..68..909S. DOI:10.1070/RC1999v068n11ABEH000544.
- Guo، W. X.؛ Shu، D.؛ Chen، H. Y.؛ Li، A. J.؛ Wang، H.؛ Xiao، G. M.؛ Dou، C. L.؛ Peng، S. G.؛ Wei، W. W. (2009). "Study on the structure and property of lead tellurium alloy as the positive grid of lead-acid batteries". Journal of Alloys and Compounds. ج. 475 ع. 1–2: 102–109. DOI:10.1016/j.jallcom.2008.08.011.
- Knockaert، Guy (2005)، "Tellurium and Tellurium Compounds"، موسوعة أولمان للكيمياء الصناعية، فاينهايم: وايلي-في سي إتش، DOI:10.1002/14356007.a26_177
- Morton، Maurice (1987). "Sulfur and Related Elements". Rubber Technology. Springer. ص. 42. ISBN:978-0-412-53950-3.
- Lide, D. R.، المحرر (2005)، CRC Handbook of Chemistry and Physics (ط. 86th)، Boca Raton (FL): CRC Press، ISBN:0-8493-0486-5
- Nishii، J.؛ Morimoto، S.؛ Inagawa، I.؛ Iizuka، R.؛ Yamashita، T.؛ Yamagishi، T. (1992). "Recent advances and trends in chalcogenide glass fiber technology: a review". Journal of Non-Crystalline Solids. ج. 140: 199–208. Bibcode:1992JNCS..140..199N. DOI:10.1016/S0022-3093(05)80767-7.
- El-Mallawany، Raouf A. H. (2002). Tellurite glasses handbook: physical properties and data. CRC Press. ص. 1–11. ISBN:978-0-8493-0368-5. مؤرشف من الأصل في 2021-11-14.
- Johnson، L. B. (1960). "Correspondence. Representing Delay Powder Data". Industrial & Engineering Chemistry. ج. 52 ع. 10: 868. DOI:10.1021/ie50610a035.
- [Nordion fact sheet: I-131 http://www.nordion.com/wp-content/uploads/2014/10/MI_Iodine-131_Solution_Canada.pdf] نسخة محفوظة 2021-11-14 على موقع واي باك مشين.
- Zweibel، K. (2010). "The Impact of Tellurium Supply on Cadmium Telluride Photovoltaics". Science. ج. 328 ع. 5979: 699–701. Bibcode:2010Sci...328..699Z. DOI:10.1126/science.1189690. PMID:20448173.
- Saha, Gopal B. (2001). "Cadmium zinc telluride detector". Physics and radiobiology of nuclear medicine. New York: Springer. ص. 87–88. ISBN:978-0-387-95021-1.
- Willardson, R.K.؛ Beer, Albert C، المحررون (1981). Mercury cadmium telluride. New York: Academic Press. ISBN:978-0-12-752118-3.
- Capper, Peter؛ Elliott, C. T.، المحررون (2001). "Metalorganic vapour phase epitaxy". Infrared detectors and emitters : materials and devices. Boston, Mass.: Kluwer Academic. ص. 265–267. ISBN:978-0-7923-7206-6.
- Shenai-Khatkhate، Deodatta V.؛ Webb، Paul؛ Cole-Hamilton، David J.؛ Blackmore، Graham W.؛ Brian Mullin، J. (1988). "Ultra-pure organotellurium precursors for the low-temperature MOVPE growth of II/VI compound semiconductors". Journal of Crystal Growth. ج. 93 ع. 1–4: 744–749. Bibcode:1988JCrGr..93..744S. DOI:10.1016/0022-0248(88)90613-6.
- Shenai-Khatkhate، Deodatta V.؛ Parker، M. B.؛ McQueen، A. E. D.؛ Mullin، J. B.؛ Cole-Hamilton، D. J.؛ Day، P. (1990). "Organometallic Molecules for Semiconductor Fabrication [and Discussion]". Phil. Trans. R. Soc. Lond. A. ج. 330 ع. 1610: 173–182. Bibcode:1990RSPTA.330..173S. DOI:10.1098/rsta.1990.0011.
- Mullin, J.B.; Cole-Hamilton, D.J.; Shenai-Khatkhate, D.V.; Webb P. (May 26, 1992) U.S. Patent 5٬117٬021 "Method for purification of tellurium and selenium alkyls"
- Farivar، Cyrus (19 أكتوبر 2006). "Panasonic says that its 100GB Blu-ray discs will last a century". مؤرشف من الأصل في 2020-03-21. اطلع عليه بتاريخ 2008-11-13.
- Nishiuchi, Kenichi؛ Kitaura, Hideki؛ Yamada, Noboru؛ Akahira, Nobuo (1998). "Dual-Layer Optical Disk with Te–O–Pd Phase-Change Film". Japanese Journal of Applied Physics. ج. 37 ع. 4B: 2163–2167. Bibcode:1998JaJAP..37.2163N. DOI:10.1143/JJAP.37.2163.
- Hudgens، S.؛ Johnson, B. (2004). "Overview of Phase-Change Chalcogenide Nonvolatile Memory Technology". MRS Bulletin. ج. 29 ع. 11: 829–832. DOI:10.1557/mrs2004.236.
- Geppert، Linda (2003). "The New Indelible Memories". IEEE Spectrum. ج. 40 ع. 3: 48–54. DOI:10.1109/MSPEC.2003.1184436.
- Taft, E.; Apker, L. (1 Feb 1953). "Photoemission from Cesium and Rubidium Tellurides". JOSA (بالإنجليزية). 43 (2): 81–83. Bibcode:1953JOSA...43...81T. DOI:10.1364/JOSA.43.000081. Archived from the original on 2021-11-16.
- LCLS-II Project Team. (2015).
- Rao, T., & Dowell, D. H. (2013).
- Trautner, H. (2000).
- Atta-ur- Rahman (2008). Studies in Natural Products Chemistry. Elsevier. ص. 905–. ISBN:978-0-444-53181-0. مؤرشف من الأصل في 2021-11-21.
- Chua SL, Sivakumar K, Rybtke M, Yuan M, Andersen JB, Nielsen TE, Givskov M, Tolker-Nielsen T, Cao B, Kjelleberg S, Yang L (2015). "C-di-GMP regulates Pseudomonas aeruginosa stress response to tellurite during both planktonic and biofilm modes of growth". Scientific Reports. ج. 5: 10052. Bibcode:2015NatSR...510052C. DOI:10.1038/srep10052. PMID:25992876.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - Ottosson، L. G.؛ Logg، K.؛ Ibstedt، S.؛ Sunnerhagen، P.؛ Käll، M.؛ Blomberg، A.؛ Warringer، J. (2010). "Sulfate assimilation mediates tellurite reduction and toxicity in Saccharomyces cerevisiae". Eukaryotic Cell. ج. 9 ع. 10: 1635–47. DOI:10.1128/EC.00078-10. PMID:20675578.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - Chasteen، Thomas G.؛ Bentley، Ronald (2003). "Biomethylation of Selenium and Tellurium: Microorganisms and Plants". Chemical Reviews. ج. 103 ع. 1: 1–26. DOI:10.1021/cr010210+. PMID:12517179.
- Taylor، Andrew (1996). "Biochemistry of tellurium". Biological Trace Element Research. ج. 55 ع. 3: 231–9. DOI:10.1007/BF02785282. PMID:9096851.
- Kwantes، W. (1984). "Diphtheria in Europe". The Journal of Hygiene. ج. 93 ع. 3: 433–437. DOI:10.1017/S0022172400065025. JSTOR:3862778. PMID:6512248.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - Pubchem LCSS https://pubchem.ncbi.nlm.nih.gov/compound/6327182#datasheet=LCSS§ion=GHS-Classification نسخة محفوظة 2021-11-06 على موقع واي باك مشين.
- "Tellurium 452378". Sigma-Aldrich. مؤرشف من الأصل في 2021-11-05.
- Harrison، W.؛ Bradberry، S.؛ Vale، J. (28 يناير 1998). "Tellurium". International Programme on Chemical Safety. مؤرشف من الأصل في 2008-12-10. اطلع عليه بتاريخ 2007-01-12.
- Kean، Sam (2017). "The Scent of a Molecule". Distillations. ج. 3 ع. 3: 5. مؤرشف من الأصل في 2021-11-05. اطلع عليه بتاريخ 2018-05-16.
- Wright, PL؛ B (1966). "Comparative metabolism of selenium and tellurium in sheep and swine". American Journal of Physiology. Legacy Content. ج. 211 ع. 1: 6–10. DOI:10.1152/ajplegacy.1966.211.1.6. PMID:5911055.
- Müller، R.؛ Zschiesche، W.؛ Steffen، H. M.؛ Schaller، K. H. (1989). "Tellurium-intoxication". Klinische Wochenschrift. ج. 67 ع. 22: 1152–5. DOI:10.1007/BF01726117. PMID:2586020.
- Taylor، Andrew (1996). "Biochemistry of tellurium". Biological Trace Element Research. ج. 55 ع. 3: 231–239. DOI:10.1007/BF02785282. PMID:9096851.
- "CDC – NIOSH Pocket Guide to Chemical Hazards – Tellurium". www.cdc.gov. مؤرشف من الأصل في 2021-11-05. اطلع عليه بتاريخ 2015-11-24.
- إدوار غالب، الموسوعة في العلوم الطبيعية (ط. الثانية)، دار المشرق، بيروت، ج. الأول، ص.298، يُقابله Tellurium
روابط خارجية
- USGS Mineral Information عن السيلينيوم والتيلوريوم.
- تيلوريوم في الجدول الدوري لمقاطع الفيديو (جامعة نوتنجهام).
- CDC - دليل الجيب NIOSH للمخاطر الكيميائية - التيلوريوم.
- بوابة العناصر الكيميائية
- بوابة الفيزياء
- بوابة الكيمياء
- بوابة علم الأحجار الكريمة والمجوهرات
- بوابة علم طبقات الأرض


