كبريت
الكبريت هو عنصر كيميائي لافلزّي رمزه S وعدده الذرّي 16؛ ويقع ضمن عناصر الدورة الثالثة وفي المجموعة السادسة عشر (المجموعة السادسة وفق ترقيم المجموعات الرئيسية) في الجدول الدوري، حيث يقع في المرتبة الثانية في نفس مجموعة الأكسجين، وبالتالي فهو من الكالكوجينات. ينتمي عنصر الكبريت إلى اللافلزّات وهو متعدّد التكافؤ ويوجد عددٌ كبيرٌ من المركّبات الكيميائية الكبريتية. عُرفَ الكبريت في الحضارات القديمة المختلفة، وكان للعلماء العرب والمسلمين دوراً في تطوير ونشر المعارف عن الكبريت، خاصّةً العالم جابر بن حيان، الذي توصّل إلى اكتشاف حمض الكبريتيك وأسماه «زيت الزاج»، حيث كانت تشير تسمية الزاج إلى أملاح الكبريتات المشتقّة من هذا الحمض.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المظهر | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
عينة من الكبريت المتبلور مستخرجة من منجم في بوليفيا الخطوط الطيفية للكبريت | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص العامة | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الاسم، العدد، الرمز | كبريت، 16، S | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| تصنيف العنصر | لا فلز | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 16، 3، p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكتلة الذرية | 32.065 غ·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع إلكتروني | Ne]؛ 3s2 3p4] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 8, 6 (صورة) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الفيزيائية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الطور | صلب | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | (ألفا) 2.07 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | (بيتا) 1.96 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | (غاما) 1.92 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| كثافة السائل عند نقطة الانصهار | 1.819 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الانصهار | 388.36 ك، 115.21 °س، 239.38 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الغليان | 717.8 ك، 444.6 °س، 832.3 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| النقطة الحرجة | 1314 ك، 20.7 ميغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة الانصهار | (أحادي) 1.727 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة التبخر | (أحادي) 45 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | 22.75 جول·مول−1·كلفن−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ضغط البخار | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الذرية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| أرقام الأكسدة | 6, 5, 4, 3, 2, 1, -1, -2 (أكاسيده حمضية قوية) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكهرسلبية | 2.58 (مقياس باولنغ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| طاقات التأين | الأول: 999.6 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثاني: 2252 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثالث: 3357 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر تساهمي | 3±105 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر فان دير فالس | 180 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| خواص أخرى | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| البنية البلورية | نظام بلوري معيني قائم | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المغناطيسية | مغناطيسية معاكسة[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مقاومة كهربائية | (لابلوري) 2×1015أوم·متر (20 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الناقلية الحرارية | (لابلوري) 0.205 واط·متر−1·كلفن−1 (300 كلفن) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل الحجم | 7.7 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة موس | 2.0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رقم CAS | 7704-34-9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر الكبريت | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
يوجد الكبريت في الطبيعة على شكله العنصري الطبيعي الخام بشكلٍ وافرٍ نسبياً (العاشر من حيث ترتيب العناصر بالنسبة للكتلة في الكون)، إذ يُصادَف في الطبيعة في الشروط القياسية على شكل خامّ بلّوري أصفر اللون من ثماني الكبريت S8، والذي يعرف باسم «زهر الكبريت». كما يدخل الكبريت في تركيب المعادن في القشرة الأرضية على شكل معادن الكبريتيدات ومعادن الكبريتات؛ كما يدخل أيضاً في تركيب القطفات الثقيلة من النفط. يستحصل على الكبريت حالياً على شكل منتج ثانوي من عملية تكرير النفط، حيث يُحوّل بشكلٍ أساسي إلى حمض الكبريتيك، وهو أحد المواد الكيميائية الأولية المهمّة صناعياً، ومنه إلى مركّبات الكبريت الأخرى المختلفة. يدخل الكبريت في تركيب العديد من المواد الحياتية اليومية مثل الأسمدة والمبيدات وكذلك في عيدان الثقاب. تتميّز مركّبات الكبريت العضوية بأنها ذات رائحة كريهة، ولها دور في الرائحة المنفّرة في النفط والغاز الطبيعي، وكذلك في الثوم والبصل؛ كما أن كبريتيد الهيدروجين مسؤولٌ عن صدور الرائحة الكريهة للبيض العَفِن. من جهةٍ أخرى، فإن لأكاسيد الكبريت أثر بيئي كبير، فهي من مكوّنات المطر الحمضي.
للكبريت أهميّة حيوية، فهو يعدّ من العناصر الغذائية الأساسية؛ فهو يدخل في تركيب الحمضَين الأمينيّّين (السيستئين والميثيونين) واثنين من الفيتامينات (الثيامين (فيتامين ب1) والبيوتين (فيتامين ب7)). كما تحوي العديد من العوامل المرافقة على الكبريت في تركيبها، مثل الغلوتاثيون والثيوريدوكسين، بالإضافة إلى البروتينات الحديدية-الكبريتية. تسهم الروابط S-S في ثنائيات الكبريتيدات في إضفاء خواص المتانة الميكانيكية وعدم الانحلالية لبروتين الكيراتين، وهو بروتين حيوي مهمّ وموجود في شعر وريش العديد من الكائنات الحية. يلعب الكبريت أيضاً دوراً في عمليات كسب الطاقة في عددٍ من الكائنات الحية المجهرية اللاهوائية.
التاريخ
العصور القديمة والوسطى

عُرف الكبريت منذ أقدم العصور، وذلك لأنّه يوجد في الطبيعة بشكله العنصري الحرّ. فقد استخدم المصريون القدماء الكبريت في تبييض الأقمشة وفي بعض التطبيقات الأخرى منذ حوالي 2000 سنة قبل الميلاد؛ ووفقاً لبردية إبيرس فقد استُعمِلَ مرهمٌ حاوٍ على الكبريت في علاج التهاب الجفن. منذ القرن السادس قبل الميلاد أطلق الصينيون على خامة الكبريت الطبيعية اسم «شيليوهوانغ 石硫黄»، والمنتشرة بالقرب من مدينة هانتشونغ؛[2] ومنذ القرن الثالث قبل الميلاد اكتشف الصينيون أنّه من الممكن استخراج الكبريت من البيريت.[2][3] اهتمّ الطاويّون بقدرة الكبريت على الاشتعال وبتفاعله مع بعض الفلزات، ووجدوا له استخداماتٍ في الطبّ الصيني التقليدي.[2]
.svg.png.webp)
استُخدِم الكبريت منذ مرحلة ما قبل العصر الكلاسيكي اليوناني في التعقيم بالبخار،[4] وهو أمرٌ مذكورٌ في الأوديسّة؛[5][6] كما استُعمِل الكبريت في الحروب لتحضير المشاعل لقدرته على الاحتراق البطيء.[3] ناقش بلينيوس الأكبر الكبريت في موسوعة التاريخ الطبيعي، وأورد التطبيقات المستخدمة في ذلك الوقت مثل التعقيم والطب وتبييض الملابس.[7] ساهم الكيميائيون العرب والمسلمون في تطوير التجارب على عنصر الكبريت التي سعت لمعرفة ماهيته،[ْ 1] ونجح جابر بن حيان في تحضير حمض الكبريتيك من أملاح الكبريتات (التي كانت تسمى الزاج)، ولذلك أطلق عليه اسم «زيت الزاج».[ْ 2] قام الهنود أيضاً بوصف استخدام الكبريت في العمليات الخيميائية مع الزئبق وذلك منذ القرن الثامن للميلاد،[8] وكان يطلق عليه اسم «ذو الرائحة». وَصَفت معاهدة سلالة سونغ الحاكمة العسكرية سنة 1044 للميلاد استخدام صيغٍ متنوّعة من مسحوق البارود الأسود، والذي كان يحوي على الكبريت في تركيبه بالإضافة إلى الفحم ونترات البوتاسيوم (ملح البارود).[9] كان الرمز الخيميائي للكبريت في أوروبا على شكل مثلّث على رأس صليب؛ واستخدم الكبريت من الخيميائيين الأوروبيين في معالجة الجرب والحكة والصدفية وحب الشباب؛ وذلك غالباً بسبب أثر الكبريتيت (السلفيت) المعقّم والمختزل.[10][11][12]
العصور الحديثة

كانت عملية غرف الرصاص التي طوّرها جون روبوك سنة 1746 من أولى العمليات التقنية الكيميائية لإنتاج حمض الكبريتيك.[13][14] ساهم أنطوان لافوازييه لاحقاً سنة 1777 في إقناع المجتمع العلمي آنذاك أنّ الكبريت هو عنصرٌ وليس مركّباً كيميائياً؛ خاصّةً أنّ إجراء التجارب على احتراق الكبريت كان عاملاً مساعداً في إسقاط نظرية الفلوجستون.[15] في النهاية أدّت تجارب لوي جوزيف غي لوساك ولوي جاك تينار في ترسيخ حقيقة أنّ الكبريت ينتمي إلى العناصر الكيميائية؛[16] وبناءً على اقتراح من يونس ياكوب بيرسيليوس مُنِحَ العنصر الرمز S، حيث بدأ يظهر في الجداول العلمية للعناصر منذ سنة 1814.[17] تمكّن الكيميائي وليام كريستوفر زايسه سنة 1822 من اكتشاف مركّبات الزانثات الحاوية على الكبريت، كما تمكّن من تحضير إيثانثيول، وهو أوّل مركّبات الثيول (المركبتانات) المكتَشفة.[18] من الاكتشافات المهمّة الأخرى المتعلّقة بالكبريت عمليةُ فلكنة المطاط، والتي اكتشفها تشارلز غوديير مصادفةً سنة 1839.
كانت توضّعات وترسّبات الكبريت في صقلية وافرةً، وكانت المصدر الرئيسي للكبريت لأوروبا لفترات طويلة من الزمن. في أواخر القرن الثامن عشر كان يُستورَد حوالي 2000 طن سنوياً من الكبريت إلى مدينة مرسيليا في فرنسا من أجل تحضير حمض الكبريتيك المستخدَم في عملية لوبلان. بالمقابل ازداد الطلب على الكبريت في بريطانيا أثناء الثورة الصناعية، ومع ازدياد التنافس مع فرنسا، زادت الضغوط السياسية، ممّا أدّى في النهاية إلى حدوث ما أطلق عليه اسم «أزمة الكبريت» سنة 1840، وذلك عندما قام فرديناندو الثاني ملك الصقليتين بمنح صلاحيات استخراج الكبريت بشكلٍ حصريٍّ إلى شركة فرنسية، خارقاً بذلك اتفاقية مُسبَقة مع بريطانيا تعود إلى سنة 1816، ممّا دفع بريطانيا بالتهديد بالحصار البحري، إلّا أنّ فرنسا توسّطت بحلّ الأمر سلمياً بمفاوضاتٍ دبلوماسية.[19][20]
توسّع استخدام الكبريت منذ أواخر القرن التاسع عشر، حيث استخدم في المجال الطبي لصنع المراهم وغيرها؛[21] كما ازداد الطلب عليه مع تطوير عملية التلامس لتحضير حمض الكبريتيك ولصناعة الأسمدة.[22] وفي الولايات المتحدة اكتُشِف الكبريت سنة 1867 في ولايتي تكساس ولويزيانا في توضّعات تحت أرضية، والتي استخدمت عملية فراش لاحقاً لاستخراجه منها،[23] والتي طُوّرت ما بين سنتي 1891 و1894 من الكيميائي هيرمان فراش.[24]
الوفرة الطبيعية

في الكون
يتشكّل نظير الكبريت 32S داخل النجوم الضخمة عند درجات حرارة مرتفعة جدّاً في عملية احتراق السيليكون، والتي تندمج فيها نواةٌ من السيليكون مع نواةٍ من الهيليوم؛[25] وتعدّ هذه العملية جزءاً من عملية ألفا التي تنتج العناصر الكيميائية في الكون بكمّيّات وافرة، ولذلك فإنّ الكبريت هو عاشر العناصر الكيميائية من حيث ترتيب الوفرة في الكون. توجد سحبٌ من غاز ثنائي أكسيد الكبريت وضباب من حمض الكبريتيك في الغلاف الجوّي لكوكب الزهرة، وبُرهِنَ على وجود الكبريت في تركيب كوكب المريخ؛ كما عُثرَ على الكبريت أيضاً في تركيب قمر أوروبا؛[26] ومن الأمثلة الواضحة على وفرة الكبريت في الكون هو قمر آيو (أحد أقمار كوكب المشتري)، والذي يتميّز بلونه الأصفر بسبب وجود الكبريت فيه بأطواره المتعددة، الغازية والصلبة والمنصهرة؛[27] حيث اقتُرحَ أن تكون الحمم البركانية، التي تمتدّ على مسافة مئات من الكيلومترات، مكوّنةً من الكبريت ومركّباته.[28]
يدخل الكبريت أيضاً على هيئة مركّبات الكبريتيد في تركيب عدّة أنماط من الأحجار النيزكية؛ فيحوي الكوندريت العادي وسطياً على الكبريت بنسبةٍ تصل إلى 2% تقريباً، في حين تصل النسبة في الكوندريت الكربوني إلى حوالي 6.6%. تحوي النيازك عادةً على كبريتيد الحديد FeS على شكل معدن ترويليت، ولكنّ هناك استثناءات، حيث يحوي الكوندريت الكربوني أحياناً على الكبريت العنصري أو الكبريتات أو مركّبات أخرى للكبريت.[29] يمكن أن يوجد الكبريت على عدّة أشكال في الكون، من بينها الشكل النادر على هيئة جزيء ثنائي الذرة S2 في النيازك؛[30] كما توجد مركّبات بسيطة مختلفة للكبريت في الوسط بين النجمي مثل كبريتيد الهيدروجين H2S وكبريتيد الكربونيل COS وأحادي أكسيد الكبريت SO وثيوفورمالدهيد CH2S وغيرها.[31][32]
في الأرض
يعدّ الكبريت خامس العناصر الكيميائية من حيث ترتيب الكتلة في الأرض، أمّا من حيث تركيب القشرة الأرضية فيأتي الكبريت ومركّباته في المرتبة السادسة عشرة. تصفُ دورة الكبريت العمليات الجيوكيميائية التي ينتقل فيها الكبريت ومركّباته بين الأنظمة والأوساط المختلفة الموجودة على سطح الأرض، والتي تشمل غلاف الأرض الصخري والمائي والجوي والحيوي.[33][34]
يمكن أن يُعثَر على الكبريت بشكله الطبيعي العنصريَ الحرَ، أي بشكل غير مرتبط مع عناصر أخرى، وهو ذو لون أصفر مميّز، ويسمّى هذا الشكل عادةً «زهر الكبريت». وفق الجمعية الدولية للمعادن فإنّ الكبريت ينتمي إلى المعادن اللافلزية العنصرية، ويمكن أن يوجد على أشكالٍ متعدّدة، منها معدن الروسيتسكيت النادر. تكون توضّعات الكبريت عادةً ذات بلّورات صغيرة متكتّلة معتمة، ولكن يمكن العثور على بلّورات كبيرة الحجم، وأكبر بلّورة كبريت موثّقة تبلغ أبعادها 22×16×11 سم.[35] تكون البلّورات الكبيرة من الكبريت شفّافة إلى شافّة، وهي ذات بريق، ولها الخواص البصرية التالية: معامل الانكسار: nα = 1.9579 و nβ = 2.0377 وnγ = 2.2452؛ وزاوية التبعثر: '2vz ≈ 68°58.[36] تترك بلورات الكبريت خدشاً أبيضَ اللون على السطوح السوداء.
حسب مكان العثور على الخامة فإنّه يمكن للكبريت أن يوجد بتكوّن ترتيبي مع معادنَ أخرى مثل الأنهيدريت والأراغونيت والكالسيت والسليستيت والجص والهاليت.[36] يوجد الكبريت في الطبيعة أيضاً في معادن مختلفة، أكثرها شهرةً على شكل معادن الكبريتيدات مثل البيريت والمرقشيت (كبريتيد الحديد) والكالكوبيريت (كبريتيد الحديد والنحاس) والزنجفر (كبريتيد الزئبق) والغالينا (كبريتيد الرصاص) والسفاليريت (كبريتيد الزنك) والإستبنيت (كبريتيد الإثمد) وغيرها. إنّ أكثر المعادن ارتفاعاً بنسبة الكبريت في تركيبها هي معادن الكبريتيدات التالية: باترونيت (حوالي 71.6% في كبريتيد الفاناديوم VS4) وفيلامانينيت (حوالي 55.9% في كبريتيد للنحاس مع فلزات أخرى) وهاوريت (حوالي 53.9% في كبريتيد المنغنيز MnS2).[37] يوجد الكبريت أيضاً على شكل معادن الكبريتات مثل الجص (كبريتيات الكالسيوم) والألونيت (كبريتات البوتاسيوم والألومنيوم) والباريت (كبريتات الباريوم) وسيانوتريخيت (كبريتات النحاس) وغيرها؛ كما يمكن أن يوجد في الطبيعية مع الهاليدات مثل معدن كونيليت؛ أو مع الأكاسيد مثل معدن قرمزيت؛ أو مع الكربونات مثل معدن ليدهيليت؛ أو مع الزرنيخات مثل معدن كالكوفيليت؛ أو مع السيليكات مثل معدَنَي هاوين ونوزيان.
كانت صقلية لفترةٍ طويلة من التاريخ مصدراً رئيسياً لتعدين الكبريت، وخاصّةً أثناء الثورة الصناعية.[38] يمكن العثور على الكبريت العنصري بالقرب من الظواهر البركانية مثل الحمم والمنافس الحرارية المائية والنوافث في عدّة مناطق في العالم، وخاصّةً على نطاق منطقة الحزام الناري، حيث يستخرج الكبريت بالقرب منها مثلاً في إندونيسيا وتشيلي واليابان.[39] يصطنع الكبريت الطبيعي من الكائنات اللاهوائية التي تعيش على معادن الكبريتات مثل الجص في القباب الملحية.[40][41] توجد توضّعات معتبرة من القباب الملحية على طول ساحل خليج المكسيك، وكذلك في الرواسب التبخريّة في أوروبا الشرقية وغرب آسيا. كما توجد توضّعات رسوبية من الكبريت كذلك في أستراليا والولايات المتحدة وروسيا.[21] كما يوجد الكبريت أيضاً في الوقود الأحفوري مثل النفط والغاز الطبيعي والفحم الحجري، حيث يمكن أن تصل نسبة الكبريت في الفحم البني مثلاً إلى 10%.[42]
يوجد الكبريت في غلاف الأرض المائي على شكل أيون الكبريتات (السلفات)، وهو يشكّل ما مقداره 7.68% من نسبة الأملاح الكلّية في مياه البحر، ليأتي بذلك في المرتبة الثالثة بعد أيونات الكلوريد والصوديوم.[43] عندما يكون تركيز أيون الكبريتات فوق 100 مغ/ل، فإنّه يسبب التآكل، خاصّةً للفولاذ والخرسانة في الإنشاءات البحرية.[44] أمّا في المياه العذبة فتشكّل أيونات الكبريتات مصدراً لقساوة المياه وعُسْرها، لذلك تعمل محطّات تحلية المياه على ضبط تركيزها في مياه الشرب. تطلق البراكين طبيعياً غاز ثنائي أكسيد الكبريت عند ثورانها، كما يمكن أن تشكّل جسيمات كبريتية من الهباء الجوي تتراوح أبعادها بين 0.1 إلى 1 ميكرومتر في طبقات الغلاف الجوّي العليا، والتي تعكس حينها أشعّة الشمس وتبعثِرُها، ممّا قد يترك تأثيراً مبرّداً على المناخ العالمي.[45] يطلق على المياه الحاوية على نسبٍ مرتفعةٍ من الكبريت (غالباً على شكل كبريتيد الهيدروجين) اسم «المياه الكبريتية»؛ وهي غالباً ما تستخدم للاستشفاء.[46]
الإنتاج

يمكن العثور على خامة الكبريت طبيعياً على هيئة زهر الكبريت الأصفر في عدّة أماكنٍ من العالم، وهو شائع الوجود على هذا الشكل.[47] كما يمكن أن يُستحصَل على الكبريت بشكلٍ غير مباشر وذلك من أكسدة معادن الكبريتيدات المنتشرة في الطبيعة مثل معدن البيريت، وذلك بالتسخين الحراري بحيث ينتج غاز ثنائي أكسيد الكبريت، والذي يُحوَّل لاحقاً إلى حمض الكبريتيك.[48]
كانت المنطقة البركانية في صقلية مركزاً للحصول على خام الكبريت، حيث كان يَسهُل العثور على خام الكبريت بالقرب من سطح الأرض، إذ كان يُجمَع ثم يُعالَج بأسلوب عُرفَ لاحقاً باسم «عملية صقلية»، والتي كانت الطريقة الأولية البدائية المنتشرة لمعالجة الكبريت إلى أن جرى استبدالها لاحقاً في القرن التاسع عشر بعملية فراش.[49][50] كانت قطع الكبريت تُكدَّس مع وجود فراغات فيما بينها في قمائن (أتون) مصنوعة من الآجر (القرميد) ومبنية على الهضاب المنحدرة؛ بعد ذلك يُنثَر مسحوقٌ من الكبريت على تلك القطع ويُشعَل ممّا يسبّب انصهار الكبريت وسيلانه إلى أسفل الهضبة؛ وفي النهاية كانت بقايا التوضّعات الرسوبية تُنثَر في المحيط. كانت عملية صقلية مجهدة ومضنية وخالية من الآليات، حيث استُعملت العمالة اليدوية لتحرير الخامة من الصخور وجلبها إلى السطح، ولا يزال هذا الأسلوب مستخدماً بالقرب من المناطق البركانية في أنحاء العالم، وخاصّةً في إندونيسيا بالقرب من بركان إيجن.[51]

1 - أنبوب الوسط
2 - بخار ساخن
3 - موقع الاستخراج
4 - الكبريت الذائب والماء
5 - الهواء المضغوط
يُنتَج الكبريت حاليّاً بطرق آلية، إمّا من أماكن توفّر خامة الكبريت وفق عملية فراش،[21] أو يُستحصَل على شكل ناتج ثانوي من عمليات تكرير النفط. يَعتمد المبدأ في عملية فراش على ضخّ بخار الماء المحمَّص إلى توضّعات الكبريت الرسوبية، ممّا يؤدّي إلى انصهار الكبريت بالشكل الذي يسهل فيه استخراجه بشكل نقي نسبياً (حوالي 99.5%) من جوف الأرض بضخ الهواء المضغوط.[52] كانت عملية فراش العملية الوحيدة لاستخراج الكبريت لفترة طويلة، وبقيت مستخدمة رغم وجود طرق أخرى إلى أواخر القرن العشرين، ففي سنة 1995 على سبيل المثال كان الإنتاج العالمي وفق هذه الطريقة حوالي 3.1 مليون طن.[53] ولكن مجموع العوامل من حيث محدودية أماكن توضّعات خامة الكبريت والكلفة المرتفعة، بالإضافة إلى تطوير وسائل استحصال الكبريت من النفط والغاز الطبيعي، أدّى إلى تراجع استخدام عملية فراش، بحيث أنّ هذه العملية لم تعد مطبّقة بشكل أساسي في أيّ مكان من العالم منذ سنة 2002.[54][55]
يُستحصَل على الكبريت حالياً بشكل أساسي من كبريتيد الهيدروجين، والذي ينتج ثانوياً من عمليات تكرير النفط والغاز الطبيعي، إمّا بشكل طبيعي أثناء عملية الاستخراج، أو بشكل ناتج ثانوي من عمليات نزع الكبريت المهدرج، والتي تهدف إلى إزالة مركبات الكبريت العضوية غير المرغوب بها من المنتجات النفطية النهائية وذلك بإجراء فصم للرابطة الكيميائية بين الكربون والكبريت C–S على الشكل:[54][55]

يُحوَّل كبريتيد الهيدروجين إلى عنصر الكبريت وفق عملية كلاوس، والتي تتألّف من خطوتين؛[56] تتضمّن الأولى أكسدة جزء من كبريتيد الهيدروجين إلى ثنائي أكسيد الكبريت بأكسجين الهواء، ثمّ في الخطوة الثانية بإجراء تفاعل تناسب مشترك بين كبريتيد الهيدروجين وثنائي أكسيد الكبريت:[54][55]
يمكن أن يُكدَّس الكبريت المستحصَل على هيئة أكوام ليستخدم في تطبيقات أخرى؛ فعلى سبيل المثال توجد حالياً كمّيات كبيرة نسبياً من عنصر الكبريت في مقاطعة ألبرتا الكندية نظراً لارتفاع محتوى الكبريت في نفط أثاباسكا الرملي.[57] لكن تخزين الكبريت في حالته الصلبة يجعله عرضةً للرطوبة الجوية ولأنواع من البكتريا، ممّا يحوّله في النهاية إلى حمض الكبريتيك؛ كما يؤدّي تشكّل كبريتيد الحديد نتيجة التآكل ضمن الخزانات الحديدية إلى حدوث تلقائية الاشتعال، ممّا يرفع من خطورة اندلاع الحرائق أو الانفجارات.[58] لذلك فإنّه غالباً ما يُخزَّن ويُنقَل الكبريت على الحالة السائلة، خاصّةً أنّ وجوده على هذا الشكل له ميّزات من حيث الكلفة والجودة، كما أنه يسيَّل في أغلب الأحيان قبل استخدامه في التطبيقات المختلفة. بلغ الإنتاج العالمي من الكبريت سنة 2011 حوالي 69 مليون طن متري، ساهمت فيه أكثر من 15 دولة بمليون طنّ على حدة، أمّا باقي الدول المساهمة بأكثر من 5 ملايين طن فهي الصين (9.6) والولايات المتّحدة الأمريكية (8.8) وكندا (7.1) وروسيا (7.1).[59]
النظائر
لعنصر الكبريت 23 نظيراً معروفاً، أربعةٌ منها مستقرّة وهي 32S بوفرة طبيعية 94.99%±0.26% (أكثر النظائر وفرةً) و33S بوفرةٍ مقدارها 0.75%±0.02% و34S بوفرةٍ مقدارها 4.25%±0.24% و36S بوفرةٍ مقدارها 0.01%±0.01%.[60][61] أمّا باقي النظائر فهي مشعّة، وأطولها عمراً هو النظير 35S، حيث يبلغ عمر النصف 87 يوماً، ويتشكّل من تشظية الأشعّة الكونيّة لنظير الآرغون 40Ar؛ في حين أنّ النظائر المشعّة المتبقيّة للكبريت لها عمر نصف أقلّ من ثلاث ساعات.
عند ترسّب معادن الكبريتيدات، فإنّ التوازن النظيري بين الطور السائل والطور الصلب يمكن أن يسبّب فرقاً طفيفاً في التجزئة النظيرية لقيم النظير كبريت-34 بالنسبة إلى النظير الأكثر انتشاراً كبريت-32؛ ويُرمَز لذلك الفرق δ34S. تستخدم تلك الفروقات في عيّنات المعادن ذات الأصل المشترك لتقدير درجة حرارة التوازن، كما يستفاد منها، إلى جانب تفاوت قيم النظير كربون-13 δ13C، في معادن الكربونات ومعادن الكبريتيدات من أجل تقدير حموضة الوسط (pH) وانفلاتية الأكسجين في المائع الحامل أثناء تشكّل المعدن الخام. تُحسَب قيمة δ34S هذه على الشكل:[62]
- ‰
تساهم البكتريا منتزعة الكبريت في التغيّر الطبيعي لنسب توزّع نظائر الكبريت، إلّا أنّ ذلك التغيّر يمكن أن يعود إلى النشاط البشري. يستخدم الكبريت المخصَّب في دراسات علم المياه، حيث يؤدّي معرفة نسبة النظائر في تتبّع مصادر التلوث.
الخواص الفيزيائية

يوجد الكبريت في الطبيعة على عدّة أشكال (متآصلات) من الجزيئات متعدّدة الذرّات المختلفة في عدد وترتيب الذرّات فيها؛ وتعتمد الخواص الفيزيائية للكبريت والتحوّل بين هذه الأشكال اعتماداً كبيراً على درجة الحرارة. بذلك يعدّ الكبريت أكثر العناصر الكيميائية تعدّداً بالأشكال داخل وبين الجزيئية، ولكنّ الشكل الأكثر استقراراً هو الشكل الحلقي ثماني الكبريت، وهو الذي يوجد بشكل حرّ في الطبيعة. يوجد ثماني الكبريت في الشروط القياسية على شكل صلب أصفر اللون سهل التفتّت. ينصهر الكبريت عند الدرجة 115.21 °س؛ ويغلي عند الدرجة 444.6 °س؛ وهو يتسامى بسهولة.[63]
عند تسخين الكبريت إلى درجة حرارة تتجاوز 119 °س يتشكّل في البداية سائل قليل اللزوجة ذو لون أصفر فاقع، وهو يتكوّن بمعظمه من حلقي ثماني الكبريت S8. عند تثبيت درجة الحرارة يتسبّب تحوّل جزئي لحلقات ثماني الكبريت إلى حلقات أصغر بحدوث انخفاض لنقطة التجمد، والتي تبلغ حدّها الأدنى عند 114.5 °س. يؤدّي الاستمرار بالتسخين إلى رفع لزوجة المصهور بسبب تشكّل البوليمرات،[63] والتي تبلغ قيمتها الأعظمية عند 187 °س؛ وعندها تتكسّر حلقات الكبريت وتشكّل جزيئات طويلة السلسلة، وهو مثال على بلمرة فتح الحلقة. تتكسّر هذه السلاسل عند درجات حرارة تفوق هذه الدرجة، وتتناقص حينها اللزوجة بشكل مستمرّ؛ ويكون لمصهور الكبريت لون أحمر فوق الدرجة 200 °س. تبلغ كثافة الكبريت وسطياً حوالي 2 غ/سم3 حسب نوع المتآصل؛ وتعدّ جميع متآصلات الكبريت ممتازةً من حيث مقدرتها على العزل الكهربائي.
الأشكال المختلفة
يشكّل الكبريت أكثر من 30 متآصلاً من الأشكال المختلفة، وذلك بشكل أكبر من أيّ عنصرٍ كيميائيٍ آخر.[64] أكثر هذه المتآصلات انتشاراً هو ثماني الكبريت الحلقي S8، ولكن توجد حلقات أخرى عديدة من هذا العنصر،[64] مثل الحلقة السباعية S7، والتي تتميّز بلونها الأصفر الأغمق من S8. بيّنت التجارب باستخدام تقنية استشراب السائل رفيع الإنجاز (HPLC) أنّ الكبريت العنصري في الحالة السائلة يكون في حالة توازن بين مزيج يتكوّن بشكل رئيسي من S8 مع وجود نسبة من S7، وكمّيات صغيرة من S6.[65] جرى التمكّن من تحضير حلقات أكبر من الكبريت، بما في ذلك S12 وS18.[66][67] يمكن الحصول على شكل لابلّوري من الكبريت (يسمّى أيضاً الشكل البلاستيكي) بإجراء عملية تبريد سريعة لمصهور الكبريت، مثل سكبه الفجائي في الماء البارد. بيّنت دراسة بالأشعّة السينية أنّ الشكل اللابلّوري يكون على هيئة لولب، يحوي ثمان ذرّات في كلّ لفة.[64]
- ثماني الكبريت الحلقي

تترتّب الذرّات في ثماني الكبريت S8 على هيئة حلقة لها شكل التاج، ويبلغ طول الرابطة S-S مقدار 203.7 بيكومتر (بم)، أمّا زاوية الرابطة S-S-S فتبلغ 107.8°، في حيت تبلغ الزاوية ثنائية السطح مقدار 98°؛[63] وتكون الزمرة النقطية من النمط D4d، ويبلغ عزم ثنائي القطب 0 ديباي.[68] يوجد ثماني الكبريت في الطبيعة في الشروط الديناميكية الحرارية القياسية على الشكل ألفا α، وتكون البنية فيه وفق نظام بلوري معيني قائم. تتبع البلّورات وفق ذلك الزمرة الفراغية Fddd، وتكون أبعاد الشبكة البلّورية a = 1044 بم، وb = 1284 بم وc = 2437 بم؛ مع وجود 16 وحدة صيغة S8 لكل وحدة خلية.
عند الدرجة 95.2 °س، وهي دون نقطة انصهاره، يغيّر ثماني الكبريت الحلقي من بنيته البلورية من الشكل ألفا α إلى الشكل بيتّا β؛[63] لكن ترتيب الذرّات في حلقة S8 الثمانية لا تتأثّر بهذا التغيّر الطوري، ولكنه بالمقابل يؤثّر على التآثرات بين الجزيئية. يتبلور الكبريت على الشكل بيتّا وفق نظام بلوري أحادي الميل، وتكون فيه أبعاد الشبكة البلورية وفق ما يلي: a = 1085 بم وb = 1093 بم و c = 1095 بم؛ وزاوية الميلان بمقدار 96.2°؛ مع وجود 6 وحدة صيغة S8 لكلّ وحدة خلية؛ ولذلك يكون الشكل بيتّا أقلّ كثافة من الشكل ألفا. ينصهر الشكل بيتّا عند الدرجة 119.6 °س، وهي تدعى نقطة الانصهار المثالية للكبريت، وذلك في مقابل 115 °س التي تمثل نقطة الانصهار الطبيعية للكبريت.[69] عند التبريد يتحوّل الكبريت عائداً إلى الشكل ألفا.[63] يوجد شكل بلوري ثالث ونادر من ثماني الكبريت، وهو الشكل غامّا، الذي يعرَف أيضاً باسم روسيتسكيت، وتتّبع فيه البلّورات نظاماً أحادي الميل أيضاً.[64]
- سباعي الكبريت الحلقي
وهو أقلّ متآصلات الكبريت ثباتية؛[64] حيث يقع طول الرابطة S-S فيه ضمن مجال غير عادي بين 199.3 و 218.1 بيكومتر. توجد منه أربعة أشكال بلّورية معروفة (ألفا α- وبيتا β- وغاما γ- ودلتا δ-)؛[63] ويُكشَف عنه غالباً إمّا في الحالة المصهورة أو في محاليل الكبريت في المذيبات اللاعضوية.
- سداسي الكبريت الحلقي
هو متآصل للكبريت تترتّب فيه الذرّات بشكل حلقي على هيئة الكرسي، ويكون طول الرابطة S–S مقدار 2.057 بم؛ وزاوية الرابطة S–S–S مقدار 102.2 °.[70] يوجد سداسي الكبريت الحلقي على شكل بلّورات حمراء برتقالية، وهي تتبع النظام البلوري السداسي؛ وحُضّر أوّل مرّة سنة 1891 من الكيميائي إنغلز بمفاعلة ثيوكبريتات الصوديوم مع حمض الهيدروكلوريك؛[71] لذلك يعرف باسم «كبريت إنغلز». عند الشروط القياسية يتحوّل سداسي الكبريت إلى ثماني الكبريت الأكثر استقراراً.[63]
- أشكال مختلفة للكبريت

هناك أشكال حلقية مختلفة للكبريت تتفاوت في أحجامها، ولكنها غير مستقرّة على العموم؛ وأصغر الحلقات المكتشفة هي حلقة خماسية للكبريت، ولكنّه لم يُتَمكَّن من عزلها، إنّما جرى الكشف عنها فقط في حالة البخار.[64] أمّا الحلقات الأكبر المكوّنة من 9 ذرات وما فوق (Sn حيث n = 9 – 15, 18, 20) فيمكن تحضيرها ضمن شروط خاصّة،[69] ويعدّ الشكل الاثناعشريّ هو الشكل الأكثر استقراراً فيما بينها، ويمكن تخيّل بنيته على شكل ثلاثة مستويات متوازية، تقع فيها ثلاث ذرّات كبريت في الأعلى وستّ في المنتصف وثلاث في الأسفل.[63]
عند درجات حرارة مرتفعة يمكن الحصول على سلاسل بوليمرية من الكبريت، وهي شديدة التنوّع من حيث طول السلسلة وشكلها والشروط الحرارية التي تتشكّل فيها.[72] هناك خمسة متآصلات مميّزة للكبريت يمكن الحصول عليها عند ضغوط مرتفعة؛[64] أمّا في الحالة الغازية فيمكن أن تتشكّل جزيئات صغيرة S2 – 4، تتراوح بين الكبريت الثنائي والثلاثي والرباعي، وهي تتشكّل عند درجات أعلى من 550 °س.[63]
الخواص الكيميائية

باستثناء الغازات الخاملة وبعض الفلزّات النبيلة مثل الذهب والبلاتين وكذلك بعض اللافلزات مثل النتروجين واليود،[69] فإنّ الكبريت يتفاعل تقريباً مع أغلب العناصر الكيميائية حتى غير النشيطة منها ويشكّل معها مركّبات، كما هو الحال مع الإريديوم الذي يشكّل معه مركب ثنائي كبريتيد الإريديوم.[73] تتطلّب بعض هذه التفاعلات المذكورة درجات حرارة مرتفعة لحدوثها؛[74] ومن جهة أخرى، يتفاعل الكبريت مع الزئبق عند درجة حرارة الغرفة ليشكّل كبريتيد الزئبق الثنائي.
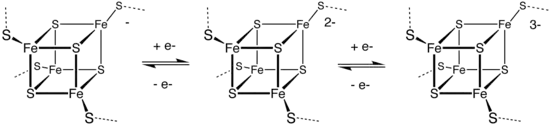
يحترق الكبريت في الهواء عند درجات حرارة تزيد عن 250 °س بلهبٍ أزرق مع تشكّل لغاز ثنائي أكسيد الكبريت، والذي له رائحة خانقة ومهيّجة. بوجود الهواء الرطب يتأكسد الكبريت مع مرور الوقت، بحيث يمكن الحصول على ثنائي أكسيد الكبريت ومنه إلى حمض الكبريتيك. لا ينحلّ الكبريت في الماء، ولكنه ينحلّ في ثنائي كبريتيد الكربون، وبدرجة أقلّ في المذيبات العضوية اللاقطبية مثل البنزين والتولوين. لا يتفاعل الكبريت مع الأحماض غير المؤكسِدة؛ في حين أنّ الأحماض المؤكسِدة مثل حمض النتريك قادرة على أكسدته إلى أيونات الكبريتات الموافقة. في المحاليل القلوية يخضع الكبريت إلى تفاعل عدم تناسب ليعطي الكبريتيد والكبريتيت. ينحلّ الكبريت في محاليل الكبريتيدات ليعطي مركّبات متعدد الكبريتيد المختلفة؛ في حين أنّ إذابته في محاليل الكبريتيت يؤدي في النهاية إلى تشكّل مركبات ثيوكبريتات الموافقة. يمكن أن يشكّل الكبريت أيونات ملوّنة متعدّدة الكهارل، مثل 2+S8 (أزرق غامق) و2+S4 (أصفر) و2+S16 (أحمر)، وذلك عندما يتفاعل مع المؤكسدات متوسّطة القوّة في الأوساط الحمضية القوية.[75] يُستحصَل على هذه المحاليل الملوّنة مثلاً عند إذابة الكبريت في الأوليوم، وهي ظاهرة وُثّقَت أوّل مرّة سنة 1804، ولكن لم يُعرَف تفسيرٌ لها إلّا في ستينيات القرن العشرين.[63] بالمقابل، يؤدّي اختزال الكبريت إلى الحصول على متعدّدات الكبريتيد، والتي تتألّف من سلاسل من ذرّات الكبريت التي تنتهي بأنيونات كبريتيد سالبة الشحنة −S:
يعكس هذا التفاعل مقدرة الكبريت على تشكيل سلاسل ذاتية. تؤدّي برتنة هذه السلاسل إلى الحصول على متعدّدات السلفان الموافقة ذات الصيغة العامة H2Sx، وأبسطها هو ثنائي السلفان. من التطبيقات المعروفة لهذه المركّبات الاستفادة من الطاقة الناتجة عن تفكّكها وتشكّلها في تخزين الطاقة في البطاريات الحرارية، كما هو الحال في بطارية ليثيوم-كبريت وبطارية صوديوم-كبريت.
تشكّل الأنواع الكيميائية الحاوية على الكبريت رابطة تناسقية بسهولة نسبياً مع الفلزّات الانتقالية؛ ونظراً لأنّ الأخيرة مستخدمةٌ بشكلٍ أساسيٍّ في الحفّازات، فإنّ هذا التآثر الكيميائي يشكّل خطراً على فعالية الحفاز، ممّا يؤدّي إلى خموله، وتنشأ ظاهرة تعرف باسم تسمّم الحفاز، والتي تحدث حتى بتراكيز منخفضة من الأنواع الكبريتية.[76] يدخل الكبريت مادّةً أوّليةً في بعض تفاعلات الاصطناع العضوي، كما هو الحال في تفاعل أسينغر لتحضير مشتقّات الثيازولين؛[77] وكذلك في تفاعل غيفالد، وهو بدوره تفاعل متعدّد المكوّنات أيضاً، وذلك من أجل تحضير مشتقّات 2-أمينو الثيوفين؛[78] كما يتفاعل الكبريت مع كواشف غرينيار ليشكّل مركّبات الثيوإيثرات أو الثيولات.[79]
المركبات الكيميائية
تتراوح حالات الأكسدة التي يأخذها الكبريت في مركّباته الكيميائية من −2 إلى +6. تبلغ طاقتا تأيّن الكبريت الأولى والثانية مقدار 999.6 و2252 كيلوجول/مول، على الترتيب؛ ورغم ذلك فإنّ حالة الأكسدة +2 نادرة للكبريت، في حين أنّ الحالتان +4 و+6 أكثر شيوعاً في مركّباته الكيميائية. تبلغ طاقتا تأين الكبريت الرابعة والسادسة مقدار 4556 و8495.8 كيلوجول/مول، على الترتيب؛ ويعود ارتفاع القيمة إلى الانتقال الإلكتروني الداخلي بين المدارات الذرّية.
مع الهيدروجين والفلزات
يشكل الكبريت مع الهيدروجين مركّب كبريتيد الهيدروجين H2S، وهو غاز قابل للاشتعال عديم اللون له رائحة البيض الفاسد، وهو يتشكّل من تفاعل الكبريتيدات MxSy مع الأحماض القوية مثل حمض الهيدروكلوريك HCl. يرافق كبريتيد الهيدروجين الغاز الطبيعي، وينتج بكمّيات كبيرة من عمليات نزع الكبريت المهدرج لقطفات النفط. كيميائياً يعدّ كبريتيد الهيدروجين حمضاً ضعيفاً،[80] وهو لا ينحلّ بشكل جيّد في الماء، لكنّه ينحلّ بشكلٍ أكبر في الكحول. يمكن أن تشكّل متعدد الكبريتيدات مركّبات متعدّدات السلفان عند برتنتها.
يتفاعل كبريتيد الهيدروجين طبيعياً ومخبرياً مع أيونات الفلزّات الثقيلة، مثل الأكاسيد والهيدروكسيد، ليشكّل الكبريتيدات الموافقة، كما هو الحال مع كبريتيد الزئبق الثنائي (الزنجفر) وكبريتيد الرصاص الثنائي (الغالينا)؛ وتستخدم هذه الوسيلة في الكيمياء التحليلية في التحليل اللاعضوي النوعي. أمّا ثنائي كبريتيد الهيدروجين H2S2، فهو يوجد على شكل سائلٍ مستقرّ، ولكنّ أملاحه معروفة، وهي أملاح ثنائي الكبريتيد، وتوجد في الطبيعة على شكل البيريت على سبيل المثال.[81]
الأكاسيد
للكبريت أكاسيد متعدّدة، يستحصَل على الشكلين الأشهر منهما نتيجة احتراق الكبريت بأكسجين الهواء:
يوجد ثنائي أكسيد الكبريت SO2 في الشروط القياسية على هيئة غازٍ عديم اللون، ويمتاز بصفاته المهيّجة ورائحته اللاذعة وطبيعته الحمضية؛ وهو ينحلّ بسهولة في الماء ليشكّل حمض الكبريتوز، لذلك يعدّ هذا الأكسيد من الناحية الكيميائية أنهيدريداً للحمض المذكور.[69] أمّا ثلاثي أكسيد الكبريت SO3 فهو أنهيدريد حمض الكبريتيك، ويوجد هذا الأكسيد في الشروط القياسية على هيئة بلّورات إبرية عديمة اللون، تتميّز بقابليتها المرتفعة للاسترطاب، وهي تنحلّ بشكل ناشر للحرارة في الماء لتشكّل حمض الكبريتيك. لا يعدّ أحادي أكسيد الكبريت SO مستقرّاً إلّا عندما يكون ممدّداً، أمّا في التراكيز المرتفعة فهو سرعان ما يتحوّل إلى ثنائي أكسيد ثنائي الكبريت S2O2. هناك مجموعةٌ من تحت أكاسيد الكبريت والتي لها الصيغة العامة SmOn، حيث m <2n، وأبسط مركّب منها هو أحادي أكسيد ثنائي الكبريت S2O؛ لكنّها أكاسيد غير مستقرّة، ويمكن أن يُقدَّر ترتيب استقرارها على الشكل S2O> S2O2> SO.[82]
الأحماض الأكسجينية
يشكّل الكبريت سلسلةً من الأحماض الأكسجينية، التي لا يمكن عزل بعضها، لذا لا تعرف إلا على شكل الأملاح الموافقة. يمكن لأحماض الكبريت الأكسجينية للكبريت أن تحوي ذرّةً واحدةً من الكبريت، أو أن يكون حمضاً مضاعفاً مؤلّفاً من ذرتي كبريت؛ أو تكون على شكل أحماض أكسجينية متعدّدة الكبريت، ومن الأمثلة على الأخيرة الأحماض متعددة الثيونيك ذات الصيغة العامة Sn(SO3H)2 (حيث n> 2).
هناك صلة وصل بين ثنائي أكسيد الكبريت وأيون الكبريتيت 2−SO3 مع حمض الكبريتوز H2SO3؛ في حين توجد صلة وصل بين ثلاثي أكسيد الكبريت وأيون الكبريتات 2−SO4 مع حمض الكبريتيك H2SO4. يتحدّ حمض الكبريتيك مع ثلاثي أكسيد الكبريت ليتشكّل الأوليوم، وهو محلول من حمض ثنائي الكبريتيك (حمض البيروكبريتيك H2S2O7) في حمض الكبريتيك. يعدّ الأخير من المؤكسدات القوية، لأنّ الكبريت يكون فيه في حالة أكسدة مرتفعة. بالمقابل يمكن أن يشكّل الكبريت أحماضاً أكسجينية وهو في حالة أكسدة متدنيّة، كما هو الحال في حمض الثيوكبريتيك H2S2O3، ولكن أملاحه من الثيوكبريتات 2−S2O3 أشهر منه، وهي من المختزلات المعروفة.
| متوسّط حالة أكسدة ذرّة/ذرّات الكبريت | البنية الجزيئية | اسم الحمض | اسم الملح الموافق | |
|---|---|---|---|---|
| الأحماض من النمط H2SOn | ||||
| +II | حمض الهيبوكبريتوز (أو حمض السلفوكسيليك) H2SO2 | هيبوكبريتيت (أو سلفوكسيلات) | ||
| +IV | حمض الكبريتوز H2SO3 | كبريتيت / بيكبريتيت | ||
| +VI |  | حمض الكبريتيك H2SO4 | كبريتات / بيكبريتات | |
| +VI |  | حمض بيروكسي أحادي الكبريتيك (أو حمض البيركبريتيك أو حمض كارو) H2SO5 | بيروكسي أحادي كبريتات | |
| الأحماض من النمط H2S2On | ||||
| +I | حمض الثيوكبريتوز H2S2O2 | ثيوكبريتيت (أملاحه غير معروفة) | ||
| +II |  | حمض الثيوكبريتيك H2S2O3 | ثيوكبريتات | |
| +III | حمض ثنائي الثيونوز H2S2O4 | ثنائي ثيونيت | ||
| +IV |  | حمض ثنائي الكبريتوز H2S2O5 | ثنائي كبريتيت (أو ميتابيكبريتيت أو بيروكبريتيت) | |
| +V |  | حمض ثنائي الثيونيك H2S2O6 | ثنائي ثيونات | |
| +VI |  | حمض ثنائي الكبريتيك (أو حمض البيروكبريتيك أو الأوليوم) H2S2O7 | ثنائي كبريتات (أو بيروكبريتات) | |
| +VI |  | حمض بيروكسي ثنائي الكبريتيك H2S2O8 | بيروكسي ثنائي كبريتات | |
الهاليدات
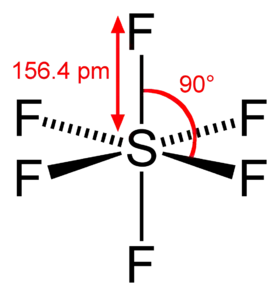
هناك العديد من هاليدات الكبريت المعروفة، وبعضها لها تطبيقات مهمّة في الصناعة، وخاصّةً الفلوريدات والكلوريدات؛ أمّا البروميدات فهي قليلة الشهرة، في حين أنّ يوديدات الكبريت غير معروفة. أشهر الفلوريدات هو سداسي فلوريد الكبريت SF6، ويوجد في الشروط القياسية على هيئة غاز كثيف، ويستخدم وسطاً عازلاً في المحوّلات الكهربائية مرتفعة التوتّر.[69] يوجد ثنائي فلوريد الكبريت SF2 على شكل غاز عديم اللون، وهو غير مستقرّ؛ أمّا رباعي فلوريد الكبريت فهو كاشف عضوي نادر الاستخدام ومرتفع السمّية ويوجد أيضاً على شكل غاز عديم اللون.[83] هناك أيضاً فلوريدات مضاعفة، مثل ثنائي فلوريد ثنائي الكبريت S2F2، والذي يوجد على شكل غاز عديم اللون؛ في حين أنّ عشاري فلوريد ثنائي الكبريت S2F10 هو سائل عديم اللون له رائحة ثنائي أكسيد الكبريت.
من جهةٍ أخرى، فإنّ ثنائي كلوريد الكبريت SCl2 وثنائي كلوريد ثنائي الكبريت S2Cl2 هي كواشف عضوية كلورية للكبريت ومهمّة في المختبرات الكيميائية؛[84] وكذلك الأمر بالنسبة للكلوريدات الأكسجينية، مثل كلوريد الثيونيل SOCl2 وكلوريد السلفوريل SO2Cl2 المستخدَمة بكثرة في الاصطناع العضوي؛[85] أمّا رباعي كلوريد الكبريت فهو غير مستقرّ.[84]
يُعرَف من بروميدات الكبريت مركّب ثنائي بروميد ثنائي الكبريت S2Br2 وبروميد الثيونيل SOBr2، والأخير من البروميدات الأكسجينية. من الهاليدات المختلطة المعروفة للكبريت مركّب كلوريد خماسي فلوريد الكبريت SClF5؛ كما تعرف أيضاً هاليدات أكسجينية مختلطة من النمط SOX2 للفلور والكلور؛[69] كما توجد مشتقّات هالوجينية من حمض الكبريتيك، يعرف منها حمض الفلوروكبريتيك HSO3F وحمض الكلوروكبريتيك HSO3Cl؛ في حين أنّ حمض البروموكبريتيك غير مستقرّ؛ أمّا حمض اليودوكبريتيك فغير معروف.
مركبات لاعضوية أخرى

من مركّبات الكبريت مع النتروجين اللاعضوية المثيرة للاهتمام مركّب رباعي نتريد رباعي الكبريت S4N4، إذ يعطي تسخينه بوليمراً لاعضوياً من متعدد الثيازيل SN)x)، والذي له خواص كيميائية فلزّية، رغم عدم احتوائه على أيّة فلزّات في تركيبه؛[86][87] كما يمكن أن يُستحصَل على هذا البوليمر أيضاً من مركّب ثنائي نتريد ثنائي الكبريت S2N2.[88]
يحوي أنيون الثيوسيانات −SCN في تركيبه بالإضافة للكبريت على النتروجين والكربون، وهو ملح حمض الثيوسيانيك HSCN. تؤدّي أكسدة الثيوسيانات إلى الحصول على مركّب ثيوسيانوجين SCN)2)، والذي يكون ترتيب الذرات فيه على الشكل NCS-SCN.[89]
يوجد هناك عددٌ كبيرٌ من كبريتيدات الفوسفور المتفاوتة في أشكالها ونسب عدد الذرّات فيما بينها، ومن أمثلتها المركّبات القفصية P4S10 وP4S3.[90][91]
مركبات الكبريت العضوية
- أمثلة على مركّبات كبريت عضوية
 أليسين، مركّب كبريت عضوي يوجد في الثوم.
أليسين، مركّب كبريت عضوي يوجد في الثوم.
 ثنائي كبريتيد ثنائي الفينيل، أحد المركّبات الحاوية على جسر كبريتيدي.
ثنائي كبريتيد ثنائي الفينيل، أحد المركّبات الحاوية على جسر كبريتيدي. ثنائي بنزوثيوفين، مركّب حلقي غير متجانس موجود في النفط.
ثنائي بنزوثيوفين، مركّب حلقي غير متجانس موجود في النفط. البنية الأساسية للبنسلين، وهو مضاد حيوي معروف.
البنية الأساسية للبنسلين، وهو مضاد حيوي معروف.
يوجد العديد من أصناف مركّبات الكبريت العضوية منها:[92]
- الثيولات (أو المركبتانات كما كانت تسمى قديماً) R-SH: وهي مشابهات بنيوية للكحولات والفينولات؛ عندما تكون R من الألكيلات، وأبسطها ميثانثيول؛ ويمكن أن تكون R من الأريلات وأبسطها ثيوفينول.
- ثيوإيثرات R1-S-R2: وهي مشابهات بنيوية للإيثرات، وأبسطها مركّب كبريتيد ثنائي الميثيل CH3)2S).
- السلفوكسيدات R1-S(=O)-R2 والسلفونات R1-S(=O)(=O)-R2 وهي ثيوإيثرات ترتبط فيها ذرّة أكسجين واحدة أو اثنتين على الترتيب بذرّة الكبريت المركزية. من الأمثلة على السلفوكسيدات مركّب ثنائي ميثيل السلفوكسيد (DMSO)، وهو مذيب معروف؛ ومن الأمثلة على السلفونات مركّب سلفولان.
- الأحماض الأكسجينية الكبريتية العضوية، مثل أحماض السلفنيك RSOH وأحماض السلفينيك RSO2H، بالإضافة أحماض السلفونيك R−S(=O)2−OH، والأخيرة مستخدمة بشكل واسع في صناعة المنظفات.
- أملاح السلفونيوم +[SR3]: ومن أمثلتها ثنائي ميثيل بروبيونات السلفونيوم (DMSP)، وهو مركّب مهمّ في دورة الكبريت العضوية لبعض الأحياء البحرية.
- مركّبات كبريتية عضوية متنوّعة مثل المشتقّات الكبريتية للأحماض المعروفة مثل حمض الثيوفوسفوريك H3PO3S وحمض الثيوأسيتيك CH3COSH، والأخير هو أحد أحماض الثيوكربوكسيليك. ومن المركّبات الأخرى كل من ثيويوريا SC(NH2)2 وثنائي أكسيد الثيويوريا CH4N2O2S وغيرها.
إنّ أغلب المركّبات المذكورة تحوي في تركيبها على رابطة كربون-كبريت أحادية، وتعد الرابطة كربون-كبريت أطول من الرابطة كربون-كربون، إذ يبلغ طولها 183 بيكومتر في الميثانثيول و174 بيكومتر في الثيوفين.[93] يعدّ وجود روابط مضاعفة بين عنصري الكبريت والكربون غير شائع، وربما أشهر الأمثلة على وجودها هو مركّب ثنائي كبريتيد الكربون CS2، وهو سائل متطاير عديم اللون مشاله بنيوياً لثنائي أكسيد الكربون، وله تطبيقات صناعية مهمّة، مثل استخدامه في صناعة أنسجة الرايون. على العكس من أحادي أكسيد الكربون فإنّ أحادي كبريتيد الكربون غير مستقرّ، ولا يوجد إلّا في الأوساط الممدّدة جدّاً؛ وقد بُرهِنَ على وجوده في الوسط بين النجمي.[94]
تنتشر مركّبات الكبريت العضوية في الطبيعة، فهناك حمضان أمينيان أساسيان حاويان على الكبريت (ميثيونين وسيستئين). كما يوجد الكبريت العضوي في النفط، وذلك غالباً على شكل مركبات حلقية غير متجانسة من مشتقّات الثيوفين. تعدّ روابط ثنائي الكبريتيد S-S (جسور كبريتيدية) ذات أهمّية بنيوية في المركّبات الطبيعية، إذ تعطي خاصّة المتانة والمرونة للبروتينات والهرمونات، كما هو الحال في الكيراتين على سبيل المثال. عند إجراء عملية تجعيد صناعي للشعر، يُعمَد إلى تكسير الجسور الكبريتيدية كيميائياً باختزالها بمركّب حمض الثيوغليكوليك، ومن ثمّ بإعادة تشكيلها بعد إجراء التصفيف باستخدام بيروكسيد الهيدروجين. تتميّز مركّبات الكبريت العضوية برائحتها المنفّرة، وهي توجد طبيعياً مثلاُ على شكل مركّب أليسين الناتج عن تحوّل مركّب أليين في الثوم، والرائحة الكريهة الصادرة عن حيوان الظربان (3-ميثيل بوتانثيول). كما يمكن أن تستخدم خاصية الرائحة المنفّرة لمركّبات الكبريت العضوية صناعياً، إذ أنّها منبّهة قويّة لحاسّة الشم حيث تُضاف بتراكيز منخفضة كافية؛[95] كما هو الحال عند إضافة مركّبات كبريتية ذات رائحة مميّزة إلى الغاز المنزلي. تعود أقلّ عتبة كشف رائحة مسجلّة لمركّب طبيعي (بمقدار 4−10 جزء في البليون) إلى مركّب ثيوتربينول المستخلَص من الليمون الهندي (الكريب فروت).[96]
التحليل الكيميائي
- التحليل التقليدي
توجد عدّة تفاعلات كيميائية لإجراء التحليل النوعي للكبريت، من ضمنها:
- في حال وجوده في العيّنة يُحوّل الكبريت بعد التفاعل مع فلزّ الصوديوم الحرّ إلى كبريتيد الصوديوم، وهو جيّد الانحلال في الماء، بحيث تتشكّل أنيونات الكبريتيد. عند إضافة محلول ملحي من مركّبات الرصاص الثنائي يتشكّل راسب أسود اللون من كبريتيد الرصاص.
- يؤدّي إضافة حمض إلى مركّبات الكبريتيد غير المنحلّة تتشكّل رائحة مميّزة من غاز كبريتيد الهيدروجين، والذي يقوم بتسويد ورق مشبع بمحلول أسيتات الرصاص الثنائي نتيجة تشكّل كبريتيد الرصاص.
- تؤدّي أكسدة المركّبات الحاوية على الكبريت إلى تشكّل أيونات الكبريتيت والكبريتات، حيث يمكن الكشف عن الأخيرة باستخدام محاليل الباريوم الثنائي، إذ يتشكّل جرّاء ذلك راسب أبيض من كبريتات الباريوم:
أمّا الكبريتيت فيُكشَف عنه بواسطة بيكبريتات البوتاسيوم، حيث ينتج غاز ثنائي أكسيد الكبريت الحمضي ذو الرائحة الواخزة:
- التحليل الآلي
يمكن تحليل الكبريت مطيافياً باستخدام مطيافية الرنين المغناطيسي النووي 33S-NMR، وذلك من أجل تحليل الكبريت على شكل الكبريتيت أو الكبريتات؛ إلّا أنّ حساسية هذا الأسلوب التحليلي قليلة، بسبب ندرة الوفرة الطبيعية لهذا النظير.
كما يمكن وفق تقنية الاستشراب الغازي (الكروماتوغرافيا الغازية) الكشف عن الكبريت انتقائياً باستخدام كواشف عاملة وفق مبدأ الضيائية الكيميائية أو البلازما. أمّا من أجل تحديد المحتوى الكلّي من الكبريت في المركّبات العضوية فيمكن تحويلها إلى غاز كبريتيد الهيدروجين، ثم بتحليلها كروماتوغرافياً.[97]
الدور الحيوي
-Cystine_BLUE_Structural_Formula.png.webp)
ينتمي الكبريت إلى العناصر الحيوية المهمّة في خلايا الكائنات الحية، وله العديد من الوظائف الحيوية، وهو يدخل في دورة الغذاء على كافّة المستويات التصنيفية للكائنات الحية. تماثل الوفرة الطبيعية للكبريت في جسم الإنسان وفرة البوتاسيوم، وتقدّر كمّيته في جسم إنسان وزنه 70 كغ بحوالي 140 غرام، ويقدّر نسبياً بحوالي 0.25% وزناً؛ ويحوي الغلوبين عند الإنسان حوالي 0.6% وزناً كبريت.[98] يمكن لبعض الأنواع النباتية أن تحوي مكوّنات عضوية كبريتية مثل الأليين وغيرها، والمسؤولة عن الروائح المميّزة للبصل والثوم مثلاً، وذلك إلى نسبة تصل إلى حوالي 5% من وزنها الجاف.[99] عند تعرّض هذه المركّبات في حالتها الطازجة إلى أكسجين الهواء تتأكسد بمساهمة من نشاط إنزيمي إلى مكوّنات كبريتية عضوية مثل ثنائي كبريتيد ثنائي الأليل والأليسين، وهي المسؤولة عن الرائحة والنكهة المميّزة لهذه النباتات.[100]
البروتينات والعوامل المرافقة العضوية
غالباً ما يوجد الكبريت في خلايا الأجسام الحية من النباتات والحيوانات على شكل الحمضين الأمينيين السيستئين والميثيونين، بالتالي فهما يدخلان في تركيب جميع الببتيدات والبروتينات والإنزيمات الحاوية على هذين الحمضين الأمينيين. يعدّ الميثيونين من الأحماض الأمينية الضرورية لجسم الإنسان؛ وباستثناء البيوتين والثيامين، يُصطَنع منه حيوياً أغلب المركّبات الحيوية الحاوية على الكبريت في الجسم. يساهم إنزيم أكسيداز الكبريتيت (مؤكسدة الكبريتيت) في استقلاب الميثيونين والسيستئين عند الإنسان والحيوانات. تعدّ الرابطة ثنائية الكبريتيد (S-S) بين البقايا الطرفية للسيستين في السلاسل الببتيدية ذات أهميّة حيوية في تشكيل بنية البروتينات؛ حيث تعمل هذه الروابط على منح متانة وجساءة إضافية لها.[101] فعلى سبيل المثال تعود القوّة الهيكلية للريش والشعر إلى عدّة أسباب، منها المحتوى المرتفع من روابط S-S في الكيراتين. كما يساهم المحتوى المرتفع من روابط S-S في الشعر والريش أيضاً في عدم قابليتها للتحلّل، وفي إصدارها لرائحة مميّزة عند حرقها. يحوي البيض نسبةً مرتفعةً من الكبريت، وذلك من أجل تأمين تغذية كافية لتشكّل الريش عند الفراخ؛ وبسبب النسبة المرتفعة من الكبريت تلاحظ رائحة كبريتيد الهيدروجين عند تعفّن البيض.
هناك حمضان أمينيان آخران حاويان على الكبريت، وهما هوموسيستئين والتورين، ولكنهما لا يُشفّران من الدنا أثناء اصطناع البروتينات. تستخدم العديد من الإنزيمات ذات الأهمية الخلوية المجموعات الكبريتية الداخلة في تركيبها من أجل المشاركة الفعّالة في التفاعلات التي تتضمّن مجموعة أسيل؛ ومن الأمثلة المعروفة كلّ من مرافق الإنزيم-أ وألفا حمض الليبويك.[101] في العمليات الكيميائية الحيوية داخل الخلية يسهم الكبريت بعمليات الأكسدة والاختزال داخلها؛ إذ أنّ الغلوتاثيون على سبيل المثال، وهو ثلاثي ببتيد يحوي الكبريت في تركيبه، يقوم بدور مختزل بواسطة وحدة الثيول (SH-) الطرفية. كما تقوم بروتينات ثيوريدوكسين الصغيرة بدورٍ مهمّ في عمليات الاختزال اعتماداً على وجود وحدات سيستئين في بنيتها.
إنّ عملية توليد الميثان، وهي عملية تحوّل كيميائية حيوية مهمّة ومتعدّدة المراحل للحصول على غاز الميثان من غاز ثنائي أكسيد الكربون، تتطلّب وجود العديد من العوامل المرافقة العضوية الحاوية على الكبريت، بما فيها مرافق الإنزيم M، وهو المركّب الطليعي (السلف) المباشر قبل الميثان.[102]
البروتينات الفلزية والعوامل المرافقة اللاعضوية
تعدّ البروتينات الفلزية، التي يتكوّن موضعها الفعال من معقّد فلزّ انتقالي قادر على الارتباط بذرّات الكبريت، من المكوّنات ذات الأهمية للإنزيمات المسؤولة عن عمليات انتقال الإلكترون البينية.[103] من الأمثلة على ذلك، كلٌ من بلاستوسيانين والعديد من البروتينات الحاوية على فلزّات النحاس والنيكل والحديد. تتضمّن الأمثلة الأخرى كذلك العناقيد الحديدية-الكبريتية، مثل مركّبات الفيريدوكسين، التي تقوم بدورٍ حيويٍ بنقل الإلكترونات داخل الخلايا.[104] أمّا في البكتريا، فإنّ إنزيمات نتروجيناز المهمّة تكون حاوية على عنقود Fe–Mo–S، ولها دور تحفيزي مهم ّفي عملية تثبيت النتروجين.[105]
دورة الكبريت واستقلابه
كانت دورة الكبريت أولى الدورات الحيوية الجيوكيميائية المكتشَفة، وذلك في أواخر القرن التاسع عشر، حيث وجد سيرجي وينوجرادسكي أنّ بعض أنواع البكتريا التي تعيش في وسطٍ غنيٍّ بالكبريت تقوم بأكسدة غاز كبريتيد الهيدروجين للحصول على مصدرٍ للطاقة. وُجد لاحقاً أنّ الأحياء المؤكسِدة للكبريت تستخدم أنواع كيميائية أخرى إلى جانب كبريتيد الهيدروجين، يكون فيها الكبريت بحالة أكسدة دنيا مثل الكبريت العنصري والكبريتيت والثيوكبريتات، بالإضافة إلى متعدّدات الثيونات مثل رباعي الثيونات.[106] تعتمد هذه البكتريا على إنزيمات تقوم بأكسدة الأنواع الكبريتية إلى كبريتات. توجد هناك حتّى بعض الكائنات الحية جمادية التغذية من البكتريا والعتائق والقادرة على استخدام الطاقة الناتجة من استقلاب الكبريت في إنتاج السكّريات، وهي عملية تعرف باسم التركيب الكيميائي؛ حيث تستخدم مركّبات الكبريت مثل كبريتيد الهيدروجين بدلاً من الماء مانحاً للإلكترونات بشكلٍ مشابهٍ لما هو عليه في التركيب الضوئي، حيث يقوم الأكسجين هناك بدور مستقبل للإلكترونات. تكثر هذه الأنواع من الكائنات الحية المعتمدة على الكبريت في استقلابها بالقرب المنافس المائية الحرارية، كما توجد أنواع أخرى تَكَيَّفَ أسلوب غذائها بالتعايش مع هذه الكائنات الحية، ومنها الدودة الأنبوبية الكبيرة. من جهةٍ أخرى، توجد هناك أنواع من بكتيريا مختزلة للكبريت تقوم بعملية اختزال حيوي للكبريتات إلى كبريتيد الهيدروجين.[107]
تقوم النباتات بامتصاص الكبريت من التربة على شكل كبريتات، ومن ثم تختزل إلى كبريتيد عبر الكبريتيت، ثم تُحوَّل داخل النبات إلى سيستئين ومركّبات كبريتية عضوية أخرى.[108] تتطلّب عملية التحويل إلى مكوّنات حيوية أخرى داخل النبات (عملية التمثّل) بالنسبة للكبريت مقداراً من الطاقة يفوق ما تتطلّبه عمليّة تَمَثُّل النترات.[108] من جهةٍ أخرى، يؤثّر نقص الكبريتات في التربة سلباً على محصول النباتات.[109]
الأثر البيئي

بسبب احتواء الوقود الأحفوري مثل الفحم القاري أو الفحم البني أو النفط على الكبريت فإنّ المعالجة خلال عمليات الاستخراج والتكرير تطلق كمّيات معتبرة من غاز ثنائي أكسيد الكبريت SO2. يُقدّر أنّ النشاط البشري يساهم بحوالي 35% من انبعاثات هذا الغاز إلى الغلاف الجوّي بكمّية تصل إلى حوالي 400 مليون طنّ سنوياً.[110] يعدّ غاز ثنائي أكسيد الكبريت من الملوّثات، فهو من مكوّنات الضباب الدخاني (ضبخان) المؤذي للصحة؛ كما يمكن أن يتأكسد إلى ثلاثي أكسيد الكبريت SO3، والذي يمكن أن يتحوّل بسهولة إلى حمض الكبريتيك H2SO4 عند نزول المطر، وبذلك يتشكّل ما يعرف باسم المطر الحمضي المدمّر للبيئة.[69]
لذلك فإنّه غالباً ما تُلزَمُ المنشآت المستخرِجة للطاقة بإجراء عملية نزع كبريت غاز العادم. تعتمد تلك العملية بشكلٍ أساسيٍّ على إجراء غسيل للغاز الحمضي بتمريره في وحدة ماصّة ضمن وسط قاعدي، وغالباً من محلول هيدروكسيد الكالسيوم، والذي يقوم بامتصاص غاز ثنائي أكسيد الكبريت ليشكّل في نهاية التفاعل مركّب كبريتات الكالسيوم (الجص) وفق المعادلة:
بالإضافة إلى ذلك فقد جرى تطوير عمليات لنزع أو تخفيض نسبة الكبريت في المشتقّات النفطية مثل نزع الكبريت المهدرج أو عملية كلاوس. إلّا أنّ تلك العمليات لم تكن كافية بالشكل الكافي للحدّ من الاحترار العالمي، ممّا تطلّبَ اتخاذَ تشريعات مناخية على مستوى العالم، والتي تمثّلت بانعقاد مؤتمر باريس للمناخ وتوقيع اتفاقيته.[111] جرّاء ذلك أعلنت المنظمة البحرية الدولية (IMO) على سبيل المثال أنّه ابتداءاً من مطلع سنة 2020 يجب أن لا يزيد محتوى الكبريت في زيت الوقود المستخدم في البواخر والناقلات عن مقدار 0.50% وزناً.[112]
الاستخدامات

يستخدم عنصر الكبريت بشكلٍ أساسي لتحضير مركّبات الكبريت الأخرى، وأهمّها حمض الكبريتيك؛ كما يتفاعل مباشرةً مع الميثان لتحضير ثنائي كبريتيد الكربون، والذي يستخدم لتحضير السيلوفان والرايون.[21] لعنصر الكبريت تطبيقات بحدّ ذاته، فهو يستخدم من أجل فلكنة المطاط، حيث يساهم تشكل سلاسل متعدد الكبريتيد في زيادة تَشَبُّك البوليمر العضوي؛ كما يضاف عنصراً في تحضير أنواع خاصة من الفولاذ.
لمركّبات الكبريت اللاعضوية استخدامات كثيرة متنوّعة، فعلى سبيل المثال تستخدم كمّيات كبيرة من الكبريتيت (السلفيت) في تبييض الورق؛ كما يستخدم مركب كبريتات الكالسيوم في صناعة الإسمنت والأسمدة. بالمقابل تصنّف مركّبات الكبريت العضوية ضمن الكيماويات النقيّة الدقيقة ذات الأهمّية في عددٍ من الصناعات، مثل صناعة الأدوية والمبيدات والأصبغة.
حمض الكبريتيك
إن أكثر من حوالي 85% من الكبريت المستخرج يُحوَّل إلى حمض الكبريتيك، وهي مادة كيميائية أولية مهمّة. يُحضَّر حالياً وفق عملية التلامس، وفيها يُحوّل الكبريت إلى أكاسيده ثم يُعالَج بالماء بوجود حفّاز من خماسي أكسيد الفاناديوم V2O5. لحمض الكبريتيك أهمّية صناعية كبيرة؛ فعلى سبيل المثال، كان حمض الكبريتيك أكثرَ مادّة كيميائية لاعضوية منتجة في الولايات المتحدة الأمريكية سنة 2010.[113] يُستخدَم أكثر من 60% من حمض الكبريتيك المنتَج في صناعة الأسمدة؛[114] كما يستخدم بشكل أساسي في عمليات استخراج الخامات واستخلاص الفلزات وفي تكرير النفط وغيرها من الصناعات الكيميائية الأخرى.[21]
صناعة الأسمدة
يعدّ الكبريت بذاته عنصراً مغذّياً للنبات، فيمكن أن يُستخدَم سماداً، إلّا أنّه لا يمكن للنبات أن يمتصّه بحدّ ذاته مباشرة، ولكن يمكن لأنواع من البكتريا أن تحوّله إلى مشتقّات منحلّة، مثل أيون الكبريتات، فتصبح النباتات قادرةً على امتصاصه، وهو يقوم عند امتصاصه بتحسين كفاءة امتصاص المغذّيات الأساسية الأخرى، وخاصّةً النتروجين والفوسفور.[115] يجري هذا التطبيق عادةً في الأماكن التي تعاني من نقص في الكبريت في تربتها.[116][117][118] كما يدخل الكبريت عنصراً في تركيب بعض المواد الكيميائية المهمّة الداخلة في صناعة الأسمدة مثل مركب كبريتات الكالسيوم.
المبيدات

يعدّ عنصر الكبريت من أقدم المبيدات المستخدمة، فقد كانت شمعة الكبريت مستخدمةً للقضاء على الطفيليات على اختلافها. فيستخدم مسحوق الكبريت مبيداً للفطريات لبعض المحاصيل مثل العنب والفريز وغيرها؛ إذ له فعالية جيّدة تجاه طيفٍ واسعٍ من أمراض البياض الدقيقي، وكذلك تجاه فطر البقعة السوداء في الورد؛ كما أنّ لاستخدامه في الزراعة العضوية أهمّية كبيرة، فهو يستخدم في مكافحة جرب التفاح والعفونة وغيرها من الآفات الفطرية. لكي يُطبَّق مسحوق الكبريت على المحاصيل فإنه يمكن أن يُرَشّ أرضياً بجهاز أو أن يرشَّ جوياً من طائرة زراعية؛ ويعرَف الكبريت المطبّق لهذا الخصوص تجارياً باسم «الكبريت القابل للبلل»، لأنه يُخلَط مع مكوّنات إضافية تجعله قابلاً للامتزاج مع الماء.[119][120]
يستخدَم مسحوق عنصر الكبريت مبيداً للحشرات (خاصّةً العناكب) للقضاء على القرّاد والسوس مثلاً. كما يُطبَّق محلولٌ ممدّدٌ من الكبريت الجيري (والذي يصنع من مزج هيدروكسيد الكالسيوم (الجير المطفأ) مع الكبريت في الماء) على الحيوانات الأليفة للقضاء على الفطريات مثل القوباء الحلقية وجرب الحيوانات والعديد من مسبببات الأمراض الجلدية والطفيليات الأخرى.[121]
الصناعات الدوائية
يستخدم زهر الكبريت (ثماني الكبريت S8) في المجال الدوائي مستحضرَاً لمعالجة عددٍ من الحالات الجلدية. يقوم الكبريت بدورٍ حالٍّ للطبقة القرنية، كما يقوم بالقضاء على البكتريا والفطريات والقراديات المسبّبة للجرب وغيرها من الطفيليات.[122] يمكن أن يطبق الكبريت لهذا الاستخدام راسباً أو مُستَعلَقاً غروانياً على شكل غسول أو كريمات أو مساحيق أو صوابين ضمن مستحضرات التجميل، لعلاج حبّ الشباب والعدّ الوردي والتهاب الجلد الدهني؛[123] ولكن قد لا يخلو الأمر من ظهور آثار جانبية من التهيّج تبدو على شكل أعراض من الجفاف واللسع والحكة والتقشر.[124]
تحوي العديد من الأدوية من الكبريت في تركيبها، ومن أوائل الأمثلة على ذلك مستحضر السلفوناميد، والمعروف باسم «عقار السلفا». ومن الأمثلة الشهيرة أيضاً دخول الكبريت في تركيب مضادات بيتا لاكتام الحيوية، من ضمنها البنسلينات والسيفالوسبورينات وغيرها.
متفرقات
- يستخدم غاز ثلاثي أكسيد الكبريت في إنتاج المواد الفعّالة بالسطح (المؤثّرات السطحية) المستخدمة في صناعة المنظّفات، وذلك مثلاً عبر السلفنة العطرية لمركّب دوديسيل البنزين للحصول على سلفونات دوديسيل بنزين الصوديوم، وهي مادّة مهمّة في تركيب منظّفات الغسيل؛[125] كما تضاف مجموعة الكبريتات إلى الكحولات الدهنية بالمعالجة مع حمض الكبريتيك، للحصول على دوديسيل كبريتات الصوديوم على سبيل المثال.[126]
- يستفاد من الطاقة الناتجة عن تفكّك وتشكّل مركّبات متعدد السلفان في تخزين الطاقة في البطاريات الحرارية، كما هو الحال في بطارية ليثيوم-كبريت وبطارية صوديوم-كبريت.
- تضاف كمّيّات صغيرة من غاز ثنائي أكسيد الكبريت (أو مكافئاً من ميتابيكبريتيت البوتاسيوم) إلى النبيذ في مرحلة التخمير، وذلك من أجل إنتاج كمّيّات صغيرة من حمض الكبريتوز (عندما يتفاعل SO2 مع الماء) وأملاحه من الكبريتيت في المزيج؛ وتلك طريقةٌ لها أهمّيّة كبيرة في صناعة النبيذ؛[127] إذ تعمل هذه المركبات على امتصاص الأكسجين وتثبيط نمو البكتريا الهوائية، والتي ستعمل على تحويل الإيثانول إلى حمض الخليك (الأسيتيك)، مما سيفسد مذاق النبيذ.
- تُصنَع صبغة اللازورد من حرق مزيجٍ من الكبريت والكاولين وملح غلاوبر والنطرون (الصودا) والفحم المنشط. يعود اللون الأزرق الغامق إلى الأيونات الجذرية من متعدّدات الكبريتيد •−S3 المُحتَجَزة ضمن أقفاص الصوداليت.[128]
- يمكن أن يستخدم الكبريت في بعض الأحيان لزخرفة الأثاث الخشبي، حيث يُصبّ مصهور الكبريت في مكانه ثم يُحَفّ ويُنَعَّم. كان هذا الأسلوب شائعاً في القرن الثامن عشر والتاسع عشر في ولاية بنسلفانيا الأمريكية.[129][130]
المخاطر
لا يعدّ الكبريت من العناصر السامّة، وكذلك أيضاً مركبات الكبريتات المنحلّة مثل كبريتات المغنسيوم (الملح الإنجليزي). تعدّ أكاسيد الكبريت من الأكاسيد الحمضية وهي من المواد الأكّالة المخرّشة؛ كما تعدّ أحماض الكبريت المستقرّة من الأحماض القويّة، وهي شرهة جدّاً للماء، لذلك فإنّ تماس الجلد معها يؤدّي إلى التسبّب بحروق.[131]
يكون غاز كبريتيد الهيدروجين بتراكيز مرتفعة وبغياب تهوية مناسبة من الغازات السامة؛[132] وتُزال السمّية بالأكسدة إلى كبريتات.[133]
في الحياة والثقافة العامة
في اللغة
- في اللغة العربية
أورد ابن منظور في معجم لسان العرب قول ابن دريد عن الكبريت «لا أَحسبه عربيّاً صحيحاً»؛[ْ 3] ويقال كَبْرَتَ بعيرَه: أي طلاه به.[ْ 4]
- في اللغات الأجنبية
تشتَقُّ كلمة «Sulfur» من الكلمة اللاتينية «sulpur»، والتي جرى تحويرها إلى «sulphur» اعتقاداً أنّ أصلها إغريقي؛ مع العلم أنّ الكلمة اليونانية للكبريت هي «θεῖον» (ثيون)؛ ومن هنا أتت السابقة ثيو- المستخدمة في تسمية مركّبات الكبريت العضوية. مع انقلاب حرف P إلى PH أصبحت التهجئة بحرف f؛ وتغيّر الشكل مع مرور العصور. ففي القرن الثاني عشر الميلادي كانت التهجئة في اللغة الأنجلو-نورمانية «sulfre»؛ وفي القرن الرابع عشر الميلادي أعيد استخدام تهجئة «sulphre» في الإنجليزية الوسطى؛ أمّا في القرن الخامس عشر الميلادي فأصبحت التهجئتان «sulfur» و «sulphur» شائعتين في اللغة الإنجليزية. استمرّ الاستخدام المزدوج حتى القرن التاسع عشر الميلادي، حين جرى اعتماد تهجئة «sulphur» في الإنجليزية البريطانية؛ في حين أنّ الإنجليزية الأمريكية اعتمد فيها تهجئة «Sulfur». اعتمد الاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPAC) أسلوب الكتابة على الشكل «sulfur» في أواخر القرن العشرين؛[134] وكذلك لجنة التسمية في الجمعية الملكية للكيمياء.[135] تشير قواميس أكسفورد أن التهجئة باستخدام حرف -f- هي الشائعة في السياق الكيميائي التقني، إلا أن الاستخدام العام لها يشيع بازدياد في بريطانيا أيضاً.[136]
يُسمّى هذا العنصر في اللغة الألمانية «Schwefel» (شفيفل)، وذلك عبر اللغة الألمانية العليا الوسطى «swëbel»، من اللغة الألمانية العليا القديمة «swëbal»، والتي تقارب الكلمة اللاتينية «sulpur». يعتقد أن أصل الكلمة في اللغات الهندية الأوروبية قد يعود إلى الجذر «suel»، والذي يعني «المحترق ببطء».[137]
في الأديان
ورد ذكر الكبريت في الكتاب المقدّس 14 مرّة؛[ْ 5] حيث ورد ذكره في التوراة وفي سفر التكوين، وعادةً ما تشير ترجمات الإنجيل باللغة الإنجليزية للكبريت المشتعل باسم «brimstone»،[80] والذي يعني «الحجر المحترق»،[138] وهو ما أتى بتعبير «النار والكبريت» في المواعظ التي ترهّب من العقاب الإلهي.
وفي التصوّف الإسلامي يرد ذكر الكبريت الأحمر في عناوين الكتب،[ْ 6] ومنها كتاب «الكبريت الأحمر في بيان علوم الشّيخ الأكبر» لمؤلّفه عبد الوهاب الشعراني، والذي دافع فيه عن شيخه محيي الدين بن عربي. والكبريت الأحمر شيءٌ افتراضيٌّ يُضرب به المثل من حيث القيمة المثالية، أو من حيث نُدرة الوجود، أو الشيء الذي يستحيل العثور عليه.[ْ 7]
المراجع
باللغة العربية
- إيلهارد فيدمان (2020)، دراسات وأبحاث في تاريخ العلوم العربية والإسلامية، ترجمة الدكتور سائر بصمه جي Dar Al Kotob Al Ilmiyah دار الكتب العلمية، ص. 92، مؤرشف من الأصل في 2020-05-21
- عزيزة فوال بابتي (2009)، موسوعة الأعلام (العرب والمسلمين والعالميين) 1-4 ج2، Dar Al Kotob Al Ilmiyah دار الكتب العلمية, 2009، ص. 69، مؤرشف من الأصل في 2020-02-22
- "مدخل كلمة كبريت في لسان العرب عبر موقع المعاني". مؤرشف من الأصل في 2020-05-17.
- "مدخل كلمة كبريت في القاموس المحيط عبر موقع المعاني". مؤرشف من الأصل في 2020-05-17.
- موقع الأنبا تكلاهيمانوت القبطي الأرثوذكسي. "قاموس الكتاب المقدس". مؤرشف من الأصل في 2017-09-17.
{{استشهاد ويب}}: النص "دائرة المعارف الكتابية المسيحية" تم تجاهله (مساعدة) والنص "شرح كلمة كبريت" تم تجاهله (مساعدة) - البحث عن "الكبريت الأحمر" في جوجل كتب نسخة محفوظة 18 مايو 2020 على موقع واي باك مشين.
- صالح الكرباسي. "ما هو الكبريت الاحمر الذي تتحدث الاحاديث و الروايات عنه ؟". مركز الإشعاع الإسلامي للدراسات والبحوث الإسلامية. مؤرشف من الأصل في 2019-10-19.
بلغات أجنبية
- Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics (PDF). CRC press. 2000. ISBN:0849304814.
- Zhang, Yunming (1986). "The History of Science Society: Ancient Chinese Sulfur Manufacturing Processes". Isis. ج. 77 ع. 3: 487. DOI:10.1086/354207.
- N. Figurowski: Die Entdeckung der chemischen Elemente und der Ursprung ihrer Namen. Aulis-Verlag Deubner, Köln 1981, ISBN 3-7614-0561-8, S. 179–180.
- Rapp، George Robert (4 فبراير 2009). Archaeomineralogy. ص. 242. ISBN:978-3-540-78593-4. مؤرشف من الأصل في 2020-02-17.
- Odyssey, book 22, lines 480–495. www.perseus.tufts.edu. Retrieved on 16 August 2012. نسخة محفوظة 28 فبراير 2020 على موقع واي باك مشين.
- George Rapp: Archaeomineralogy. 2. Auflage. Springer, 2009, ISBN 978-3-540-78593-4, S. 242.
- Pliny the Elder on science and technology, John F. Healy, Oxford University Press, 1999, (ردمك 0-19-814687-6), pp. 247–249.
- White، David Gordon (1996). The Alchemical Body — Siddha Traditions in Medieval India. Chicago: University of Chicago Press. ص. passim. ISBN:978-0-226-89499-7.
- Fritz Seel: Geschichte und Chemie des Schwarzpulvers. Le charbon fait la poudre. In: Chemie in unserer Zeit. 22, 1988, S. 9–16, doi:10.1002/ciuz.19880220103.
- Lin، A. N.؛ Reimer، R. J.؛ Carter، D. M. (1988). "Sulfur revisited". Journal of the American Academy of Dermatology. ج. 18 ع. 3: 553–558. DOI:10.1016/S0190-9622(88)70079-1. PMID:2450900.
- Maibach، H. I.؛ Surber، C.؛ Orkin، M. (1990). "Sulfur revisited". Journal of the American Academy of Dermatology. ج. 23 ع. 1: 154–156. DOI:10.1016/S0190-9622(08)81225-X. PMID:2365870.
- Gupta، A. K.؛ Nicol، K. (2004). "The use of sulfur in dermatology". Journal of Drugs in Dermatology. ج. 3 ع. 4: 427–31. PMID:15303787.
- Derry، Thomas Kingston؛ Williams، Trevor I. (1993). A Short History of Technology: From the Earliest Times to A.D. 1900. New York: Dover.
- Kiefer، David M. (2001). "Sulfuric Acid: Pumping Up the Volume". American Chemical Society. مؤرشف من الأصل في 2018-11-18. اطلع عليه بتاريخ 2008-04-21.
- William H. Brock: Viewegs Geschichte der Chemie. Springer, 1997, ISBN 3-540-67033-5, S. 67
- J. Gay-Lussax, L. J. Thenard: Prüfung der zerlegenden Untersuchungen des Hrn. Davy über die Natur des Schwefels und des Phosphors. In: Annalen der Physik. Volume 35, Issue 7, 1810, S. 292–310, doi:10.1002/andp.18100350704.
- Peter Kurzweil, Paul Scheipers: Chemie: Grundlagen, Aufbauwissen, Anwendungen und Experimente. Vieweg+Teubner; (2011), S. , ISBN 3-8348-1555-1.
- W. C. Zeise: Jahresber. Fortschr. Chem. 3, 1824, S. 80; 16, 1837, S. 302.
- Riall, Lucy (1998). Sicily and the Unification of Italy: Liberal Policy and Local Power, 1859–1866. Oxford University Press. ISBN:9780191542619. مؤرشف من الأصل في 2020-02-21. اطلع عليه بتاريخ 2013-02-07.
{{استشهاد بكتاب}}:|archive-date=/|archive-url=timestamp mismatch (مساعدة) - Thomson، D. W. (أبريل 1995). "Prelude to the Sulphur War of 1840: The Neapolitan Perspective". European History Quarterly. ج. 25 ع. 2: 163–180. DOI:10.1177/026569149502500201.
- Nehb، Wolfgang؛ Vydra، Karel (2006). "Sulfur". Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag. DOI:10.1002/14356007.a25_507.pub2. ISBN:978-3-527-30673-2.
- Kogel، Jessica (2006). Industrial minerals & rocks: commodities, markets, and uses (ط. 7th). Colorado: Littleton. ص. 935. ISBN:978-0-87335-233-8. OCLC:62805047.
- Botsch, Walter (2001). "Chemiker, Techniker, Unternehmer: Zum 150. Geburtstag von Hermann Frasch". Chemie in Unserer Zeit (بالألمانية). 35 (5): 324–331. DOI:10.1002/1521-3781(200110)35:5<324::AID-CIUZ324>3.0.CO;2-9.
- Max Schmidt: Schwefel – was ist das eigentlich? In: Chemie in unserer Zeit. Volume 7, Issue 1, Februar 1973, S. 11–18, doi:10.1002/ciuz.19730070103.
- Cameron، A. G. W. (1957). "Stellar Evolution, Nuclear Astrophysics, and Nucleogenesis" (PDF). CRL-41. مؤرشف من الأصل (PDF) في 2020-01-12.
- "SWIMMING A SALTY SEA". Astrobiology Magazine. 02/2020. مؤرشف من الأصل في 28 أغسطس 2016.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - Lopes، Rosaly M. C.؛ Williams، David A. (2005). "Io after Galileo". Reports on Progress in Physics. ج. 68 ع. 2: 303–340. Bibcode:2005RPPh...68..303L. DOI:10.1088/0034-4885/68/2/R02.
- "VOLCANISM ON IO". San Diego State University. 02/2020. مؤرشف من الأصل في 2020-02-29.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - Mason، B. (1962). Meteorites. New York: John Wiley & Sons. ص. 160. ISBN:978-0-908678-84-6. مؤرشف من الأصل في 2020-02-26.
- Daniel C. Boice, Celine Reyle: The Nature of Diatomic Sulfur in Comets. In: Formation of Cometary Material, 25th meeting of the IAU, Joint Discussion 14, 22 July 2003, Sydney, Australia. بيب كود: 2003IAUJD..14E..38B
- C. A. Gottlieb, E. W. Gottlieb, M. M. Litvak, J. A. Ball, H. Pennfield: Observations of interstellar sulfur monoxide. In: Astrophysical Journal. 219, 1, 1978, S. 77–94. بيب كود: 1978ApJ...219...77G.
- M. W. Sinclair, N. Fourikis, J. C. Ribes, B. J. Robinson, R. D. Brown, P. D. Godfrey: Detection of interstellar thioformaldehyde. In: Australian Journal of Physics. Band 26, S. 85. بيب كود: 1973AuJPh..26...85S.
- Madigan MT, Martino JM (2006). Brock Biology of Microorganisms (ط. 11th). Pearson. ص. 136. ISBN:0-13-196893-9.
- Cours Cycle azote metabolisme acides amines uree urea Enseignement et recherche Biochimie Emmanuel Jaspard Universite Angers نسخة محفوظة 09 2يناير3 على موقع واي باك مشين.
- Rickwood، P. C. (1981). "The largest crystals" (PDF). American Mineralogist. ج. 66: 885–907. مؤرشف من الأصل (PDF) في 2020-02-08.
- "Sulfur" (PDF). handbook of mineralogy. 002/2020. مؤرشف من الأصل (PDF) في 4 مارس 2016.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - "Mineral Species containing Sulfur". webmineral. 02/2020. مؤرشف من الأصل في 2019-06-23.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - Kutney، Gerald (2007). Sulfur: history, technology, applications & industry. Toronto: ChemTec Publications. ص. 43. ISBN:978-1-895198-37-9. OCLC:79256100.
- "Sulphur". mindat.org. 02/2020. مؤرشف من الأصل في 21 أبريل 2016.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - Klein, Cornelis and Cornelius S. Hurlbut, Jr., Manual of Mineralogy, Wiley, 1985, 20th ed., p. 265-6 (ردمك 0-471-80580-7)
- "Sulphur: Mineral information, data and localities". www.mindat.org. مؤرشف من الأصل في 2019-07-08.
- Peter Adolphi, Bernd Ullrich: Fixierung und Reaktionsfähigkeit von Schwefel in Braunkohle. In: Proc. XXXII. Kraftwerkstechnisches Kolloquium, Nutzung schwieriger Brennstoffe in Kraftwerken, Dresden 24. und 25. Oktober 2000. S. 109–116.
- "The chemical composition of seawater". seafriends.org.nz. 02/2020. مؤرشف من الأصل في 7 فبراير 2020.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - "Wasserlexikon: Sulfat". wvsb.at. 02/2020. مؤرشف من الأصل في 24 مايو 2019.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - "Atmospheric Aerosols: What Are They, and Why Are They So Important?". NASA. 02/2020. مؤرشف من الأصل في 23 ديسمبر 2019.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - Cervin، Michael. "Sulfur Springs: To Soak or not to Soak?". Fox. مؤرشف من الأصل في 2015-09-24. اطلع عليه بتاريخ 2015-02-24.
- Riegel، Emil؛ Kent، James (2007). Kent and Riegel's Handbook of Industrial Chemistry and Biotechnology. ج. 1. ص. 1171. Bibcode:2007karh.book....... ISBN:978-0-387-27842-1. OCLC:74650396.
- Ursula Klein: Verbindung und Affinität: Die Grundlegung der neuzeitlichen Chemie an der Wende vom 17. zum 18. Jahrhundert. Birkhäuser Verlag, 1994, ISBN 3-7643-5003-2.
- "Learn More About Sulphur - Introduction". The Sulphur Institute. مؤرشف من الأصل في 2019-02-07. اطلع عليه بتاريخ 2019-02-05.
- Gray، C.W. (1920). Fundamentals of Chemistry. ص. 76.
- McElvaney، Kevin (25 فبراير 2015). "The Men Who Mine Volcanos". The Atlantic. مؤرشف من الأصل في 2020-04-11. اطلع عليه بتاريخ 2015-02-26.
{{استشهاد بدورية محكمة}}:|archive-date=/|archive-url=timestamp mismatch (مساعدة) - The Sulphur Institute. "An Introduction to Sulphur.", accessed 17 January 2011. نسخة محفوظة 12 مارس 2016 على موقع واي باك مشين.
- Emil Raymond Riegel, James Albert Kent: Kent and Riegel's handbook of industrial chemistry and biotechnology. Band 1, S. 1162.
- Eow، John S. (2002). "Recovery of sulfur from sour acid gas: A review of the technology". Environmental Progress. ج. 21 ع. 3: 143–162. DOI:10.1002/ep.670210312.
- Schreiner، Bernhard (2008). "Der Claus-Prozess. Reich an Jahren und bedeutender denn je". Chemie in Unserer Zeit. ج. 42 ع. 6: 378–392. DOI:10.1002/ciuz.200800461.
- Roland Dittmeyer, Wilhelm Keim, Gerhard Kreysa, Alfred Oberholz (Hrsg.): Winnacker/Küchler: Chemische Technik: Prozesse und Produkte. Band 3: Anorganische Grundstoffe, Zwischenprodukte. Verlag Wiley-VCH, Weinheim 2005, ISBN 3-527-30768-0.
- Hyndman، A. W.؛ Liu، J. K.؛ Denney، D. W. (1982). "Sulfur Recovery from Oil Sands". Sulfur: New Sources and Uses. ACS Symposium Series. ج. 183. ص. 69–82. DOI:10.1021/bk-1982-0183.ch005. ISBN:978-0-8412-0713-4.
- R. Dittmeyer, W. Keim, G. Kreysa, A. Oberholz: Winnacker·Küchler: Chemische Technik. Band 3: Anorganische Grundstoffe, Zwischenprodukte. 5. Auflage. Wiley-VCH, Weinheim 2005, ISBN 3-527-30768-0, S. 33–34 (Volltext؛ PDF; 7,9 MB). نسخة محفوظة 12 أبريل 2020 على موقع واي باك مشين.
- Apodaca, Lori E. (2012) Sulfur. Mineral Commodity Summaries. USGS نسخة محفوظة 18 مارس 2020 على موقع واي باك مشين.
- Sulfur. Commission on Isotopic Abundances and Atomic Weights نسخة محفوظة 4 نوفمبر 2019 على موقع واي باك مشين.
- Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 1.14. ISBN 1-4398-5511-0
- Canfield، D. E. (2001). "Biogeochemistry of Sulfur Isotopes". Reviews in Mineralogy and Geochemistry. ج. 43 ع. 1: 607–636. DOI:10.2138/gsrmg.43.1.607.

- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (بالإنجليزية) (2 ed.). Butterworth-Heinemann. ISBN:0-08-037941-9.
- Steudel، Ralf؛ Eckert، Bodo (2003). Solid Sulfur Allotropes Sulfur Allotropes. Topics in Current Chemistry. ج. 230. ص. 1–80. DOI:10.1007/b12110. ISBN:978-3-540-40191-9.
- Tebbe، Fred N.؛ Wasserman، E.؛ Peet، William G.؛ Vatvars، Arturs؛ Hayman، Alan C. (1982). "Composition of Elemental Sulfur in Solution: Equilibrium of S6, S7, and S8 at Ambient Temperatures". Journal of the American Chemical Society. ج. 104 ع. 18: 4971–4972. DOI:10.1021/ja00382a050.
- Meyer، Beat (1964). "Solid Allotropes of Sulfur". Chemical Reviews. ج. 64 ع. 4: 429–451. DOI:10.1021/cr60230a004.
- Meyer، Beat (1976). "Elemental sulfur". Chemical Reviews. ج. 76 ع. 3: 367–388. DOI:10.1021/cr60301a003.
- Rettig، S. J.؛ Trotter، J. (15 ديسمبر 1987). "Refinement of the structure of orthorhombic sulfur, α-S8" (PDF). Acta Crystallographica Section C. ج. 43 ع. 12: 2260–2262. DOI:10.1107/S0108270187088152. مؤرشف من الأصل (PDF) في 2020-04-13.
- Wiberg, Egon؛ Holleman, Arnold Frederick (2001). Inorganic Chemistry. Elsevier. ISBN:0-12-352651-5. مؤرشف من الأصل في 2020-04-13.
- Paul D. Bartlett and William R. Roderick: Hexaatomic sulfur. In: Henry F. Holtzclaw, Jr. (Hrsg.): Inorganic Syntheses. Band 8. McGraw-Hill Book Company, Inc., 1966, S. 100–103
- R. Engel: Compt. Rend., 112, 866 (1891).
- Theilig, Eilene (1982). A primer on sulfur for the planetary geologist. NASA Contractor Report 3594, Grant NAGW-132, Office of Space Science and Applications, Washington, DC, USA: National Aeronautics and Space Administration, Scientific and Technical Information Branch. ص. 4. مؤرشف من الأصل في 2020-04-13.
- Munson، Ronald A. (فبراير 1968). "The synthesis of iridium disulfide and nickel diarsenide having the pyrite structure" (PDF). Inorganic Chemistry. ج. 7 ع. 2: 389–390. DOI:10.1021/ic50060a047. مؤرشف من الأصل (PDF) في 2019-04-12.
- Egon Wiberg؛ Nils Wiberg (2001). Inorganic Chemistry. Academic Press. ص. 513–. ISBN:978-0-12-352651-9. مؤرشف من الأصل في 2020-03-21.
- Shriver, Atkins. Inorganic Chemistry, Fifth Edition. W. H. Freeman and Company, New York, 2010; pp 416
- Sulfur as a Catalyst Poison (PDF; 52 kB). نسخة محفوظة 2015-09-24 على موقع واي باك مشين.
- F. Asinger, M. Thiel: Einfache Synthesen und chemisches Verhalten neuer heterocyclischer Ringsysteme. In: Angewandte Chemie. 70, 1958, S. 667–683, doi:10.1002/ange.19580702202.
- Gewald, K.; Schinke, E.; Böttcher, H. Chemische Berichte 1966, 99, 94-100.
- Jerry March: Advanced Organic Chemistry. 3. Auflage. Verlag Wiley & Sons, 1985, ISBN 0-471-60180-2, S. 550 und 1053.
- Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd ed.), Oxford:Butterworth-Heinemann. (ردمك 0-7506-3365-4).
- Vaughan, D. J.; Craig, J. R. "Mineral Chemistry of Metal Sulfides" Cambridge University Press, Cambridge (1978) (ردمك 0-521-21489-0)
- R. Steudel (2003). "Sulfur-Rich Oxides SnO and SnO2". في Steudel, R. (المحرر). Elemental Sulfur und Sulfur-Rich Compounds II. Berlin-Heidelberg: Springer. DOI:10.1007/b13185. ISBN:9783540449515.
- "{{{title}}}". Org. Synth.. DOI:10.1002/0471264180.os041.28.
- G. Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry. 2. Auflage. Band 1, Academic Press, 1963, S. 371–372
- "{{{title}}}". Org. Synth.. DOI:10.15227/orgsyn.030.0062.
- N. N. Greenwood, A. Earnshaw: Chemical Elements. 2. Auflage. Butterworth-Heinemann, Boston, MA 1997, S. 721–725.
- T. Chivers: Guide To Chalcogen-Nitrogen Chemistry. World Scientific Publishing Company, Singapore 2004, ISBN 981-256-095-5.
- Hans P. Latscha, Helmut A. Klein: Anorganische Chemie: Chemie-basiswissen I. Band 1, S. 374.
- Jensen، James (2005). "Vibrational frequencies and structural determination of thiocyanogen". Journal of Molecular Structure: THEOCHEM. ج. 714 ع. 2–3: 137–141. DOI:10.1016/j.theochem.2004.09.046. مؤرشف من الأصل في 2020-01-27.
- Heal، H. G. (1980). The Inorganic Heterocyclic Chemistry of Sulfur, Nitrogen, and Phosphorus. London: Academic Press. ISBN:978-0-12-335680-2.
- Chivers، T. (2004). A Guide To Chalcogen-Nitrogen Chemistry. Singapore: World Scientific. ISBN:978-981-256-095-7. مؤرشف من الأصل في 22 أغسطس 2022.
{{استشهاد بكتاب}}: تحقق من التاريخ في:|سنة=لا يطابق|تاريخ=(مساعدة) - Cremlyn R. J. (1996). An Introduction to Organosulfur Chemistry. Chichester: John Wiley and Sons. ISBN:0-471-95512-4.
- L. Pauling: Die Natur der chemischen Bindung. Verlag Chemie, Weinheim 1973, ISBN 3-527-25217-7, S. 286.
- Wilson، R. W.؛ Penzias، A. A.؛ Wannier، P. G.؛ Linke، R. A. (15 مارس 1976). "Isotopic abundances in interstellar carbon monosulfide". Astrophysical Journal. ج. 204: L135–L137. Bibcode:1976ApJ...204L.135W. DOI:10.1086/182072.
- Günther Ohloff: Riechstoffe und Geruchssinn – Die molekulare Welt der Düfte; Springer Verlag, ISBN 978-3-540-52560-8.
- Edouard Demole, Paul Enggist, Günther Ohloff: 1-p-Menthene-8-thiol: A powerful flavor impact constituent of grapefruit juice (Citrus parodisi MACFAYDEN). In: Helv. Chem. Acta. 65, 1982, S. 1785–1794; doi:10.1002/hlca.19820650614.
- T. Ubuka, T. Abe, R. Kajikawa, K. Morino: Determination of hydrogen sulfide and acid-labile sulfur in animal tissues by gas chromatography and ion chromatography. In: Journal of Chromatography B: Biomedical Sciences and Applications. 757, Nr. 1, 2001, S. 31–37, doi:10.1016/S0378-4347(01)00046-9.
- https://www.jbc.org/. "Total Sulfur, Cystine, and Methione Content of blood globins of mammalian species" (PDF). Journal of Biological Chemistry. مؤرشف من الأصل (PDF) في 2019-02-14.
{{استشهاد ويب}}: روابط خارجية في|مؤلف= - Prof. Dr. Rüdiger Hell. "Was macht der Schwefel in der Zwiebel?". uni-heidelberg.de. مؤرشف من الأصل في 2017-07-08.
- Didaktik der Chemie. "Die Küchenzwiebel aus chemischer Sicht". Universität Bayreuth. مؤرشف من الأصل في 2020-05-09. اطلع عليه بتاريخ 2020-05-09.
- Nelson، D. L.؛ Cox، M. M. (2000). Lehninger, Principles of Biochemistry (ط. 3rd). New York: Worth Publishing. ISBN:978-1-57259-153-0. مؤرشف من الأصل في 2020-05-09.
- Thauer، R. K. (1998). "Biochemistry of methanogenesis: a tribute to Marjory Stephenson:1998 Marjory Stephenson Prize Lecture". Microbiology. ج. 144 ع. 9: 2377–2406. DOI:10.1099/00221287-144-9-2377. PMID:9782487.
- Sosa Torres، Martha E.؛ Kroneck، Peter M.H.، المحررون (2020)، Transition Metals and Sulfur: A Strong Relationship for Life، Metal Ions in Life Sciences (Series editors Astrid Sigel, Eva Freisinger and Roland K.O. Sigel)، Berlin/Boston: de Gryyter، ج. 20، ص. xlv+455، DOI:10.1515./978311058897، ISBN:978-3-11-058889-7، ISSN:1559-0402
- Hanukoglu I، Jefcoate CR (أبريل 1980). "Mitochondrial cytochrome P-450scc. Mechanism of electron transport by adrenodoxin" (PDF). The Journal of Biological Chemistry. ج. 255 ع. 7: 3057–61. PMID:6766943. مؤرشف من الأصل في 2020-03-01.
- Lippard، S. J.؛ Berg، J. M. (1994). Principles of Bioinorganic Chemistry. University Science Books. ISBN:978-0-935702-73-6. مؤرشف من الأصل في 2013-01-15.
{{استشهاد بكتاب}}: صيانة الاستشهاد: التاريخ والسنة (link) - Pronk JT؛ Meulenberg R؛ Hazeu W؛ Bos P؛ Kuenen JG (1990). "Oxidation of reduced inorganic sulphur compounds by acidophilic thiobacilli" (PDF). FEMS Microbiology Letters. ج. 75 ع. 2–3: 293–306. DOI:10.1111/j.1574-6968.1990.tb04103.x. مؤرشف من الأصل (PDF) في 4 أكتوبر 2013. اطلع عليه بتاريخ 1 يونيو 2013.
- Ernst-Detlef Schulze؛ Harold A. Mooney (1993)، Biodiversity and ecosystem function، Springer-Verlag، ص. 88–90، ISBN:9783540581031، مؤرشف من الأصل في 2020-05-09
- Heldt، Hans-Walter (1996). Pflanzenbiochemie. Heidelberg: Spektrum Akademischer Verlag. ص. 321–333. ISBN:978-3-8274-0103-8.
- Thomas Leustek, Kazuki Saito: Sulfate Transport and Assimilation in Plants. In: Plant Physiology. Band 120, Nr. 3, Juli 1999, S. 637–644, doi:10.1104/pp.120.3.637.
- Alan R. Wellburn, U. Gramm (Übers.), D. Mennecke-Bühler (Übers.): Luftverschmutzung und Klimaänderung: Auswirkungen auf Flora, Fauna und Mensch. Springer, 1997, ISBN 3-540-61831-7, S. 31 u. 104.
- Niemeier, U., & Tilmes, S. (2017). Sulfur injections for a cooler planet. Science, 357(6348), 246–248. doi:10.1126/science.aan3317
- "Sulphur 2020 – cutting sulphur oxide emissions". International Maritime Organization. مؤرشف من الأصل في 2020-05-03.
- Apodaca, Lori E. "Mineral Yearbook 2010: Sulfur" (PDF). United States Geological Survey. مؤرشف من الأصل في 2019-04-12.
- UN Industrial Development Organization: Fertilizer Manual. Verlag Springer Netherlands, 1998, ISBN 0-7923-5032-4.
- "FAQ - The Sulphur Institute". sulphurinstitute.org. The Sulphur Institute. 2020. مؤرشف من الأصل في 2020-03-21. اطلع عليه بتاريخ 2020-02-27.
- Zhao، F.؛ Hawkesford، M. J.؛ McGrath، S. P. (1999). "Sulphur Assimilation and Effects on Yield and Quality of Wheat". Journal of Cereal Science. ج. 30 ع. 1: 1–17. DOI:10.1006/jcrs.1998.0241.
- Blake-Kalff، M. M. A. (2000). "Diagnosing sulfur deficiency in field-grown oilseed rape (Brassica napus L.) and wheat ( Triticum aestivum L.)". Plant and Soil. ج. 225 ع. 1/2: 95–107. DOI:10.1023/A:1026503812267.
- Ceccotti، S. P. (1996). "Plant nutrient sulphur-a review of nutrient balance, environmental impact and fertilizers". Fertilizer Research. ج. 43 ع. 1–3: 117–125. DOI:10.1007/BF00747690.
- Mohamed, Abdel-Mohsen Onsy؛ El Gamal, M. M (13 يوليو 2010). Sulfur Concrete for the Construction Industry: A Sustainable Development Approach. ص. 104–105. ISBN:978-1-60427-005-1. مؤرشف من الأصل في 2020-05-10.
- Every, Richard L.؛ وآخرون (20 أغسطس 1968). "Method for Preparation of Wettable Sulfur" (PDF). مؤرشف من الأصل (PDF) في 2020-04-20. اطلع عليه بتاريخ 2010-05-20.
- Kathrin Hartmann, Jutta Hein: Infektionskrankheiten der Katze Kluwer, 2008, ISBN 3-87706-746-8, S. 332
- Hagers Handbuch der Pharmazeutischen Praxis (بالألمانية) (4th ed.). Berlin–Heidelberg–New York: Springer. Vol. 6B. 1978. pp. 672–9. ISBN:978-3-540-07738-1.
- Arzneibuch-Kommentar. Wissenschaftliche Erläuterungen zum Europäischen Arzneibuch und zum Deutschen Arzneibuch [Pharmacopoeia Commentary. Scientific annotations to the European Pharmacopoeia and the German Pharmacopoeia] (بالألمانية) (23rd ed.). Stuttgart: Wissenschaftliche Verlagsgesellschaft. 2004. Monographie Schwefel zum äußerlichen Gebrauch [Monograph Sulfur for external use]. ISBN:978-3-8047-2575-1.
- معلومات ملتم للمستهلك: Sulfur topical.
- Kurt Kosswig,"Surfactants" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2005, Weinheim. دُوِي:10.1002/14356007.a25_747
- Tharwat F. Tadros: Applied Surfactants: Principles and Applications. Wiley-VCH Verlag, 2005, ISBN 3-527-30629-3.
- Spencer, Benjamin Sulfur in wine demystified. intowine.com. Retrieved 26 October 2011. نسخة محفوظة 8 مايو 2020 على موقع واي باك مشين.
- Von Dr. Herbert Röhrig. "Dreitausend Jahre Ultramarin". Kremer Pigmente. مؤرشف من الأصل في 2020-05-10. اطلع عليه بتاريخ 2020-05-10.
- The Worst Way To Inlay, Popular Science, January 1, 2005. نسخة محفوظة 2020-04-21 على موقع واي باك مشين.
- Mass، Jennifer L؛ Anderson، Mark J (2003). "Pennsylvania German sulfur-inlaid furniture: characterization, reproduction, and ageing phenomena of the inlays". Measurement Science and Technology. ج. 14 ع. 9: 1598. DOI:10.1088/0957-0233/14/9/311.
- Baker، Colin (1 مارس 2007). "The dehydration of sucrose". Education in Chemistry. Royal Society of Chemistry. مؤرشف من الأصل في 2019-04-02. اطلع عليه بتاريخ 2018-06-14.
- Lindenmann، J.؛ Matzi، V.؛ Neuboeck، N.؛ Ratzenhofer-Komenda، B.؛ Maier، A؛ Smolle-Juettner، F. M. (ديسمبر 2010). "Severe hydrogen sulphide poisoning treated with 4-dimethylaminophenol and hyperbaric oxygen". Diving and Hyperbaric Medicine. ج. 40 ع. 4: 213–217. PMID:23111938. مؤرشف من الأصل في 2020-05-10. اطلع عليه بتاريخ 2013-06-07.
- Ramasamy، S.؛ Singh، S.؛ Taniere، P.؛ Langman، M. J. S.؛ Eggo، M. C. (2006). "Sulfide-detoxifying enzymes in the human colon are decreased in cancer and upregulated in differentiation". Am. J. Physiol. Gastrointest. Liver Physiol. ج. 291 ع. 2: G288–96. DOI:10.1152/ajpgi.00324.2005. PMID:16500920. مؤرشف من الأصل في 2020-05-10.
- "So long sulphur". Nature Chemistry. ج. 1 ع. 5: 333. 4 أغسطس 2009. Bibcode:2009NatCh...1Q.333.. DOI:10.1038/nchem.301. PMID:21378874.
- McNaught، Alan (1991). "Journal style update". The Analyst. ج. 116 ع. 11: 1094. Bibcode:1991Ana...116.1094M. DOI:10.1039/AN9911601094. مؤرشف من الأصل في 2022-08-21.
- "sulphur – definition of sulphur in English". Oxford Dictionaries. مؤرشف من الأصل في 2019-04-02. اطلع عليه بتاريخ 2016-11-19.
- Etymologisches Wörterbuch der deutschen Sprache. 1967, S. 690.
- Chisholm, Hugh, ed. (1911). . Encyclopædia Britannica (بالإنجليزية) (11th ed.). Cambridge University Press. Vol. 4. p. 571.
- بوابة العناصر الكيميائية
- بوابة الكيمياء