يوديد المغنيسيوم
يوديد المغنيسيوم مركب كيميائي له الصيغة MgI2 ، ويكون على شكل بلورات بيضاء. يوجد منه عدة أشكال مرتبطة مع جزيئات الماء MgI2(H2O)x، أشهرها سداسي وثماني هيدرات.
| يوديد المغنيسيوم | |
|---|---|
 يوديد المغنيسيوم | |
| الاسم النظامي (IUPAC) | |
يوديد المغنيسيوم | |
| أسماء أخرى | |
يوديد مغنزيوم | |
| المعرفات | |
| رقم CAS | 10377-58-9? 75535-11-4 (سداسي هيدرات) 7790-31-0 (ثماني هيدرات) |
| بوب كيم | 5462737 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | MgI2 |
| الكتلة المولية | 278.114 غ/مول |
| المظهر | بلورات بيضاء |
| الكثافة | 4.43 غ/سم3 |
| نقطة الانصهار | 634 °س يتفكك |
| الذوبانية في الماء | 148 غ/100 مل ماء عند 18 °س |
| المخاطر | |
| توصيف المخاطر | لا يوجد |
| تحذيرات وقائية | لا يوجد |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
الخواص
- انحلالية مركب يوديد المغنيسيوم كبيرة في الماء، وتتسيل بلوراته بالتماس مع الهواء، لذلك فهي غالباً ما تحفظ تحت جو خامل من غاز الآرغون. بالتعرض الطويل للهواء يتفكك المركب تدريجياً مع حدوث تلون بني إلى عنصر اليود وأكسيد المغنيسيوم.
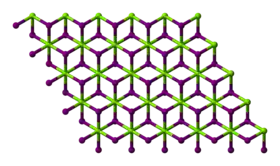
- البنية البلورية لمركب يوديد المغنيسيوم بنية مشابهة لمركب يوديد الكادميوم.
التحضير
يحضر مركب يوديد المغنيسيوم من التفاعل المباشر للعنصرين المكونين للمركب عند درجات حرارة مرتفعة
- Mg + I2 → MgI2
كما يحضر من أثر حمض يوديد الهيدروجين على كربونات المغنيسيوم أو على أكسيده أو الهيدروكسيد.
- MgCO3 + 2HI → MgI2 + CO2 + H2O
الاستخدامات
- يستخدم مركب يوديد المغنيسيوم في الاصطناع العضوي في تفاعل بيليس-هلمان (Baylis–Hillman reaction) حيث يعطي مركبات فاينيل لها ترتيب Z.[2]
المراجع
- Magnesium diiodide (بالإنجليزية), QID:Q278487
- Tietze، Lutz-Friedjan؛ Brasche، Gordon؛ Gericke، Kersten (2006)، Domino Reactions in Organic Synthesis، Wiley-VCH، ص. 59، ISBN:3527290605، مؤرشف من الأصل في 2020-01-26، اطلع عليه بتاريخ 2007-12-09
- بوابة الكيمياء
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.