وحدة فرعية ألفا ج
الوحدة الفرعية ألفا الخاصة بالبروتين ج (بالإنجليزية: G alpha subunit) هي إحدى ثلاث وحدات فرعية مكونة للبروتين المرتبط بنوكليوتيد الغوانين (بروتين ج).(ملاحظة 1) بروتينات ج هي بروتينات ثلاثية متغايرة مرتبطة بالغشاء تتكون من ثلاث وحدات فرعية: ألفا، بيتا، وغاما.[1] تشكل بروتينات ج مع مستقبلاتها أحد أكثر أنظمة التأشير انتشارا في خلايا الثدييات، وتنظم أنظمة متنوعة متعددة مثل: الإدراك الحسي، نمو الخلية والتنظيم الهرموني.[2]
| ج-ألفا | |
|---|---|
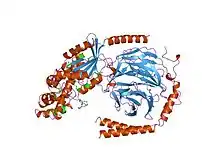 | |
| مركب ثلاثي مغاير مكون من الوحدة الفرعية Gi والوحدتين الفرعيتين بيتا-غاما G. | |
| معرف | |
| رمز | ج-ألفا |
| قاعدة بيانات عوائل البروتينات | PF00503 |
| قاعدة بيانات عوائل البروتينات clan | CL0023 |
| إنتربرو | IPR001019 |
| قاعدة بيانات التصنيف الهيكلي للبروتينات | 1gia |
في سطح الخلية، يُنشِّط ارتباط الربائط مثل الهرمونات والنواقل العصبية بالمستقبلات المقترنة بالبروتين ج هذه المستقبلات عبر التسبب في تغير بنيوي في بنيتها. هذا التغير بدوره ينشط البروتين ج المرتبط بها والمتواجد في الجزء الداخل خلوي من الغشاء. يُعزز المستقبل المنشَّط تبديل ارتباط الوحدة الفرعية ألفا في البروتين ج من الارتباط بثنائي فوسفات الغوانوزين (GDP) إلى الارتباط بثلاثي فوسفات الغوانوزين (GTP). يغير الارتباط بثلاثي فوسفات الغوانوزين تصاوغ مناطق محوِّلة في الوحدة الفرعية ألفا، وهذا يسمح بانفصال بروتين ج الثلاثي المغاير (غير المنشط) عن المستقبل وتفككه إلى وحدة فرعية ألفا نشطة (مرتبطة بثلاثي فوسفات الغوانوزين) ومثنوي بيتا-غاما. بعد ذلك تمضي الوحدة الفرعية ألفا ومثنوي بيتا-غاما لتنشيط مجموعة متنوعة من المستفعلات مع المسار مثل: محلقة الأدينيلات، إنزيمات فسفودايستراز، فوسفوليباز C، والقنوات الأيونية. بدورها تنظم هذه المستفعلات التركيز داخل الخلوي للرسل الثواني مثل: أحادي فوسفات الأدينوسين الحلقي، ثنائي الغليسيريد، كاتيونات الكالسيوم والصوديوم، وهوالأمر الذي يقود في النهاية إلى استجابة فيسيولوجية تكون عادة عبر تخفيض النسخ الجيني. تنتهي الحلقة (المسار) عبر حلمأة الوحدة الفرعية المرتبطة بـGTP لتصبح مرتبطة بـGDP وينتج عن ذلك إعادة ارتباط الوحدات ألفا وبيتا-غاما ببعضهما واقترانهم بالمستقبل الذي يُنهي الإشارة.[3] يتم التحكم في مدة إشارة البروتين ج بواسطة مدة ارتباط الوحدة الفرعية ألفا بالـGTP، الأمر الذي يمكن تنظيمه بواسطة البروتينات المنظمة لتأشير البروتين ج (RGS) أو عبر تعديلات في روابط تساهمية.[4]
توجد العديد من النظائر (هذه النظائر يمكن أن يكون لها مغايرات توصيل) والتي يمكنها معا تكوين المئات من توليفات البروتينات ج. لا تؤثر توليفة الوحدات الفرعية في بروتين ج الثلاثي المغاير على نوع المستقبل الذي تستطيع الارتباط به فحسب، بل تؤثر كذلك على نوع المستفعلات مع المسار التي تنشطها، وهذا يتيح إمكانية استهداف عمليات فيسيولوجية محددة استجابة لمنبهات خارجية محددة.[5][6] تحمل بروتينات ج تعديلات لبيدية على وحدة فرعية أو أكثر من وحداتها الفرعية لتوجيهها إلى الغشاء البلازمي والمساهمة في تآثرات البروتين.
تعمل الوحدة الفرعية ألفا الخاصة بالبروتين ج كجتباز ضعيف، وتُصنف البروتينات ج إلى أقسام حسب تسلسل ووظفيفة وحدات ألفا الفرعية التي تحتوي عليها، والتي تنقسم لدى الثدييات إلى عدة أنواع فرعية: ألفا G(S)، ألفا G(Q)، ألفا G(I)، ترانسدوسن، وألفا G(S)، كما توجد أقسام وحدات فرعية ألفا أخرى لدى النبات والفطريات.
التكوين
تتكون الوحدة الفرعية ألفا من نطاقين: نطاق يرتبط بالـGTP ونطاق إدخال لولبي.[7] النطاق المرتبط بالـGTP مماثل للجتبازات الصغيرة من النوع راس، ويحتوي على منطقتي تحويل 1 و2 اللتان تغيران من تصاوغهما البنيوي أثناء التنشيط. مناطق التحويل هي لفات من لوالب ألفا ذات تصاوغات حساسة لنوكليوتيدات الغوانين. نطاق الإدخال اللولبي يتم إدخاله في النطاق المرتبط بالـGTP قبل منطقة التحويل 1، وهو مميز وفريد في بروتينات ج الثلاثية المغايرة. يعمل نطاق الإدخال اللولبي على عزل نوكليوتيد الغوانين في مكان ارتباطه مع النطاق المرتبط بالـGTP، ويجب فصل هذا النطاق لتمكين تفكك النوكليوتيد.[8]
ملاحظات
- ملاحظة 1 سُمي البروتين ج (G protein) كذلك نسبة للحرف الأول (وهوالجيم) في نوكليوتيد الجوانين الذي يرتبط به (Guanine).
مراجع
- Preininger AM، Hamm HE (فبراير 2004). "G protein signaling: insights from new structures". Sci. STKE. ج. 2004 ع. 218: re3. DOI:10.1126/stke.2182004re3. PMID:14762218.
- Roberts DJ، Waelbroeck M (سبتمبر 2004). "G protein activation by G protein coupled receptors: ternary complex formation or catalyzed reaction?". Biochem. Pharmacol. ج. 68 ع. 5: 799–806. DOI:10.1016/j.bcp.2004.05.044. PMID:15294442.
- Svoboda P، Teisinger J، Novotný J، Bourová L، Drmota T، Hejnová L، Moravcová Z، Lisý V، Rudajev V، Stöhr J، Vokurková A، Svandová I، Durchánková D (2004). "Biochemistry of transmembrane signaling mediated by trimeric G proteins". Physiol Res. 53 Suppl 1: S141–52. PMID:15119945.
- Chen CA، Manning DR (مارس 2001). "Regulation of G proteins by covalent modification". Oncogene. ج. 20 ع. 13: 1643–52. DOI:10.1038/sj.onc.1204185. PMID:11313912.
- Hildebrandt JD (أغسطس 1997). "Role of subunit diversity in signaling by heterotrimeric G proteins". Biochem. Pharmacol. ج. 54 ع. 3: 325–39. DOI:10.1016/S0006-2952(97)00269-4. PMID:9278091.
- Albert PR، Robillard L (مايو 2002). "G protein specificity: traffic direction required". Cell. Signal. ج. 14 ع. 5: 407–18. DOI:10.1016/S0898-6568(01)00259-5. PMID:11882385.
- إنتربرو: IPR011025
- Cherfils J, Chabre M (2003) Activation of G-protein Galpha subunits by receptors through Galpha-Gbeta and Galpha-Ggamma interactions. Trends Biochem Sci 28 (1):13-7. DOI:10.1016/s0968-0004(02)00006-3 PMID: 12517447[وصلة مكسورة] "نسخة مؤرشفة". مؤرشف من الأصل في 2021-03-09. اطلع عليه بتاريخ 2021-08-19.
{{استشهاد ويب}}: صيانة الاستشهاد: BOT: original URL status unknown (link)
- بوابة الكيمياء الحيوية
- بوابة علم الأحياء
- بوابة علم الأحياء الخلوي والجزيئي