هستون هـ3
الهستون هـ3 (بالإنجليزية: Histone H3) هو أحد خمسة هستونات رئيسية لها دور في بنية الكروماتين في خلايا حقيقيات النوى.[1][2] ويتميز بنطاق كروي وذيل نهاية أمينية طويل. الهستون هـ3 جزء من بنية الجسيم النووي التي هي على شكل "خزرات على خيط". بروتينات الهستون تُعدل بعد الترجمة كثيرا، والهستون هـ3 هو أكثر الهستونات الخمسة خضوعا لتعديلات ما بعد الترجمة. المصطلح "هستون هـ3" بمفرده مبهم وذلك لأنه لا يُميز بين النظائر المختلفة في التسلسل أو حالة التعديل. الهستون هـ3 بروتين مهم في مجال علم الجينات الفوقي حيث يُعتقد أن نظائره المختلفة في التسلسل وحالة التعديل تلعب دورا في التنظيم طويل الأمد والديناميكي للتعبير عن الجينات.
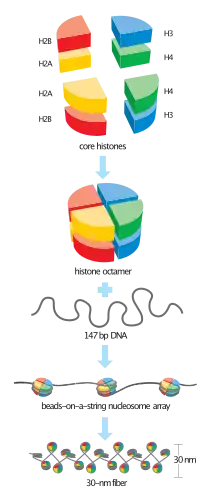
تعديلات بعد الترجمة وفوق جينية
تبرز النهاية الأمينية لـ هـ3 من لب الجسيم النووي الكروي وهي عرضة لتعديلات ما بعد الترجمة التي تؤثر على العمليات الخلوية. تشمل هذه التعديلات الربط التساهمي لمجموعات الميثيل أو الأستيل بالحمض الأميني لايسين وأرجنين وفسفرة السيرين أو الثريونين. المثيلة الثنائية أو الثلاثية للايسين رقم 9 مرتبطة بكبت الترجمة والكروماتين المغاير (H3K9me2 و H3K9me3 [الإنجليزية])، بينما ترتبط المثيلة الأحادية للايسين رقم 4 (H3K4me1 [الإنجليزية]) بالجينات النشطة.[3][4] تتم أستلة الهستون هـ3 في عدة مواضع لايسين في ذيل الهستون بواسطة ناقلة أستيل الهستون. أستلة اللايسين رقم 14 شائعة الحدوث في الجينات التي تُنسخ بنشاط إلى رنا (H3K14ac [الإنجليزية]).
مراجع
- Bhasin M، Reinherz EL، Reche PA (2006). "Recognition and classification of histones using support vector machine" (PDF). Journal of Computational Biology. ج. 13 ع. 1: 102–12. DOI:10.1089/cmb.2006.13.102. PMID:16472024. مؤرشف من الأصل (PDF) في 2023-05-22.
- Hartl DL، Freifelder D، Snyder LA (1988). Basic Genetics. Boston: Jones and Bartlett Publishers. ISBN:978-0-86720-090-4.
- Rosenfeld JA، Wang Z، Schones DE، Zhao K، DeSalle R، Zhang MQ (مارس 2009). "Determination of enriched histone modifications in non-genic portions of the human genome". BMC Genomics. ج. 10: 143. DOI:10.1186/1471-2164-10-143. PMC:2667539. PMID:19335899.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - Lachner M، O'Carroll D، Rea S، Mechtler K، Jenuwein T (مارس 2001). "Methylation of histone H3 lysine 9 creates a binding site for HP1 proteins". Nature. ج. 410 ع. 6824: 116–20. Bibcode:2001Natur.410..116L. DOI:10.1038/35065132. PMID:11242053. S2CID:4331863. مؤرشف من الأصل في 2022-10-17.
- بوابة الكيمياء الحيوية
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة علم الوراثة