مخطط الحديد والكربون
مخطط الحديد والكربون أو مخطط أطوار الحديد والكربون (بالإنجليزية: Iron-carbon phase diagram ) توجد في سبائك الحديد (وهي الفولاذ و الحديد الزهر) دائما نسبة صغيرة من الكربون ، وهي التي تحدد خصائص الفولاذ وخصائص الحديد الزهر .[1] ومخطط أطوار الحديد والكربون هو رسم بياني يبين أطوار الحديد والتوازن بينها كمخطط ثنائي للحديد والكربون . وهو يبين اعتماد الأطوار الناتجة للحديد على درجة الحرارة وعلى كمية الكربون الموجودة في كل طور .
وإذا أردنا أن نعرف بنية السبيكة عند تبريدها سريعا ، فإننا نلجأ إلى مخطط التحول الحراري الزمني.
يشكل الكربون أهم الإضافات التي تدخل في صناعة سبائك الحديد ، وأي تغير في نسبة الكربون وإن كانت صغيرة فلها تأثير كبير على صفات سبيكة الحديد . ويقل ما نستنتجه من مخطط الحديد والكربون كلما كانت سرعة التبريد أو التسخين عالية ، أو كلما زادت نسبة المواد المكونة للسبيكة .
يمثل مخطط الحديد والكربون في شكلين : نظام شبه مستقر (Fe-Fe3C) وفيه يكون الكربون مرتبطا كذرات في البنية الحديدية, ونظام مستقر (Fe-C) يكون الكربون فيه حبيبيا في هيئة غرافيت. وفي التقنية العملية يستخدم عادة النظام Fe-Fe3C الشبه مستقر .
مخطط أطوار الحديد والكربون
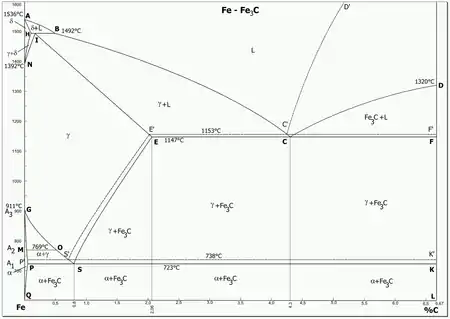
يبين المحور الأفقي نسبة الكربون في الحديد (النسبة الكتلية) ، ويبين المحور الرأسي درجة الحرارة. ويوضح هذا الرسم البياني نسب الكربون في الحديد بين 0 - 6,67% وهي المهمة عمليا (ولا يوجد سبائك حديد بنسب كربون أعلى من ذلك سوى كسبائك أولية) ، عندما تكون نسبة الكربون 6,67% أو أكبر فهي تشكل سبيكة سمنتيت ، أحد أنواع سبائك الحديد.
توصل الخطوط في المنحنى بين نقاط تثبت فيها درجة الحرارة وتفصل الخطوط أطوار الحديد عن بعضها البعض . بعض النقاط المهمة تميز بحروف كتابية ، وفي بعض الرسوم البيانية يرمز للنقطة I بدلا من J .
يبين الخط ABCD الحد الفاصل بين الحالة السائلة والحالة الصلبة ، حيث تكون السبيكة في درجات حرارة أعلى منه في الحالة السائلة . والخط AHIECF يمثل الحد الفاصل للطور الصلب ، وتحت هذا الخط تتصلب السبيكة . وبين هذين الخطين تكون السبيكة في حالة هلامية متكونة من حالة سائلة و حديد دلتا δ و حديد جاما γ و سمنتيت (Fe3C) في مختلف التركيزات وكمياتها . وعند تبريد السبيكة تحت خط السائل يبدأ التبلور الابتدائي من المصهور .
بسبب خاصية تآصل الحديد تتكون أطوارا مختلفة له تختلف حسب نسبة الكربون الموجودة فيه . ويكوّن الحديد بلورات مختلفة مختلطة δ و γ و α ذات نسب مختلفة من الكربون . ويكون توزيع الذرات في وحدات خلايا مختلفة وأطول الخلايا البلورية تكون مختفة أيضا. التسميات التقنية للمخلوطات البلورية هي : δ فريت للمخلوط البلوري δ، و أوستنيت للمخلوط البلوري γ ، و فريت للمخلوط البلوري α.
تقسيمات تقريبية
- المصهور : وهو السبيكة السائلة للحديد والكربون . وتكون السبيكة سائلة بكاملها فوق خط السيولة . وبين خطي السيولة وخط التصلب تكون السبيكة سائلة جزئيا .
- δ-Ferrit (دلتا فريت): يكون متبلورا في نظام بلوري مكعب مركزي الجسم
- أوستنيت (مخلوط بلوري γ ): يكون متبلورا في نظام مكعب مركزي الوجه
- α-Ferrit (فريت ألفا): نظام بلوري مكعب مركزي الجسم
- غرافيت (نظام مستقر) أو سمنتيت (Fe3C; نظام شبه مستقر)
في البرليت وفي الليديبوريت فهما لا يشكلان أطوارا نقية وإنما بنية تهما عبارة عن مخلوطات أطوار . وهما ينشآن في أنظمة مستقرة أو شبه مستقرة عند تبريدهما ببطء. ومن وجهة أخرى ينشأ عند التبريد السريع (مثل الرواية في الماء) للأوستنيت فيتحول إلى مارتنسيت. المارتنسيت له بنية شديدة الصلابة ويكون هشا .
توجد للنظام شبه المستقر نقاط ، وخطوط ، وظواهر خصوصية:
- نقاط خصوصية:
- A: (0 %/1536 °C) B: (0,53 %/1492 °C) C: (4,3 %/1147 °C) D: (6,67 %/1320 °C) E: (2,06 %/1147 °C)
- F: (6,67 %/1147 °C) G: (0 %/911 °C) H: (0,1 %/1493 °C) I: (0,16 %/1493 °C) K: (6,67 %/723 °C)
- N: (0 %/1392 °C) P: (0,022 %/723 °C) S: (0,8 %/723 °C) Q: (0,002 %/20 °C) M: (0 %/769 °C)
- S': (0,69 %/738 °C) E': (2,03 %/1153 °C) C': (4,25 %/1153 °C)
- خطوط خصوصية:
- خط السيولة: A-B-C-D خط التصلب: A-H-I-E-C-F
- Eutektikale: E-C-F Eutektoide: P-S-K Peritektikale: H-I-B
- ظواهر خصوصية:
- Eutektikum يوتيكتيكم : 4,3 % bei 1147 °C ( النقطة C)
- Eutektoid يوتيكتويد : 0,8 % bei 723 °C (النقطة S)
- Peritektikum بريتيكتيكم : 0,16 % bei 1493 °C (النقطة I)
تعريفاتها في علم المعادن

الرموز المستخدمة لها في علم التعدين هي : فيريت دلتا δ للمخلوط البلوري δ, و أوستنيت للمخلوط البلوري γ و فيريت للمخلوط البلوري α .
| النوع | الحد الأقصى للكربون | الإسم في التعدين |
|---|---|---|
| δ خليط بلوري | 0,10 % bei 1493 °C | δ-Ferrit |
| γ خليط بلوري | 2,06 % bei 1147 °C | Austenit |
| α خليط بلوري | 0,02 % bei 723 °C | Ferrit |
السمنتيت أو مركب الحديد والكربون Fe3C هو طور للحديد ولا يصح اعتباره مخلوطا بلوريا ، وهو طور وسطي .
يوجد السمنتيت في ثلاثة أنواع رغم أن تركيبه الكيميائي واحد :
| النوع | نشأته |
|---|---|
| سمنتيت أولي | تبلور ابتدائي من الخالة السائلة (الخط CD ) |
| سمنتيت ثانوي | يترسب من الأوستنيت (الخط ES) |
| سمنتيت ثلاثي | يترسب من الفريت (الخط PQ) |
الرسم البياني ينقصه تركيزات الكربون بين 06و2 % إلى 3و4 % في وصف السمنتيت الثانوي . وهو يعتبر موجودا رغم أنه يصعب تعيينه بطرق البحث التعدينية.
وتظهر مخاليط أطوار إلى جانب الأطوار النقية :
| النوع | يتكون من | يوجد عند |
|---|---|---|
| برليت | 88 % فريت و 12 % سمنتيت | 0,02 % - 6,67 % عند T≤723 °C |
| ليديبوريت I | 51,4 % أوستنيت و 48,6 % سمنتيت | 2,06 % - 6,67 % عند 723 °C≤T≤1147 °C |
| ليديبوريت II | 51,4 % برليت و 48,6 % سمنتيت | 2,06 % - 6,67 % عند T≤723 °C |
مراجع
- "معلومات عن مخطط الحديد والكربون على موقع krugosvet.ru". krugosvet.ru. مؤرشف من الأصل في 2023-07-04.
انظر أيضا
| مفاهيم في التوازن الكيميائي |
|---|
| ثابت تفكك الحمض |
| ثابت الترابط |
| محلول منظم |
| توازن كيميائي |
| استقرار كيميائي |
| ثابت انحلال |
| معامل التوزيع |
| ثابت التوازن |
| توازن ناشر |
| طبق نظري |
| استخلاص سائل-سائل |
| مخطط الطور |
| مخطط السيطرة |
| قاعدة الطور لجيبس |
| حاصل قسمة التفاعل |
| تطايرية نسبية |
| توازن الانحلالية
انحلالية مولية |
| ثابت الانحلالية |
| ثوابت استقرارية المعقدات |
| توازن دينامي حراري |
| توازن سائل وبخاره |
- بوابة كيمياء فيزيائية
- بوابة تعدين
- بوابة الكيمياء
- بوابة الفيزياء