قطب كالومل المشبع
قطب كالومل المشبع في الكيمياء الكهربية (بالإنجليزية: Saturated Calomel Electrode) هو قطب قياسي يستخدم لتعيين جهد اختزال المواد. يعد قطب كالومل أحد الأقطاب التي تستخدم كثيرا لمعايرة أقطاب مواد أخرى إلى جانب قطب قياسي للهيدروجين، وحساسيته بالنسبة لدرجة الحرارة أقل من حساسية القطب القياسي للهيدروجين (أنظر جهد اختزال).

تكوينه
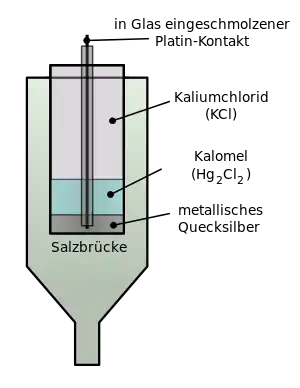
يتكون قطب كالومل من الزئبق المغطى بطبقة من كلوريد الزئبق (Hg2Cl2) المقاوم للذوبان (ولهذا يسمى كالومل) . يغطي كلوريد الزئبق محلول من كلوريد البوتاسيوم الذي يكوّن محلول مشبع من كوريد البوتاسيوم في الكالومل . يوجد قضيب من البلاتين مغطى بالزجاج لعزله منغمسا طوليا في تلك الثلاثة طبقات بحيث يلامس طرفه السفلي العاري فلز الزئبق . تتفاعل أيونات الزئبق الموجودة بين الكالومل والزئبق وينشأ جهد كهربي على سلك البلاتين وهو جهد القياسي للكالومل عند توفر الظروف القياسية لدرجة الحرارة والضغط والفاعلية الكيميائية (أنظر ظروف قياسية).
لمقارنة جهد قطب الكالومل بجهد فلز آخر يغطس الفلز الآخر في محلول لأحد أملاحه فتتكون بذلك نصف خلية ثانية، ونغطس قطب الكالومل في النصف الخلية المتكونة ونقيس فرق الجهد بين القطبين ونعين بذلك جهد اختزال مادة القطب المجهول .
طريقة عمله
ينشأ تفاعل القطب الذي يساعد على قياس الجهد عن طريق توازن بين الفلز (معدن القطب) والأيونات في محلول كلوريد البوتاسيوم. تكتسب كل أيون زئبق إلكترونين من الزئيق على السطح بين الكالومل والزئبق، ويتعادل أيون الزئبق ويصبح ذرة زئبق، طبقا للتفاعل:
وتعطي معادلة نرنست جهد القطب E ، حيث E° هو الجهد القياسي لتفاعل الزئبق .
حيث:
- و F ثابت فاراداي .
عند توازن الذوبان في الكالومل نطبق المعادلة :
ونحصل على حاصل ضرب الذوبان KL :
وبالتعويض عن تركيز الزئبق بحاصل ضرب الذوبان، نحصل على الجهد واعتماده على تركيز الكلوريد :
وكا نرى يعتمد الشطر KL وكذلك الجهد القياسي للكالومل على درجة الحرارة . ولهذا يمكننا تعريف جهد قياسي، نسميه «قطب الكالومل».
المتغير الوحيد في هذه المعادلة هي تركيز (فاعلية) أيونات الكلور. ونظرا لكون المحلول مشبعا بكلوريد البوتاسيوم فتكون الفاعلية الكيميائية محددة بذوبان كلوريد البوتاسيوم . وفي حالة التشبع يكون جهد اختزال قطب الكالومل +0.2444 فولت بالمقارنة بالقطب القياسي للهيروجين عند درجة حرارة 25 درجة مئوية ، ولكنه يكون أعلى من ذلك قليلا عندما يكون محلول الكلوريد غير مشبعا.
مثال: عندما يكون تركيز محلول كلوريد البوتاسيوم 5و3 M يزداد الجهد المرجعي إلى +0.250 فولت بالمقارنة بقطب الهيدروجين القياسي عند درجة حرارة 25 درجة مئوية . وإذا كانت مولية المحلول 1و0 M يرتفع جهد قطب الكالومل إلى +0.3356 فولت عند نفس درجة الحرارة.[1]
القياس بقطب كالومل المشبع
يمكن قياس جهد الاختزال القياسي لنظام عن طريق تكوين خلية جلفانية يكون أحد أقطابها القطب القياسي للهيدروجين - باعتباره القطب القياسي ذو قطبية 00و0 فولت - وتعيين الجهد الكهربي بينه وبين القطب المراد قياسه . ويجب أن يكون نصفي الخلية في الظروف القياسية لدرجة الحرارة والضغط والتركيز .
كما يمكن إجراء المعايرة باستخدام قطب الكالومل بدلا عن القطب القياسي للهيدروجين . ويتميز قطب كالومل عليه بنسبة خطأ أقل في حالة عدم ثبات درجة الحرارة أثناء القياس .
| درجة الحرارة | فرق الجهد |
|---|---|
| + 18 °C | + 0,2511 فولت |
| + 20 °C | + 0,2496 فولت |
| + 22 °C | + 0,2481 فولت |
ونستنتج من ذلك الجدول يتغير جهد الاختزال عندما تتغير درجة الحرارة درجتين بمقدار 6و0 % فقط .
اقرأ أيضا
المراجع
- (PDF) https://web.archive.org/web/20121224051623/http://www.cem.msu.edu/~cem333/Week11.pdf. مؤرشف من الأصل (PDF) في 2012-12-24.
{{استشهاد ويب}}: الوسيط|title=غير موجود أو فارغ (مساعدة) - Rolf Dolder: Stabilisation oxydationsempfindlicher Arzneistoffe als Redoxsysteme Dissertation Zürich 1950 نسخة محفوظة 27 أبريل 2020 على موقع واي باك مشين.
- بوابة الكيمياء