فلوريد الذهب الخماسي
فلوريد الذهب الخماسي أو خماسي فلوريد الذهب هو مركب كيميائي له الصيغة AuF5 ، ويكون على شكل صلب أحمر لكن غير ثابت. يوجد غالباً على شكل مبلمر ثنائي له الصيغة Au2F10 .
| فلوريد الذهب الخماسي | |
|---|---|
 فلوريد الذهب الخماسي | |
| الاسم النظامي (IUPAC) | |
فلوريد الذهب الخماسي | |
| أسماء أخرى | |
خماسي فلوريد الذهب | |
| المعرفات | |
| CAS | 57542-85-5 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | AuF5 |
| الكتلة المولية | 291.959 غ/مول |
| المظهر | صلب أحمر لكن غير ثابت |
| نقطة الانصهار | 60 °س يتفكك |
| الذوبانية في الماء | يتفكك |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
الخواص
- يوجد خماسي مركب فلوريد الذهب في أعلى درجة أكسدة معروفة للذهب في حال تشكيله للمركبات، إذ أن الذهب يعد من الفلزات النبيلة التي نادرا ما تقوم بتشكيل مركبات كيميائية.
- لا ينحل خماسي فلوريد الذهب في الماء، إلا أنه ينحل في حمض هيدروفلوريك، إلا أن المحلول الناتج سرعان ما يتفكك محرراً غاز الفلور.
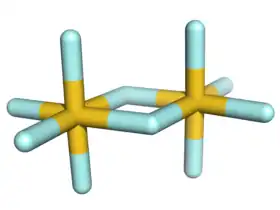
البنية
تتميز البنية البلورية لخماسي فلوريد الذهب في الحالة الصلبة بأنها متناظرة مركزيا. تتألف بنية المتماثر الثنائي للمركب من ذرتي ذهب ترتبطان مع بعضهما بجسر من ذرتي فلور. تكون كل ذرة ذهب سداسية التساند، أي يحيط بكل واحدة منها ست ذرات فلور، بحيث يكون الشكل الهندسي عبارة عن ثماني وجوه.
يعد المتماثر الثنائي لخماسي فلوريد الذهب الوحيد من نوعه بالنسبة لخماسي الفلوريدات، حيث أن خماسي الفلوريدات للعناصر المتبقية إما أن تكون عبارة عن موحودات (مونومرات) (P ،As ،Cl ،Br ،I) أو رباعيات (،Nb ،Ta ،Cr ،Mo ،W ،Tc ،Re ،Ru ،Os ،Rh ،Ir Pt) أو عبارة عن بوليمرات (Bi ،V ،U).[3]
التحضير
يحضر خماسي فلوريد الذهب من تسخين فلز الذهب في جو من الأكسجين والفلور عند درجات حرارة تصل إلى 370°س وعند ضغط يصل إلى 8 جو. فيتشكل أولا مركب فلوريد ثنائي أكسجينيل الذهب [4][5]
- 2 Au + 2 O2 + 6 F2 → 2 O2AuF6
يتفكك الملح المذكور عند الدرجة 180°س ليعطي المركب المطلوب:
- 2 O2AuF6 → Au2F10 + 2 O2 + F2
المراجع
- gold pentafluoride، معهد المعلوماتية الحيوية الأوروبي، QID:Q902623
- ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- In-Chul Hwang, Konrad Seppelt "Gold Pentafluoride: Structure and Fluoride Ion Affinity" Angewandte Chemie International Edition 2001, volume 40, 3690-3693. دُوِي: 10.1002/1521-3773(20011001)40:19<3690::AID-ANIE3690>3.0.CO;2-5
- Emeléus، H. J.؛ Sharpe، A. G. (1983). Advances in Inorganic Chemistry and Radiochemistry. Academic Press. ص. 83.
- Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (2nd ed.), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
- بوابة الكيمياء