طوافات دهنية
تحتوي الأغشية البلازمية للخلايا على مجموعات من الشَحميات السِّفنغولية السكرية والكوليسترول ومستقبلات البروتين المنظمة في النطاقات الدقيقة الدهنية للبروتين السكري والتي تسمى أطواف الدهون.[1][2][3] لا يزال وجودها في الأغشية الخلوية مثيرًا للجدل إلى حد ما. لقد اقترح أنها نطاقات غشائية متخصصة تجزئ العمليات الخلوية من خلال العمل كمراكز تنظيم لتجميع جزيئات الإشارة، مما يسمح بتفاعل أوثق لمستقبلات البروتين ومؤثراتها لتعزيز التفاعلات الإيجابية الحركية الضرورية لنقل الإشارة.[4] تؤثر الطوافات الدهنية على سيولة الغشاء وتوجيه البروتين الغشائي، وبالتالي تنظم النقل العصبي وتهريب المستقبلات.[3][5] الطوافات الدهنية أكثر ترتيبًا ومعبأة بإحكام أكثر من الطبقة الثنائية المحيطة، ولكنها تطفو بحرية داخل طبقة الغشاء الثنائية.[6] على الرغم من أنه أكثر شيوعًا في غشاء الخلية، فقد اُُبلغ أيضًا عن طوافات دهنية في أجزاء أخرى من الخلية، مثل جهاز غولجي والجسيمات الحالة.

الخصائص
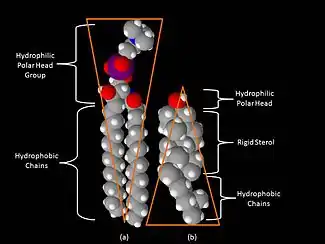
يتمثل أحد الاختلافات الرئيسية بين أطواف الدهون وأغشية البلازما التي اشتقت منها في تكوين الدهون. أظهرت الأبحاث أن أطواف الدهون تحتوي على 3 إلى 5 أضعاف كمية الكوليسترول الموجودة في الطبقة الثنائية المحيطة.[7] أيضًا، تُثرى أطواف الدهون في الشحميات السفينجولية مثل السفينجوميلين، والتي ترتفع عادةً بنسبة 50% مقارنة بغشاء البلازما. لتعويض المستويات المرتفعة من سفينجوليبيد، تنخفض مستويات الفوسفاتيديل كولين مما ينتج عنه مستويات دهون مماثلة تحتوي على مادة الكولين بين الأطواف وغشاء البلازما المحيط. يتفاعل الكوليسترول بشكل تفضيلي، وإن لم يكن حصريًا، مع السفينجوليبيدات بسبب هيكلها وتشبع سلاسل الهيدروكربون. على الرغم من عدم تشبع كل الدهون الفوسفورية داخل الطوافة بالكامل، إلا أن السلاسل الكارهة للماء للدهون الموجودة في الأطواف تكون أكثر تشبعًا ومعبأة بإحكام من الطبقة الثنائية المحيطة.[5] الكوليسترول هو «الصمغ» الديناميكي الذي يربط الطوافة ببعضها البعض.[3] بسبب الطبيعة الجامدة لمجموعة الستيرول، تُقسم الكوليسترول بشكل تفضيلي إلى مجموعات الدهون حيث تميل سلاسل الأسيل للدهون إلى أن تكون أكثر صلابة وفي حالة أقل سيولة.[5] إحدى الخصائص المهمة للدهون الغشائية هي طبيعتها الأمفيباثية. تحتوي الدهون المتضخمة على مجموعة رأس قطبية محبة للماء ومنطقة غير قطبية كارهة للماء.[8] يوضح الشكل الموجود على اليمين الشكل المخروطي المقلوب من السفينغوميلين والشكل المخروطي للكوليسترول بناءً على مساحة المساحة التي تشغلها المناطق المحبة للماء والماء. يمكن أن يتراكم الكوليسترول بين الدهون في أطواف، ويعمل كفاصل جزيئي ويملأ أي فراغات بين الشحميات السفينغولية المرتبطة.[8]
ربط Rietveld & Simons أطواف الدهون في أغشية النموذج بعدم قابلية الامتزاج (طور Lo) المرتب والمراحل السائلة المضطربة (طور Ld أو Lα).[9] سبب عدم الامتزاج غير مؤكد، لكن يُعتقد أن عدم الامتزاج يقلل من الطاقة الحرة بين المرحلتين. أظهرت الدراسات أن هناك اختلافًا في سمك الأطواف الدهنية والغشاء المحيط مما ينتج عنه عدم تطابق كاره للماء عند الحدود بين المرحلتين. لقد ثبت أن عدم تطابق ارتفاع الطور هذا يزيد من توتر الخط مما قد يؤدي إلى تكوين منصات طوافة أكبر وأكثر دائرية لتقليل التكلفة النشطة للحفاظ على الأطواف كمرحلة منفصلة. يمكن أن تؤدي الأحداث العفوية الأخرى، مثل انحناء الغشاء ودمج الأطواف الصغيرة في أطواف أكبر، إلى تقليل توتر الخط.[5]
من خلال تعريف مبكر لطوافات الدهون، تختلف أطواف الدهون عن بقية غشاء البلازما. في الواقع، افترض الباحثون[10] [من؟] أنه يمكن استخراج طوافات الدهون من غشاء البلازما. سيستفيد الاستخراج من مقاومة طوف الدهون للمنظفات غير الأيونية، مثل Triton X-100 أو Brij-98 في درجات حرارة منخفضة (على سبيل المثال، 4 درجات مئوية). عند إضافة هذا المنظف إلى الخلايا، يذوب الغشاء السائل بينما تظل أطواف الدهون سليمة ويمكن استخلاصها. [بحاجة لمصدر]
نظرًا لتكوينها ومقاومتها للمنظفات، تُسمى أطواف الدهون أيضًا مجمعات غنية بالجليكوليبيد غير قابلة للذوبان في المنظفات (GEMs) أو DIGs[11] أو أغشية مقاومة للمنظفات (DRMs). ومع ذلك، فقد تم مؤخرًا التشكيك في صحة منهجية مقاومة المنظفات للأغشية بسبب الغموض في الدهون والبروتينات المستعادة والملاحظة التي يمكن أن تتسبب أيضًا في تكوين مناطق صلبة حيث لم تكن موجودة سابقًا.[12]
عمل
وساطة تقديم المادة المتفاعلة. تعمل أطواف الدهون على توطين البروتينات المكسوة بالميتوي بعيداً عن المنطقة المضطربة لغشاء البلازما.[13] ثم يسمح تعطيل التوطين بوساطة بالميتات بتعريض البروتين لشريكه الملزم أو الركيزة في المنطقة المضطربة، وهي آلية تنشيط تسمى عرض الركيزة. على سبيل المثال، غالبًا ما يكون البروتين مرتبطًا بالميتويلين ويربط فوسفاتيديلينوسيتول 4،5-ثنائي الفوسفات (PIP2). PIP2 غير مشبع ولا يوجد في أطواف دهنية. عندما تزداد مستويات PIP2 في غشاء البلازما، ينتقل البروتين إلى مجموعات PIP2 حيث يمكن تنشيطه مباشرةً بواسطة PIP2 (أو جزيء آخر يرتبط بـ PIP2).[14][15]
من المحتمل وجود وظائف أخرى.
تاريخ
حتى عام 1982، كان من المقبول على نطاق واسع أن الدهنيات الفسفورية وبروتينات الغشاء تُوزع عشوائيًا في أغشية الخلايا، وفقًا لنموذج فسيفساء السائل Singer-Nicolson، الذي نُشر عام 1972.[5][16] ومع ذلك، تم افتراض المجالات الدقيقة للغشاء في السبعينيات باستخدام مناهج فيزيائية حيوية بواسطة Stier & Sackmann[17] وKlausner & Karnovsky.[18] نُسبت هذه المجالات الدقيقة إلى الخصائص الفيزيائية وتنظيم المخاليط الدهنية بواسطة Stier & Sackmann وIsraelachvili et al.[19] في عام 1974، أدت تأثيرات درجة الحرارة على سلوك الغشاء إلى اقتراح «مجموعات من الدهون» في الأغشية وبحلول عام 1975، اقترحت البيانات أن هذه المجموعات يمكن أن تكون مناطق «شبه بلورية» داخل جزيء شحمي بلوري سائل أكثر تشتتًا بحرية. في عام 1978، أدت دراسات حيود الأشعة السينية إلى مزيد من التطوير لفكرة «الكتلة» التي تحدد المجالات الدقيقة على أنها «الدهون في حالة أكثر تنظيمًا». قام كارنوفسكي وزملاؤه بإضفاء الطابع الرسمي على مفهوم المجالات الدهنية في الأغشية في عام 1982. وأظهرت دراسات كارنوفسكي عدم التجان في اضمحلال عمر 1,6-ثنائي فينيل -1,3,5-هيكساترين، مما يشير إلى وجود مراحل متعددة في بيئة الدهون. من الغشاء.[5] يتكون أحد أنواع المجالات الصغيرة من الكوليسترول والدهون السفينجولية. تتشكل بسبب فصل هذه الدهون في مرحلة منفصلة، كما أوضحها Biltonen و Thompson وزملاؤهما في العمل.[20] وقد تبين أن هذه المجالات الصغيرة («الطوافات») موجودة أيضًا في أغشية الخلايا.[21] في وقت لاحق، أعاد كاي سيمونز من مختبر البيولوجيا الجزيئية الأوروبي (EMBL) في ألمانيا وجيريت فان مير من جامعة أوتريخت بهولندا تركيز الاهتمام على هذه النطاقات الدقيقة للأغشية، المخصبة بالدهون والكوليسترول، والشحوم السكرية، والدهون السفينجولية الموجودة في أغشية الخلايا.[22] بعد ذلك، أطلقوا على هذه المجالات الصغيرة اسم «أطواف» الدهون. تم استخدام المفهوم الأصلي للقوارب كتفسير لنقل الكوليسترول من شبكة جولجي العابرة إلى غشاء البلازما. تُطور الفكرة بشكل رسمي أكثر في عام 1997 بواسطة Simons و Ikonen.[23] في ندوة Keystone لعام 2006 حول الأطواف الدهنية ووظيفة الخلية، تُعرف أطواف الدهون على أنها مجالات «صغيرة (10-200 نانومتر)، وغير متجانسة، وديناميكية للغاية، ومخصبة بالستيرول والسفينجوليبيد والتي تقسم العمليات الخلوية. ويمكن أحيانًا تثبيت الأطواف الصغيرة لتشكل منصات أكبر من خلال تفاعلات البروتين والبروتين» في السنوات الأخيرة، حاولت دراسات طوافة الدهون معالجة العديد من القضايا الرئيسية التي تسبب الجدل في هذا المجال، بما في ذلك حجم الطوافات وعمرها.
تشمل الأسئلة الأخرى التي لم تتم الإجابة عليها ما يلي:
- ما هي تأثيرات مستويات البروتين الغشائي؟
- ما هي الوظيفة الفسيولوجية لطوافات الدهون؟
- ما هو تأثير تدفق الدهون الغشائية على تشكيل الطوافة؟
- ما هو تأثير النظام الغذائي والأدوية على مجموعات الدهون؟
- ما هو تأثير البروتينات الموجودة على حدود الطوافة على أطواف الدهون؟[5]
الأنواع الشائعة
اقترح نوعين من أطواف الدهون: أطواف الدهون المستوية (يشار إليها أيضًا باسم الأطواف غير الكهفية، أو الجليكوليبيد، والطوافات الكهفية). تعرف الأطواف المستوية بأنها مستمرة مع مستوى غشاء البلازما (غير مغمور) وبسبب افتقارها إلى السمات المورفولوجية المميزة. Caveolae، من ناحية أخرى، عبارة عن غشاءات على شكل قارورة لغشاء البلازما التي تحتوي على بروتينات الكافولين وهي أكثر الهياكل التي يتم ملاحظتها بسهولة في أطواف الدهون. يتم التعبير عن الكافولين على نطاق واسع في الدماغ، والأوعية الدقيقة للجهاز العصبي، والخلايا البطانية، والخلايا النجمية، والخلايا الدبقية قليلة التغصن، وخلايا شوان، وعقد الجذر الظهرية، والخلايا العصبية الحصينية. تحتوي الأطواف المستوية على بروتينات flotillin وتوجد في الخلايا العصبية حيث تغيب الكهوف. كلا النوعين لهما تركيبة دهنية متشابهة (غني بالكوليسترول والدهون السفينغولية). يمكن لـ Flotillin و caveolins تجنيد جزيئات الإشارة في طوافات دهنية، وبالتالي تلعب دورًا مهمًا في نقل إشارة الناقل العصبي. لقد اقترح أن هذه المجالات الصغيرة تنظم جزيئات الإشارة مكانيًا لتعزيز التفاعلات المواتية من الناحية الحركية والضرورية لنقل الإشارة. على العكس من ذلك، يمكن لهذه المجالات الصغيرة أيضًا فصل جزيئات الإشارة، مما يؤدي إلى تثبيط التفاعلات وتثبيط استجابات الإشارات.[24]
دور في نقل الإشارة
تعد خصوصية ودقة نقل الإشارة ضروريين للخلايا للاستجابة بكفاءة للتغيرات في بيئتها. تُحقق ذلك جزئيًا عن طريق التوطين التفاضلي للبروتينات التي تشارك في مسارات الإشارات. في غشاء البلازما، تستخدم إحدى طرق التقسيم أطوافًا دهنية.[25]
إحدى الطرق المعقولة للنظر في طوافات الدهون هي أن الطوافات الصغيرة يمكن أن تشكل منصات تركيز بعد تنشيط ربط يجند للمستقبلات الفردية.[26] وجد الباحثون أن أطواف الدهون تشارك في العديد من عمليات نقل الإشارات، مثل إشارات الغلوبولين المناعي E، وإشارات مستقبلات الخلايا التائية، وإشارات مستقبلات الخلايا البائية، وإشارات مستقبلات EGF، وإشارات مستقبلات الأنسولين، وما إلى ذلك. لتوضيح هذه المبادئ، وُصفت الأمثلة التفصيلية لمسارات الإشارات التي تتضمن أطوافًا دهنية أدناه.
إشارات عامل نمو البشرة
يرتبط عامل نمو البشرة (EGF) بمستقبل EGF، المعروف أيضًا باسم HER-1 أو ErbB1، لبدء إشارات الغشاء. اقترح طوافات دهنية لتلعب دورًا ثنائيًا في هذه العملية. تمنع جوانب معينة من أطواف الدهون وظيفة مستقبلات عامل النمو البشري (EGF):
- أُثبت أن مكون ganglioside في أطواف الدهون يثبط تنشيط المستقبل[27][28]
- أُثبت قدرة الغشاء ثنائي القطب، والتي ثبت أنها أعلى في أطواف الدهون مقارنة بباقي الغشاء،[29] لتثبيط ارتباط EGF بمستقبلاته[30]
- أُثبت أن ارتباط EGF تُثبت بواسطة أطواف دهنية غير كهفية بسبب انخفاض عدد المستقبلات المتاحة لربط الترابط[31]
- تبين أن EGF[32] و ErbB2 (HER-2)[30] يهاجران من الأطواف الدهنية أو الكهوف أثناء التنشيط أو بعده
- وقد تبين أن اضطراب أطواف الدهون يحفز التنشيط المستقل عن الترابط لمستقبلات عامل النمو العشوائي. في الوقت نفسه، يبدو أن الطوافات الدهنية ضرورية للإشارة عبر الغشاء أو تقويتها:[33]
- أُثبت أن عزل ErbB2 من أطواف الدهون يثبط الإشارات التي يسببها عامل النمو البشري (EGF)[34]
- جهد ثنائي القطب الغشائي، والذي يكون أعلى في الأطواف الدهنية منه في بقية الغشاء،[29] يقوي الإشارات المستحثة بعامل عامل النمو البصري[30]
- أُثبت أن عامل نمو عامل النمو (EGF) يؤدي إلى اندماج أطواف الدهون الفردية،[35] على غرار ما اقترحه للعب دور في تنشيط مستقبل الخلايا التائية[36]
- يؤدي توطين مستقبلات EGF إلى طوافات دهنية إلى مقاومة مثبطات التيروزين كينيز[37]
إشارات الغلوبولين المناعي E
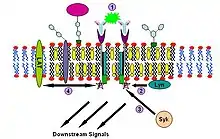
إن إشارات الغلوبولين المناعي E (IgE) هي أول طوافات دهنية مثبتة بشكل مقنع تتضمن عملية تأشير.[38][39][40] تتضمن الأدلة على هذه الحقيقة انخفاض قابلية الذوبان لمستقبلات Fc-epsilon (FcεR) في Triton X-100 من الحالة المستقرة إلى حالة التشابك،[38] تكون البقع كبيرة بما يكفي لتُصور بواسطة الفحص المجهري الفلوري من Gangliosides والبروتينات المرتبطة بـ GPI[41][42] إلغاء إشارات IgE عن طريق استنفاد الكوليسترول السطحي باستخدام methyl-β-cyclodextrin[43] وما إلى ذلك. يمكن وصف مسار الإشارة هذا على النحو التالي: يرتبط IgE أولاً بمستقبلات Fc-epsilon (FcεR) الموجودة في غشاء البلازما للخلايا البدينة والخلايا القاعدية من خلال مقطع Fc الخاص بها. FcεR عبارة عن رباعيات تتكون من سلسلة α واحدة وسلسلة β وسلسلتين Y. إنه أحادي ويربط جزيء IgE واحد. ترتبط سلسلة α بـ IgE وتحتوي السلاسل الثلاثة الأخرى على مستقبلات مناعية على أساس التيروزين التنشيط (ITAM). ثم ترتبط المستضدات قليلة القسيمات بـ IgE المرتبط بالمستقبلات لتشابك اثنين أو أكثر من هذه المستقبلات. يقوم هذا الارتباط المتشابك بعد ذلك بتجنيد مستقبلات غير مؤلفة بشكل مضاعف من نوع Src مثل التيروزين كيناز لين لتفسفر ITAMs. بعد ذلك، تربط كينازات عائلة التيروزين لعائلة Syk بقايا الفوسفوتيروزين هذه من ITAMs لبدء سلسلة الإشارات.[38][39] يمكن لـ Syk، بدوره، تنشيط بروتينات أخرى مثل LAT. من خلال الربط المتشابك، يمكن لـ LAT تجنيد بروتينات أخرى في الطوافة وزيادة تضخيم الإشارة.[44]
مستقبلات مستضد الخلايا التائية
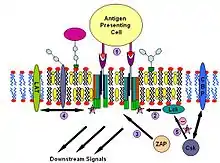
مستقبل مستضد الخلايا التائية (TCR) هو جزيء موجود على سطح الخلايا اللمفاوية التائية (الخلايا التائية). وهو يتألف من αβ-heterodimers و CD3 () ومجمع homodimer. تحتوي الوحدتان الفرعيتان α- و-على مواقع ربط خارج الخلية للببتيدات التي تُقدم بواسطة بروتينات الصنف الأول من معقد التوافق النسيجي الرئيسي (MHC) والفئة الثانية على سطح خلايا تقديم المستضد (APCs). تحتوي الوحدات الفرعية CD3 و-على أشكال ITAM السيتوبلازمية. أثناء عملية التشوير، يجمع ربط MHCs بـ TCRs مستقبلين أو أكثر معًا. هذا التشابك، على غرار إشارات IgE، يقوم بتجنيد كينازات التيروزين غير المستقبلة بشكل مضاعف والتي تشبه Src لتفسفر مخلفات التيروزين من ITAM. بالإضافة إلى تجنيد Lyn، تقوم إشارات TCR أيضًا بتجنيد Fyn.[25][45] باتباع هذا الإجراء، يرتبط ZAP-70 (الذي يختلف أيضًا مع إشارات IgE) بـ ITAMs الفسفوري، مما يؤدي إلى تنشيطه الخاص وتنشيط LAT. التنشيط LAT هو مصدر تضخيم الإشارة. هناك اختلاف آخر بين إشارات مستقبلات مستضد الخلية التائية IgE و IgE وهو أن تنشيط Lck بواسطة TCR يمكن أن يؤدي إلى تجمعات طوافة أكثر شدة[46][47] وبالتالي زيادة تضخيم الإشارة. تتضمن إحدى الآليات المحتملة لخفض تنظيم هذه الإشارة ربط cytosolic kinase Csk بالبروتين المرتبط بالبروتين CBP. قد يقوم Csk بعد ذلك بقمع إنزيمات عائلة Src من خلال الفسفرة.[48]
إشارات مستقبلات مستضد الخلايا البائية
مستقبل مستضد الخلية البائية (BCR) عبارة عن مركب بين جزيء Ig (mIg) المرتبط بالغشاء وجزيء Igα- Igβ مغاير ثنائي الكبريتيد من اثنين من عديد الببتيدات.[49] يحتوي كل من Igα و Igβ على شكل من الأحماض الأمينية، يسمى ITAM، وتسلسله هو D / ExxYxxL / Ix7YxxL / I.
تشبه عملية إشارات مستقبلات الخلايا البائية إشارات الغلوبولين المناعي E وإشارات مستقبلات مستضد الخلايا التائية. من المعتقد عمومًا أنه بخلاف BCR، تلعب الطوافات الدهنية دورًا مهمًا في العديد من أحداث سطح الخلية المتضمنة في تنشيط الخلايا البائية. تشمل وظائفها الإشارات بواسطة BCR، وتعديل تلك الإشارات بواسطة المستقبلات المشتركة، والإشارات بواسطة CD40، والتضامن من المستضد المرتبط بـ BCR وتوجيهها إلى الإندوسومات المتأخرة لتسهيل تحميل الببتيدات المشتقة من المستضد على جزيئات الفئة الثانية من معقد التوافق النسيجي الكبير، وتوجيه تلك مجمعات الببتيد / MHC-II على سطح الخلية، ومشاركتها في عرض المستضد للخلايا التائية.[49]
كمنصات لإدخال الفيروسات
يجب أن تتضمن الفيروسات، كطفيليات داخل الخلايا، تفاعلًا محددًا بين الفيروس والمستقبلات الخلوية المعبر عنها في غشاء البلازما من أجل دخول الخلايا. تدعم الأدلة المتراكمة دخول الفيروسات إلى الخلايا عن طريق اختراق المجالات الدقيقة الغشائية، بما في ذلك الأطواف الدهنية.[50][51]
فيروس غير مغلف
أفضل النماذج المدروسة للدخول الفيروسي غير المغلف المرتبط بطوافات الدهون هي فيروس القردة 40 (SV40، Papovaviridae) وechovirus type 1 (EV1، Picornaviridae).
يستخدم SV40 مستقبلين مختلفين للارتباط بسطح الخلية: Ganglioside GM1 الموجود في أطواف دهنية وجزيء من الدرجة الأولى متوافق مع الأنسجة (MHC).[50][51] يؤدي ربط SV40 بجزيئات معقد التوافق النسيجي الكبير من الفئة الأولى إلى تجميع المستقبلات وإعادة التوزيع. قد يقوم SV40 بتجنيد المزيد من الكهوف من السيتوبلازم أو حتى الكهوف الجديدة المتكونة في موقع الدخول.[51] سلسلة من أحداث التأشير التي يسببها الفيروس والتي تُشغل عن طريق التعلق تؤدي إلى الالتقام الخلوي بوساطة الكهوف في حوالي 20 دقيقة.[51] في بعض أنواع الخلايا، يمكن للفيروس أن يدخل الكهوف مباشرة من طوافات دهنية في حويصلات غير مغلفة.[51][52]
يستخدم EV1 إنتغرين α2β1 كمستقبل خلوي.[50] يمكن أن ترتبط متغايرات الإنتغرين المتعددة بالمواقع المجاورة لقفيصة الفيروس.[51] على غرار SV40، يؤدي التعلق والارتباط بالخلايا إلى تكتل ونقل جزيئات الإنتجرين من الأطواف الدهنية إلى الهياكل الشبيهة بالكافولا.[51] استنفاد الكوليسترول في أطواف الدهون يثبط عدوى EV1.[50]
هناك أيضًا فيروسات تستخدم الالتقام الخلوي غير الكهفي، مثل Echovirus 11 (EV11، picornavirus). ومع ذلك، لا تزال الآليات التفصيلية بحاجة إلى مزيد من التوصيف.[51]
فيروس مغلف
ترتبط فيروسات الإنفلونزا بالمستقبل الخلوي لحمض السياليك، الذي يرتبط بمقترن الجليكوجيت على سطح الخلية، لبدء الالتقام الخلوي. بعد النقل إلى الجسيمات الداخلية المتأخرة، تحفز تغييرات التشكل المعتمدة على الرقم الهيدروجيني المنخفض لـ HA الاندماج، ويتم إطلاق مجمعات البروتين النووي الفيروسي (RNP) عن طريق تدفق البروتون لبروتينات قناة الأيونات الفيروسية M2 التي تتطلب الارتباط بالكوليسترول. يتطلب فيروس Semliki Forest (SFV) وفيروس Sindbis (SIN) الكوليسترول والشحميات السفينغولية في أطواف الدهون الغشائية المستهدفة لدمج ودخول الغشاء بوساطة البروتين السكري.[53] يدخل فيروس T-lymphotropic البشري من النوع الأول (HTLV-1) إلى الخلايا عبر ناقل الجلوكوز 1 (GLUT-1). يستخدم فيروس الإيبولا وفيروس ماربورغ مستقبلات الفولات- α (FRα)، وهو بروتين مرتبط بـ GPI، كمستقبل خلوي. يتعرف فيروس التهاب الكبد B على النوع 2 من المستقبلات التكميلية البشرية (CR2، أو المعروفة باسم CD21). يرتبط فيروس الهربس البشري 6 (HHV-6) بـ CD46 البشري على سطح الخلية المضيفة. توجد كل هذه المستقبلات الفيروسية في أطواف دهنية أو سيتم نقلها إلى مجموعات دهنية بعد الإصابة.
يجب أن يخترق فيروس نقص المناعة البشرية (HIV)، باعتباره فيروسًا حيوانيًا ينتقل عن طريق الاتصال الجنسي، أولاً حاجزًا من الخلايا الظهارية، التي لا تعبر عن مستقبلات CD4 والكيموكين، لتكوين عدوى منتجة. المستقبل البديل للبروتين السكري لمغلف HIV-1 على الخلايا الظهارية هو جلايكوسفينجوليبيد غالاكتوزيل سيراميد (GalCer)، الذي يثري في طوف الدهون.[54][55]
التصور
نشأ أحد الأسباب الرئيسية للجدل حول أطواف الدهون من تحديات دراسة أطواف الدهون في الخلايا الحية، والتي ليست في حالة توازن ديناميكي حراري.[24] أطواف الدهون عبارة عن نطاقات صغيرة صغيرة يتراوح حجمها من 10 إلى 200 نانومتر.[5] نظرًا لكون حجمها أقل من حد الانعراج الكلاسيكي لمجهر الضوء فقد ثبت صعوبة تصور الأطواف الدهنية بشكل مباشر. حاليا يتم دراسة الأغشية الاصطناعية. ومع ذلك، هناك عيوب كثيرة لاستخدام هذه الأغشية. أولاً، تحتوي الأغشية الاصطناعية على تركيز أقل من البروتينات مقارنة بالأغشية الحيوية. أيضًا، من الصعب نمذجة التفاعلات بين الغشاء الخلوي والهيكل الخلوي الموجودة في الأغشية الحيوية. تشمل المزالق الأخرى عدم التناسق الطبيعي وعدم القدرة على دراسة الأغشية في ظروف عدم التوازن.[5][56] على الرغم من ذلك، يتم استخدام المجهر الفلوري على نطاق واسع في هذا المجال. على سبيل المثال، يتم استخدام الفلوروفورات المقترنة بوحدة B الفرعية لسم الكوليرا، والتي ترتبط بمكوِّن الطوافة ganglioside GM1 على نطاق واسع. تستخدم أيضًا أصباغ الغشاء المحبة للدهون والتي إما أن تفصل بين الأطواف والغشاء الكتلي، أو تغير خصائصها الفلورية استجابة لمرحلة الغشاء. Laurdan هو أحد الأمثلة الرئيسية لمثل هذه الصبغة. يمكن أيضًا تمييز الأطواف بالتعبير الجيني لبروتينات الانصهار الفلورية مثل Lck-GFP.
يعد التلاعب بالكوليسترول أحد أكثر الأساليب استخدامًا لدراسة أطواف الدهون. العزل (باستخدام الفليبين، النيستاتين أو الأمفوتريسين)، النضوب والإزالة (باستخدام ميثيل-ب-سيكلودكسترين) وتثبيط تخليق الكوليسترول (باستخدام مثبطات اختزال HMG-CoA) هي طرق يتم بها التلاعب بالكوليسترول في دراسات طوافة الدهون. تسمح هذه الدراسات بملاحظة التأثيرات على إشارات الناقل العصبي عند خفض مستويات الكوليسترول.[24]
استخدم شارما وزملاؤه مزيجًا من التصوير عالي الدقة والنمذجة الرياضية لتقديم وجهة نظر مفادها أن بروتينات الطوافة منظمة في مجموعات نانوية عالية الكثافة يتراوح نصف قطرها بين 5-20 نانومتر. باستخدام قياسات نقل طاقة الرنين الفلوري بين نفس المجسات (homo-FRET أو تباين مضان)، أفاد شارما وزملاؤه أن جزءًا (20-40٪) من البروتينات المرتبطة بـ GPI منظمة في مجموعات عالية الكثافة نصف قطرها 4-5 نانومتر، يتكون كل منها من عدد قليل من الجزيئات وبروتينات مختلفة مرتبطة بـ GPI.[57] لمكافحة مشاكل الحجم الصغير والطبيعة الديناميكية، فإن تتبع الجسيمات الفردية والجزيئات باستخدام كاميرات CCD المبردة والحساسة والفحص المجهري للانعكاس الداخلي الكلي (TIRF) يبرز. يسمح هذا باستخراج معلومات عن انتشار الجسيمات في الغشاء، وكذلك الكشف عن حظائر الغشاء والحواجز ومواقع الحبس.[58]
تُستخدم أيضًا تقنيات بصرية أخرى: يمكن استخدام الارتباط الفلوري والتحليل الطيفي للارتباط المتبادل (FCS / FCCS) للحصول على معلومات حول تنقل الفلوروفور في الغشاء، ويمكن أن يكتشف نقل طاقة الرنين الفلوري (FRET) عندما تكون الفلوروفورات على مقربة وملاقط بصرية يمكن أن تعطي التقنيات معلومات عن لزوجة الغشاء.[24]
ليس فقط التقنيات البصرية، ولكن أيضًا تقنيات المسح الضوئي مثل الفحص المجهري للقوة الذرية (AFM) أو الفحص المجهري لتوصيل أيونات المسح (SICM) يمكن استخدامها لاكتشاف الخصائص الطوبولوجية والميكانيكية للدهون الاصطناعية[59] أو أغشية الخلايا الأصلية[60] المعزولة بواسطة فتح الخلية.
يستخدم أيضًا قياس التداخل ثنائي الاستقطاب، الرنين المغناطيسي النووي (NMR) على الرغم من أن الفحص المجهري الفلوري لا يزال هو التقنية السائدة. في المستقبل، من المأمول أن يتغلب الفحص المجهري فائق الدقة مثل استنفاد الانبعاثات المحفز (STED)[61] أو الأشكال المختلفة من الفحص المجهري للإضاءة المنظمة على المشكلات التي يفرضها حد الانعراج.
التقنيات الأخرى المستخدمة في تحليل أطواف الدهون تشمل ELISA، النشاف الغربي، وFACS.[62][63]
الجدل
لم يتم بعد تحديد دور الطوافات في الإشارات الخلوية، والاتجار، والهيكل على الرغم من العديد من التجارب التي تنطوي على عدة طرق مختلفة، ووجودها بحد ذاته مثير للجدل على الرغم من كل ما سبق.[64]
تشمل الحجج ضد وجود أطواف الدهون ما يلي:
- أولاً، يجب أن يوجد توتر خط بين مرحلتي Lα و Lo. شوهد هذا الخط في أغشية النموذج، ولكن لم يتم ملاحظته بسهولة في أنظمة الخلايا.
- ثانيًا، لا يوجد إجماع على حجم طوافة الدهون، والتي اُُبلغ عنها في أي مكان بين 1 و 1000 نانومتر.
- ثالثًا، النطاق الزمني لوجود طوافة الدهون غير معروف. في حالة وجود أطواف دهنية، فقد تحدث فقط على نطاق زمني لا علاقة له بالعمليات البيولوجية.
- رابعًا، قد يوجد الغشاء بأكمله في الطور Lo.
يقترح الطعن الأول لهذه النقطة أن طور Lo من الطوافات معبأ بشكل أكثر إحكامًا بسبب الترابط الهيدروجين بين الجزيئات الذي يظهر بين السفينغوليبيدات والكوليسترول الذي لا يُرى في أي مكان آخر.[65]
تتساءل الحجة الثانية عن فعالية التصميم التجريبي عند تعطيل أطواف الدهون. يناقش بايك وميلر المزالق المحتملة لاستخدام استنفاد الكوليسترول لتحديد وظيفة طوف الدهون.[66] لاحظوا أن معظم الباحثين كانوا يستخدمون طرقًا حادة لاستنفاد الكوليسترول، والتي تعطل الطوافات، ولكنها أيضًا تعطل دهونًا أخرى تُعرف باسم PI (4,5) P2.[67] يلعب PI (4،5) P2 دورًا كبيرًا في تنظيم الهيكل الخلوي للخلية،[67] كما يتسبب تعطيل PI (4,5) P2 في العديد من نفس النتائج مثل هذا النوع من استنفاد الكوليسترول، بما في ذلك الانتشار الجانبي للبروتينات في غشاء.[68] نظرًا لأن الطرق تعطل كل من الطوافات و PI (4,5) P2، Kwik et al. خلص إلى أن فقدان وظيفة خلوية معينة بعد استنفاد الكوليسترول لا يمكن بالضرورة أن يُعزى فقط إلى اضطراب طوافة الدهون، حيث قد تتأثر أيضًا العمليات الأخرى المستقلة عن الطوافات. أخيرًا، بينما يُعتقد أن طوافات الدهون مرتبطة بطريقة ما بالبروتينات، يجادل إيدين بأن البروتينات تجذب الدهون في الطوافة من خلال تفاعلات البروتينات مع سلاسل الأسيل الموجودة في الدهون، وليس العكس.[69]
مراجع
- Thomas، Sunil؛ Preda-Pais، Anca؛ Casares، Sofia؛ Brumeanu، Teodor-D (2004). "Analysis of lipid rafts in T cells". Molecular Immunology. ج. 41 ع. 4: 399–409. DOI:10.1016/j.molimm.2004.03.022. PMID:15163537.
- Thomas، Sunil؛ Kumar S.، Rajeev؛ Brumeanu، Teodor−D. (2004). "Role of lipid rafts in T cells". Archivum Immunologiae et Therapiae Experimentalis. ج. 52 ع. 4: 215–24. PMID:15467486. مؤرشف من الأصل في 2017-10-06.
- Korade، Zeljka؛ Kenworthy، Anne K. (2008). "Lipid rafts, cholesterol, and the brain". Neuropharmacology. ج. 55 ع. 8: 1265–73. DOI:10.1016/j.neuropharm.2008.02.019. PMC:2638588. PMID:18402986.
- Alves, Anna Carolina Schneider; Dias, Reinaldo Antonio; Kagami, Luciano Porto; Neves, Gustavo Machado das; Torres, Fernando Cidade; Eifler-Lima, Vera Lucia; Carvalho, Ivone; Kawano*, Carolina de Miranda Silva and Daniel Fabio (31 May 2018). "Beyond the". Current Medicinal Chemistry (بالإنجليزية). 25 (18): 2082–2104. DOI:10.2174/0929867325666180111100601. PMID:29332565.
- Pike، L. J. (2008). "The challenge of lipid rafts". The Journal of Lipid Research. ج. 50: S323–8. DOI:10.1194/jlr.R800040-JLR200. PMC:2674732. PMID:18955730.
- Simons، Kai؛ Ehehalt، Robert (2002). "Cholesterol, lipid rafts, and disease". Journal of Clinical Investigation. ج. 110 ع. 5: 597–603. DOI:10.1172/JCI16390. PMC:151114. PMID:12208858.
- Laura، Anchisi؛ Sandra Dessi؛ Alessandra Pani؛ Antonella Mandas (25 نوفمبر 2012). "Cholesterol homeostasis: a key to prevent or slow down neurodegeneration". Frontiers in Physiology. ج. 3: 486. DOI:10.3389/fphys.2012.00486. PMC:3539713. PMID:23316166.
- Fantini، Jacques؛ Garmy، Nicolas؛ Mahfoud، Radhia؛ Yahi، Nouara (2004). "Lipid rafts: Structure, function and role in HIV, Alzheimer's and prion diseases". Expert Reviews in Molecular Medicine. ج. 4 ع. 27: 1–22. DOI:10.1017/S1462399402005392. PMID:14987385. S2CID:2638429. مؤرشف من الأصل في 2022-02-21.
- Rietveld، Anton؛ Simons، Kai (1998). "The differential miscibility of lipids as the basis for the formation of functional membrane rafts". Biochimica et Biophysica Acta (BBA) - Reviews on Biomembranes. ج. 1376 ع. 3: 467–79. DOI:10.1016/S0304-4157(98)00019-7. PMID:9805010.
- Radeva, Galina; Sharom, Frances J. (15 May 2004). "Isolation and characterization of lipid rafts with different properties from RBL-2H3 (rat basophilic leukaemia) cells". Biochemical Journal (بالإنجليزية). 380 (1): 219–230. DOI:10.1042/bj20031348. ISSN:0264-6021. PMC:1224147. PMID:14769131.
- Fivaz، Marc؛ Abrami، Laurence؛ Van Der Goot، F.Gisou (1999). "Landing on lipid rafts". Trends in Cell Biology. ج. 9 ع. 6: 212–3. DOI:10.1016/S0962-8924(99)01567-6. PMID:10354632.
- Heerklotz، H. (2002). "Triton Promotes Domain Formation in Lipid Raft Mixtures". Biophysical Journal. ج. 83 ع. 5: 2693–701. Bibcode:2002BpJ....83.2693H. DOI:10.1016/S0006-3495(02)75278-8. PMC:1302353. PMID:12414701.
- Levental، I؛ Lingwood، D؛ Grzybek، M؛ Coskun، U؛ Simons، K (21 ديسمبر 2010). "Palmitoylation regulates raft affinity for the majority of integral raft proteins". Proceedings of the National Academy of Sciences of the United States of America. ج. 107 ع. 51: 22050–4. Bibcode:2010PNAS..10722050L. DOI:10.1073/pnas.1016184107. PMC:3009825. PMID:21131568.
- Petersen، EN؛ Chung، HW؛ Nayebosadri، A؛ Hansen، SB (15 ديسمبر 2016). "Kinetic disruption of lipid rafts is a mechanosensor for phospholipase D." Nature Communications. ج. 7: 13873. Bibcode:2016NatCo...713873P. DOI:10.1038/ncomms13873. PMC:5171650. PMID:27976674.
- Robinson، CV؛ Rohacs، T؛ Hansen، SB (سبتمبر 2019). "Tools for Understanding Nanoscale Lipid Regulation of Ion Channels". Trends in Biochemical Sciences. ج. 44 ع. 9: 795–806. DOI:10.1016/j.tibs.2019.04.001. PMC:6729126. PMID:31060927.
- Singer، S. J.؛ Nicolson، Garth L. (1972). "The Fluid Mosaic Model of the Structure of Cell Membranes". Science. ج. 175 ع. 4023: 720–31. Bibcode:1972Sci...175..720S. DOI:10.1126/science.175.4023.720. PMID:4333397. S2CID:83851531.
- Stier، A.؛ Sackmann، E. (1973). "Spin labels as enzyme substrates Heterogeneous lipid distribution in liver microsomal membranes". Biochimica et Biophysica Acta (BBA) - Biomembranes. ج. 311 ع. 3: 400–8. DOI:10.1016/0005-2736(73)90320-9. PMID:4354130.
- Karnovsky، Morris J.؛ Kleinfeld، Alan M.؛ Hoover، Richard L.؛ Klausner، Richard D. (1982). "The concept of lipid domains in membranes". The Journal of Cell Biology. ج. 94 ع. 1: 1–6. DOI:10.1083/jcb.94.1.1. PMC:2112185. PMID:6889603.
- Israelachvili، J. N.؛ Marčelja، S.؛ Horn، R. G. (2009). "Physical principles of membrane organization". Quarterly Reviews of Biophysics. ج. 13 ع. 2: 121–200. DOI:10.1017/S0033583500001645. hdl:10536/DRO/DU:30041475. PMID:7015403.
- Estep، T. N.؛ Mountcastle، D. B.؛ Barenholz، Y.؛ Biltonen، R. L.؛ Thompson، T. E. (1979). "Thermal behavior of synthetic sphingomyelin-cholesterol dispersions". Biochemistry. ج. 18 ع. 10: 2112–7. DOI:10.1021/bi00577a042. PMID:435470.
- Goodsaid-Zalduondo، F.؛ Rintoul، D. A.؛ Carlson، J. C.؛ Hansel، W. (1982). "Luteolysis-Induced Changes in Phase Composition and Fluidity of Bovine Luteal Cell Membranes". Proceedings of the National Academy of Sciences of the United States of America. ج. 79 ع. 14: 4332–6. Bibcode:1982PNAS...79.4332G. DOI:10.1073/pnas.79.14.4332. JSTOR:12587. PMC:346665. PMID:6956862.
- Simons، Kai؛ Van Meer، Gerrit (1988). "Lipid sorting in epithelial cells". Biochemistry. ج. 27 ع. 17: 6197–202. DOI:10.1021/bi00417a001. hdl:1874/293951. PMID:3064805.
- Simons، Kai؛ Ikonen، Elina (1997). "Functional rafts in cell membranes". Nature. ج. 387 ع. 6633: 569–72. Bibcode:1997Natur.387..569S. DOI:10.1038/42408. PMID:9177342. S2CID:4359503.
- Allen، John A.؛ Halverson-Tamboli، Robyn A.؛ Rasenick، Mark M. (2006). "Lipid raft microdomains and neurotransmitter signalling". Nature Reviews Neuroscience. ج. 8 ع. 2: 128–40. DOI:10.1038/nrn2059. PMID:17195035. S2CID:2098892.
- Janes، Peter W.؛ Ley، Steven C.؛ Magee، Anthony I.؛ Kabouridis، Panagiotis S. (2000). "The role of lipid rafts in T cell antigen receptor (TCR) signalling". Seminars in Immunology. ج. 12 ع. 1: 23–34. DOI:10.1006/smim.2000.0204. PMID:10723795.
- Schmitz، Gerd. "Update on lipid membrane microdomains": 106–12. DOI:10.1097/MCO.0b013e3282f44c2c. مؤرشف من الأصل في 2022-04-22.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة)[وصلة مكسورة] - Miljan، Erik A؛ Bremer، Eric G. (2002). "Regulation of growth factor receptors by gangliosides". Sci STKE. ج. 2002 ع. 160: RE15. DOI:10.1126/stke.2002.160.re15. PMID:12454318. S2CID:84509111.
- Coskun، Ünal؛ Grzybek، Michal؛ Drechsel، David؛ Simons، Kai (2011). "Regulation of human EGF receptor by lipids". Proc Natl Acad Sci U S A. ج. 108 ع. 22: 9044–8. Bibcode:2011PNAS..108.9044C. DOI:10.1073/pnas.1105666108. PMC:3107302. PMID:21571640.
- Kovács، Tamás. "The dipole potential correlates with lipid raft markers in the plasma membrane of living cells": 1681–1691. DOI:10.1194/jlr.M077339.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة) - Kovács، Tamás. "The Dipole Potential Modifies the Clustering and Ligand Binding Affinity of ErbB Proteins and Their Signaling Efficiency". DOI:10.1038/srep35850.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة) - Roepstorff، Kirstine. "Sequestration of epidermal growth factor receptors in non-caveolar lipid rafts inhibits ligand binding". DOI:10.1074/jbc.M201422200.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة) - Mineo، Chieko. "Regulated migration of epidermal growth factor receptor from caveolae". DOI:10.1074/jbc.274.43.30636.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة) - Nagy، Peter. "Lipid rafts and the local density of ErbB proteins influence the biological role of homo- and heteroassociations of ErbB2". DOI:10.1242/jcs.00118. مؤرشف من الأصل في 2018-08-22.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة) - "View source for Lipid raft - Wikipedia". en.wikipedia.org (بالإنجليزية). Archived from the original on 2021-10-14. Retrieved 2022-01-21.
- Hofman، Erik G. "EGF induces coalescence of different lipid rafts". DOI:10.1242/jcs.028753.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة) - FILIPP، D. "Lipid rafts: resolution of the ?fyn problem??". DOI:10.1016/j.molimm.2004.04.011.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة) - Irwin، Mary E. "Lipid raft localization of EGFR alters the response of cancer cells to the EGFR tyrosine kinase inhibitor gefitinib". DOI:10.1002/jcp.22570.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة) - Field، Kenneth A.؛ Holowka، David؛ Baird، Barbara (1995). "FcɛRI-Mediated Recruitment of p53/56lyn to Detergent- Resistant Membrane Domains Accompanies Cellular Signaling". Proceedings of the National Academy of Sciences of the United States of America. ج. 92 ع. 20: 9201–5. Bibcode:1995PNAS...92.9201F. DOI:10.1073/pnas.92.20.9201. JSTOR:2368438. PMC:40952. PMID:7568101.
- Sheets، Erin D؛ Holowka، David؛ Baird، Barbara (1999). "Membrane organization in immunoglobulin E receptor signaling". Current Opinion in Chemical Biology. ج. 3 ع. 1: 95–9. DOI:10.1016/S1367-5931(99)80017-9. PMID:10021405.
- Baird، Barbara؛ Sheets، Erin D؛ Holowka، David (1999). "How does the plasma membrane participate in cellular signaling by receptors for immunoglobulin E?". Biophysical Chemistry. ج. 82 ع. 2–3: 109–19. DOI:10.1016/S0301-4622(99)00110-6. PMID:10631794.
- Stauffer، Thomas P.؛ Meyer، Tobias (1997). "Compartmentalized IgE Receptor-mediated Signal Transduction in Living Cells". The Journal of Cell Biology. ج. 139 ع. 6: 1447–54. DOI:10.1083/jcb.139.6.1447. PMC:2132626. PMID:9396750.
- Holowka، David؛ Sheets، Erin D.؛ Baird، Barbara (2000). "Interactions between FcεRI and lipid raft components are regulated by the actin cytoskeleton". Journal of Cell Science. ج. 113 ع. 6: 1009–19. DOI:10.1242/jcs.113.6.1009. PMID:10683149. مؤرشف من الأصل في 2018-08-23.
- Sheets، E. D.؛ Holowka، D؛ Baird، B (1999). "Critical Role for Cholesterol in Lyn-mediated Tyrosine Phosphorylation of Fcepsilon RI and Their Association with Detergent-resistant Membranes". The Journal of Cell Biology. ج. 145 ع. 4: 877–87. DOI:10.1083/jcb.145.4.877. PMC:2133197. PMID:10330413.
- Goitsuka، R.؛ Kanazashi، H؛ Sasanuma، H؛ Fujimura، Y؛ Hidaka، Y؛ Tatsuno، A؛ Ra، C؛ Hayashi، K؛ Kitamura، D (2000). "A BASH/SLP-76-related adaptor protein MIST/Clnk involved in IgE receptor-mediated mast cell degranulation". International Immunology. ج. 12 ع. 4: 573–80. DOI:10.1093/intimm/12.4.573. PMID:10744659.
- Langlet، Claire؛ Bernard، Anne-Marie؛ Drevot، Philippe؛ He، Hai-Tao (2000). "Membrane rafts and signaling by the multichain immune recognition receptors". Current Opinion in Immunology. ج. 12 ع. 3: 250–5. DOI:10.1016/S0952-7915(00)00084-4. PMID:10781401.
- Zhang، W؛ Trible، RP؛ Samelson، LE (1998). "LAT PalmitoylationIts Essential Role in Membrane Microdomain Targeting and Tyrosine Phosphorylation during T Cell Activation". Immunity. ج. 9 ع. 2: 239–46. DOI:10.1016/S1074-7613(00)80606-8. PMID:9729044.
- Brdička، Tomáš؛ Černý، Jan؛ Hořejší، Václav (1998). "T Cell Receptor Signalling Results in Rapid Tyrosine Phosphorylation of the Linker Protein LAT Present in Detergent-Resistant Membrane Microdomains". Biochemical and Biophysical Research Communications. ج. 248 ع. 2: 356–60. DOI:10.1006/bbrc.1998.8857. PMID:9675140. S2CID:782789. مؤرشف من الأصل في 2021-08-26.
- Cooper، Jonathan A.؛ Cary، Leslie A. (2000). "Molecular switches in lipid rafts". Nature. ج. 404 ع. 6781: 945–947. DOI:10.1038/35010257. PMID:10801110.
- Gupta، Neetu؛ Defranco، Anthony L. (2007). "Lipid rafts and B cell signaling". Seminars in Cell & Developmental Biology. ج. 18 ع. 5: 616–26. DOI:10.1016/j.semcdb.2007.07.009. PMC:2169358. PMID:17719248.
- Chazal، Nathalie؛ Gerlier، Denis (2003). "Virus Entry, Assembly, Budding, and Membrane Rafts". Microbiology and Molecular Biology Reviews. ج. 67 ع. 2: 226–37, table of contents. DOI:10.1128/MMBR.67.2.226-237.2003. PMC:156468. PMID:12794191.
- Pietiäinen، Vilja M.؛ Marjomäki، Varpu؛ Heino، Jyrki؛ Hyypiä، Timo (2005). "Viral entry, lipid rafts and caveosomes". Annals of Medicine. ج. 37 ع. 6: 394–403. DOI:10.1080/07853890510011976. PMID:16203612. S2CID:40632761.
- Rajendran، Lawrence؛ Simons، Kai (2005). "Lipid rafts and membrane dynamics". Journal of Cell Science. ج. 118 ع. 6: 1099–102. DOI:10.1242/jcs.01681. PMID:15764592.
- Rawat، Satinder S.؛ Viard، Mathias؛ Gallo، Stephen A.؛ Rein، Alan؛ Blumenthal، Robert؛ Puri، Anu (2003). "Modulation of entry of enveloped viruses by cholesterol and sphingolipids (Review)". Molecular Membrane Biology. ج. 20 ع. 3: 243–54. DOI:10.1080/0968768031000104944. PMID:12893532. S2CID:36443978.
- Campbell، S.M؛ Crowe، S.M؛ Mak، J (2001). "Lipid rafts and HIV-1: From viral entry to assembly of progeny virions". Journal of Clinical Virology. ج. 22 ع. 3: 217–27. DOI:10.1016/S1386-6532(01)00193-7. PMID:11564586.
- Alving، Carl R.؛ Beck، Zoltan؛ Karasavva، Nicos؛ Matyas، Gary R.؛ Rao، Mangala (2006). "HIV-1, lipid rafts, and antibodies to liposomes: Implications for anti-viral-neutralizing antibodies (Review)". Molecular Membrane Biology. ج. 23 ع. 6: 453–65. DOI:10.1080/09687860600935348. PMID:17127618. S2CID:38887150. مؤرشف من الأصل في 2020-06-03.
- Jacobson، Ken؛ Mouritsen، Ole G.؛ Anderson، Richard G. W. (2007). "Lipid rafts: At a crossroad between cell biology and physics". Nature Cell Biology. ج. 9 ع. 1: 7–14. DOI:10.1038/ncb0107-7. PMID:17199125. S2CID:7876073.
- Sharma، Pranav؛ Varma، Rajat؛ Sarasij، R.C؛ Ira؛ Gousset، Karine؛ Krishnamoorthy، G؛ Rao، Madan؛ Mayor، Satyajit (2004). "Nanoscale Organization of Multiple GPI-Anchored Proteins in Living Cell Membranes". Cell. ج. 116 ع. 4: 577–89. DOI:10.1016/S0092-8674(04)00167-9. PMID:14980224.
- Ritchie، Ken؛ Shan، Xiao-Yuan؛ Kondo، Junko؛ Iwasawa، Kokoro؛ Fujiwara، Takahiro؛ Kusumi، Akihiro (2005). "Detection of Non-Brownian Diffusion in the Cell Membrane in Single Molecule Tracking". Biophysical Journal. ج. 88 ع. 3: 2266–77. Bibcode:2005BpJ....88.2266R. DOI:10.1529/biophysj.104.054106. PMC:1305276. PMID:15613635.
- Chiantia، Salvatore؛ وآخرون (2006). "Effects of ceramide on liquid-ordered domains investigated by simultaneous AFM and FCS". Biophysical Journal. ج. 90 ع. 12: 4500–4508. Bibcode:2006BpJ....90.4500C. DOI:10.1529/biophysj.106.081026. PMC:1471841. PMID:16565041.
- Galvanetto، Nicola (2018). "Single-cell unroofing: probing topology and nanomechanics of native membranes". Biochimica et Biophysica Acta (BBA) - Biomembranes. ج. 1860 ع. 12: 2532–2538. arXiv:1810.01643. Bibcode:2018arXiv181001643G. DOI:10.1016/j.bbamem.2018.09.019. PMID:30273580. S2CID:52897823.
- Eggeling، Christian؛ Ringemann، Christian؛ Medda، Rebecca؛ Schwarzmann، Günter؛ Sandhoff، Konrad؛ Polyakova، Svetlana؛ Belov، Vladimir N.؛ Hein، Birka؛ وآخرون (2009). "Direct observation of the nanoscale dynamics of membrane lipids in a living cell". Nature. ج. 457 ع. 7233: 1159–62. Bibcode:2009Natur.457.1159E. DOI:10.1038/nature07596. hdl:11858/00-001M-0000-0012-D8CA-4. PMID:19098897. S2CID:4428863.
- Thomas، S. "Sensitive detection of GM1 lipid rafts and TCR partitioning in the T cell membrane". DOI:10.1016/S0022-1759(03)00014-0.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة) - Thomas، Sunil. "A Model for Antigen-Specific T-Cell Anergy: Displacement of CD4-p56lck Signalosome from the Lipid Rafts by a Soluble, Dimeric Peptide-MHC Class II Chimera1". DOI:10.4049/jimmunol.170.12.5981.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة) - Munro، Sean (2003). "Lipid rafts: elusive or illusive?". Cell. ج. 115 ع. 4: 377–88. DOI:10.1016/S0092-8674(03)00882-1. PMID:14622593.
- Barenholz، Yechezkel (2004). "Sphingomyelin and Cholesterol: From Membrane Biophysics and Rafts to Potential Medical Applications". في Quinn، Peter J. (المحرر). Membrane Dynamics and Domains. Subcellular Biochemistry. ج. 37. ص. 167–215. DOI:10.1007/978-1-4757-5806-1_5. ISBN:978-1-4419-3447-5. PMID:15376621.
- Pike، L. J.؛ Miller، JM (1998). "Cholesterol Depletion Delocalizes Phosphatidylinositol Bisphosphate and Inhibits Hormone-stimulated Phosphatidylinositol Turnover". Journal of Biological Chemistry. ج. 273 ع. 35: 22298–304. DOI:10.1074/jbc.273.35.22298. PMID:9712847.
- Caroni، P. (2001). "NEW EMBO MEMBERS' REVIEW: Actin cytoskeleton regulation through modulation of PI(4,5)P2 rafts". The EMBO Journal. ج. 20 ع. 16: 4332–6. DOI:10.1093/emboj/20.16.4332. PMC:125564. PMID:11500359.
- Kwik، Jeanne؛ Boyle، Sarah؛ Fooksman، David؛ Margolis، Leonid؛ Sheetz، Michael P.؛ Edidin، Michael (2003). "Membrane cholesterol, lateral mobility, and the phosphatidylinositol 4,5-bisphosphate-dependent organization of cell actin". Proceedings of the National Academy of Sciences. ج. 100 ع. 24: 13964–9. Bibcode:2003PNAS..10013964K. DOI:10.1073/pnas.2336102100. JSTOR:3148895. PMC:283529. PMID:14612561.
- Edidin، Michael (2003). "THE STATE OF LIPID RAFTS: From Model Membranes to Cells". Annual Review of Biophysics and Biomolecular Structure. ج. 32: 257–83. DOI:10.1146/annurev.biophys.32.110601.142439. PMID:12543707. S2CID:13122250. مؤرشف من الأصل في 2022-01-21.
- بوابة علم الأحياء الخلوي والجزيئي