ضفيرة مشيموية
الضفيرة المشيموية (بالإنجليزية: Choroid plexus) هي ضفيرة من الخلايا التي تنتج السائل الدماغي الشوكي في بطينينات الدماغ، وتكون حاجز الدم-السائل الدماغي الشوكي
| ضفيرة مشيموية | |
|---|---|
| الاسم العلمي Plexus choroideus | |
 الضفيرة المشيموية تحمل رقم 2 | |
| تفاصيل | |
| نوع من | ضفيرة، وكيان تشريحي معين |
| جزء من | جهاز عصبي مركزي |
| ترمينولوجيا أناتوميكا | 14.1.09.279، A14.1.01.307، A14.1.01.306، A14.1.01.304 و A14.1.05.715 |
| FMA | 61934 |
| UBERON ID | 0001886 |
| ن.ف.م.ط. | A08.186.211.140.298 |
| ن.ف.م.ط. | D002831 |
التركيب
الموقع
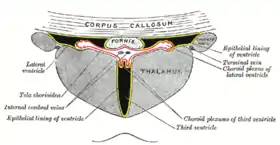
يوجد أربع ضفيائر مشيموية في الدماغ بعدد بطينات الدماغ (ضفيرة لكل بطين). وتوجد الضفيرة في جميع أجزاء البطين باستثناء المسال الدماغي، والقرن الأمامي والقذالي للبطينات الجانبية.[1]

حيث تقع الضفيرة المشيموية في البطين الجانبي فقط في قرنه السًفلي، وتمرر عبر الثقبة بين البطينات لتصل إلى البطين الثالث، وتوجد ضفيرة البطين الرابع أسفل المخيخ.
التشريح المجهري
تتكون الضفيرة المشيموية من طبقة من خلايا النسيج الطلائي المكعبة حول مركز منالشعيرات الدموية والأنسجة الضامة الرخوة. ويتصل نسيج الضفيرة الطلائي بطبقة خلايا البطانة العصبية التي تبطن البطينات، وخلايا النسيج الضفيرة المشيموية الطلائي ليس لها أهداب،[2] لكنها على العكس من طبقة البطانة العصبية فإن لها موصلات مُحكمة[3] بين خلاياها على الجانب المواجهة للبطين، وتمنع هذه الموصلات المحكمة غالبية المواد من النفاذ إلى السائل الدماغي النخاعي؛ وبالتالي تُمثل الضفيرة المشيموية حاجز بين الدم والسائل الدماغي الشوكي، وتطوى الضغيرة المشيموية من الزغب حول الشعيرات الدموية مما يخلق زوائد تبرز في تجويف البطينين، ويعمل هذا الزغب على زيادة مساحة سطح الضفيرة المشيموية بشكل كبير. ويتكون السائل الدماغي الشوكي من ترشيح بلازما الدم عبر خلايا النسيج الطلائي، حيث يمكن لهذه الخلايا أن تنقل أيونات الصوديوم بشكل نشط إلى البطين وبمجرد دخول الصوديوم يتبعه دخول الماء بسبب التدرج الاسموزي.[4]
الوظيفة
تتوسط الضفيرة المشيموية إنتاج السائل الدماغي الشوكي، والذي يعمل كنظام ترشيح يُسهل من إزالة النفايات الأيضية من الدماغ، وتبادل الجزيئات الحيوية والغرائب الحيوية داخل وخارج الدماغ.[5][6][7] وبذلك تلعب الضفيرة المشيموية دورًا مهمًا للغاية في المساعدة على الحفاظ على بيئة ملائمة لعمل الدماغ على النحو الأمثل.
كما تُعتبر الضفيرة المشيموية أيضا مصدر رئيسي لإفراز الترانسفرين الذي يلعب دورا في أيض الحديد في الدماغ.[8][9]
حاجز الدم - السائل الدماغي الشوكي
حاجز الدم - السائل الدماغي النخاعي هو زوج من الأغشية التي تفصل بين الدم والسائل الدماغي الشوكي.[10] ويحده عند الضفيرة المشيموية غشاء يتكون من خلايا طلائية وموصلات محكمة تربط بينها[10] وحدود هذا الحاجز هي الأم العنكبوتي التي تغلف سطح الدماغ.[10]
ويعمل هذا الحاجز (على غرار الحاجز الدموي الدماغي) على منع مرور معظم المواد التي ينقلها الدم إلى الدماغ مع السماح الانتقائي بمرور مواد محددة إلى الدماغ، وتسهيل إزالة نواتج أيض الدماغ إلى دم.[7][10][11][12] وعلى الرغم من الوظيفة المماثلة بين كلا الحاجزين، فكل منهما يسهل نقل مواد مختلفة إلى الدماغ بسبب الخصائص الهيكلية المميزة بين نظامي الحاجزين.[10][11]
الأهمية السريرية
كيس الضفيرة المشيموية
يتكون في بعض الأجنة أثناء تطورها أكياس الضفيرة المشيموية، ويمكن الكشف عن هذه الأكياس المملوءة بالسوائل عن طريق التصوير بالموجات فوق الصوتية خلال الأثلوث الثاني من الحمل، حيث تُعتبر هذه الأكياس شائعة نسبيا بمعدل انتشار ~ 1 ٪، وعادة ما تكون هذه الأكياس مشكلة وحيدة.[13] كما أنها تختفي عادة في وقت لاحق أثناء الحمل، وعادة ما تكون غير ضارة، كما أنها ليس لها أي تأثير على نمو الرضع والطفولة المبكرة.[14]
تضفي الأكياس المشيميوة 1% من خطر اختلال الصيغة الصبغية في الجنين.[15] ويزداد خطر هذا الاختلال من 10.5% حتى 12% إذا ما وجدت عوامل خطر أخرى خلال إجراء الموجات فوق الصوتية، ولا يؤثر الحجم أو الموقع أو الاختفاء أو الزيادة أو وجودها في كلا الجانبين على خطر اختلال الصيغة الصبغية، وجدير بالذكر أن 44 - 50% من حالات متلازمة إدوارد (التثلث الصبغي 18) يُصاحبها أكياس مشيموية، ونفس الشيء في 1.4% من حالات متلازمة داون (التثلث الصبغي 21).
صور إضافية
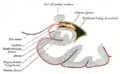 قسم الأكليلية من القرن السفلي من البطين الجانبي.
قسم الأكليلية من القرن السفلي من البطين الجانبي.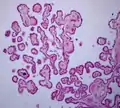 نسيج المشيمية الضفيرة 40x
نسيج المشيمية الضفيرة 40x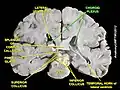 الضفيرة المشيمية
الضفيرة المشيمية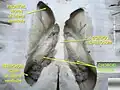 الضفيرة المشيمية
الضفيرة المشيمية
مراجع
- Young، Paul A. (2007). Basic clinical neuroscience (ط. 2nd). Philadelphia, Pa.: Lippincott Williams & Wilkins. ص. 292. ISBN:978-0-7817-5319-7.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - "A transgenic zebrafish model for the in vivo study of the blood and choroid plexus brain barriers using claudin 5". Biology Open. ج. 7 ع. 2: bio030494. فبراير 2018. DOI:10.1242/bio.030494. PMC:5861362. PMID:29437557.
- Hall، John (2011). Guyton and Hall textbook of medical physiology (ط. 12th). Philadelphia, Pa.: Saunders/Elsevier. ص. 749. ISBN:978-1-4160-4574-8.
- Guyton، Arthur C.؛ Hall، John Edward (2005). Textbook of medical physiology (ط. 11th). Philadelphia: W.B. Saunders. ص. 764–7. ISBN:978-0-7216-0240-0.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - "The Glymphatic System in Central Nervous System Health and Disease: Past, Present, and Future". Annual Review of Pathology. ج. 13: 379–394. يناير 2018. DOI:10.1146/annurev-pathol-051217-111018. PMC:5803388. PMID:29195051.
- "The role of brain barriers in fluid movement in the CNS: is there a 'glymphatic' system?". Acta Neuropathologica. ج. 135 ع. 3: 387–407. مارس 2018. DOI:10.1007/s00401-018-1812-4. PMID:29428972.
- "Alzheimer's disease against peptides products of enzymatic cleavage APP protein: Biological, pathobiological and physico-chemical properties of fibrillating peptides". Postepy Higieny I Medycyny Doswiadczalnej (Online). ج. 71: 398–410. مايو 2017. PMID:28513463.
In addition, the following studies concerning AD patients might prove challenging and simultaneously promising: peptides translocation through Blood-Brain - Barrier (BBB) and Blood-Cerebrospinal Fluid Barrier (BCSFB) and their removal from the brain according to a new concept of glymphatic system
- Moos، T (نوفمبر 2002). "Brain iron homeostasis". Danish Medical Bulletin. ج. 49 ع. 4: 279–301. PMID:12553165.
- Moos، T؛ Rosengren Nielsen، T؛ Skjørringe، T؛ Morgan، EH (ديسمبر 2007). "Iron trafficking inside the brain". Journal of Neurochemistry. ج. 103 ع. 5: 1730–40. DOI:10.1111/j.1471-4159.2007.04976.x. PMID:17953660.
- "Blood–Cerebrospinal Fluid Barrier". Basic Neurochemistry: Molecular, Cellular and Medical Aspects (ط. 6th). Philadelphia: Lippincott-Raven. 1999.
- "Elucidation of mechanism of blood-brain barrier damage for prevention and treatment of vascular dementia". Rinsho Shinkeigaku = Clinical Neurology (باليابانية). 57 (3): 95–109. Mar 2017. DOI:10.5692/clinicalneurol.cn-001004. PMID:28228623.
It is well-known that the blood-brain barrier (BBB) plays significant roles in transporting intravascular substances into the brain. ... However, the substances cannot invade the ventricles easily as there are tight junctions between epithelial cells in the choroid plexus. This restricted movement of the substances across the cytoplasm of the epithelial cells constitutes a blood-cerebrospinal fluid barrier (BCSFB). In the brain, there are circumventricular organs, in which the barrier function is imperfect in capillaries. Accordingly, it is reasonable to consider that intravascular substances can move in and around the parenchyma of the organs. Actually, it was reported in mice that intravascular substances moved in the corpus callosum, medial portions of the hippocampus, and periventricular areas via the subfornical organs or the choroid plexus. Regarding pathways of intracerebral interstitial and cerebrospinal fluids to the outside of the brain, two representative drainage pathways, or perivascular drainage and glymphatic pathways, are being established
- "Blood-brain barrier and blood-cerebrospinal fluid barrier in normal and pathological conditions". Brain Tumor Pathology. ج. 33 ع. 2: 89–96. أبريل 2016. DOI:10.1007/s10014-016-0255-7. PMID:26920424.
Blood-borne substances can invade into the extracellular spaces of the brain via endothelial cells in sites without the blood-brain barrier (BBB), and can travel through the interstitial fluid (ISF) of the brain parenchyma adjacent to non-BBB sites. It has been shown that cerebrospinal fluid (CSF) drains directly into the blood via the arachnoid villi and also into lymph nodes via the subarachnoid spaces of the brain, while ISF drains into the cervical lymph nodes through perivascular drainage pathways. In addition, the glymphatic pathway of fluids, characterized by para-arterial pathways, aquaporin4-dependent passage through astroglial cytoplasm, interstitial spaces, and paravenous routes, has been established.
- "Ultrasound screening for fetal chromosome anomalies". American Journal of Medical Genetics. ج. 90 ع. 2: 98–107. يناير 2000. DOI:10.1002/(SICI)1096-8628(20000117)90:2<98::AID-AJMG2>3.0.CO;2-H. PMID:10607945.
- "Choroid plexus cysts: infant and early childhood developmental outcome". Obstetrics and Gynecology. ج. 90 ع. 2: 191–4. أغسطس 1997. DOI:10.1016/S0029-7844(97)00251-2. PMID:9241291.
- "Choroid plexus cysts and aneuploidy". Journal of Medical Genetics. ج. 35 ع. 7: 554–7. يوليو 1998. PMC:1051365. PMID:9678699. مؤرشف من الأصل في 2019-12-09.
- بوابة تشريح
- بوابة طب
- بوابة علوم عصبية