سيكلول
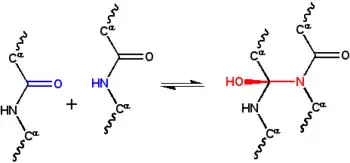
فرضية السيكلول هوأول النموذج الهيكلي رباعى من البروتين مطوي، بروتين كروي بروتين [1] تم تطويره من قبل دوروثي رينش في أواخر 1930، وكانت تقوم على ثلاثة افتراضات. أولا، تفترض فرضية أن اثنين من رابطة ببتيدية يمكن أن ترتبط تشابكيا من قبل رد فعل سيكلول (الشكل 1)؛ هذه هي الرابطة التساهمية النظير من 'غير التساهمية-رابطة هيدروجينية بين مجموعات الببتيد. وقد لوحظت هذه التفاعلات في إرجوبيبتيد وغيرها من المركبات. ثانيا، يفترض أنه في ظل بعض الظروف، فإن الأحماض الأمينية ستنشئ بطبيعة الحال أكبر عدد ممكن من روابط سيكلول التساهمية، مما يؤدى إلى جزيئات سيكلول (الشكل 2) ونسيج سيكلول (الشكل 3). ولكن لم تلاحظ أبدا هذه جزيئات سيكلول وأنسجة سيكلول. وأخيرا، فإن الفرضية تفترض أن البروتينات الكروية لديها بنية رباعية المتوافقة مع صلب أفلاطوني ومتعددات الوجوه/السطوح المنتظمة تشكلت من نسيج سيكلول مع عدم وجود حواف الحرة. لم يلاحظ مثل هذه «جزيئات المغلقة لسيكلول» سواء.
السياق التاريخي
وبحلول منتصف الثلاثينات من القرن التاسع عشر، الدراسات باستخدام الطرد المركزي الفائق السرعة التي قام بها ثيودور سفيدبرغ قد بينت أن البروتين كان له التركيب الكيميائي واضح المعالم، ولم تكن تجمعات من جزيئات صغيرة.[2] ظهرت الدراسات نفسها تبين أن الوزن الجزيئي للبروتينات ينقسم إلى عدة فئات واضحة المعالم ذات الصلة من جانب الأعداد الصحيحة،[3] مثل M w = 2p3 q وحدة كتل ذرية، حيث p و q تكون الأعداد الصحيحة غير سلبية.[4] ومع ذلك، فإنه من الصعب تحديد الوزن الجزيئي الدقيق وعدد من الأحماض الأمينية في البروتين. قد أظهر سفيدبرغ أيضا أن تغييرا في ظروف الحل قد يسبب تفكيك البروتين إلى وحدات صغيرة، والمعروفة الآن باسم تغيير في الهيكل رباعي.[5]
مراجع
- Tiselius، A (1939). "The Chemistry of Proteins and Amino Acids". Annual Review of Biochemistry. ج. 8: 155–184. DOI:10.1146/annurev.bi.08.070139.001103.
- Svedberg، T (1929). "Mass and size of protein molecules". Nature. ج. 123 ع. 3110: 871. Bibcode:1929Natur.123..871S. DOI:10.1038/123871a0.
- Svedberg، T (1934). "Sedimentation of molecules in centrifugal fields". Chemical Reviews. ج. 14: 1–15. DOI:10.1021/cr60047a001.
- Bergmann، M؛ Niemann C (1937). "On the structure of proteins: cattle hemoglobin, egg albumin, cattle fibrin, and gelatin". Journal of Biological Chemistry. ج. 118: 301–314.
- Svedberg، T (1930). "The pH Stability Regions of Proteins". Transactions of the Faraday Society. ج. 26: 741–744.
- بوابة تاريخ العلوم
- بوابة الكيمياء
- بوابة الكيمياء الحيوية