سرتوين
السرتوينات (الاسم العلمي: Sirtuins) هي عائلة من بروتينات الإشارة تشارك في تنظيم التمثيل الغذائي.[2][3] إنها قديمة في تطور الحيوانات ويبدو أنها تمتلك بنية محمية للغاية في جميع ممالك الحياة.[2] كيميائيا، السرتوينات هي فئة من البروتينات التي تمتلك نشاط أحادي ADP-ribosyltransferase أو ديسيلاز، بما في ذلك ديسيتيلاز، ديسوكسينيلاز، ديمالونيلاز، ديميريستويليز و ديبالميتويليز.[4][5][6] يأتي الاسم Sir2 من التزاوج الصامت لجين الخميرة من النوع 'silent mating-type information regulation 2', [7] وهو الجين المسؤول عن التنظيم الخلوي في الخميرة.
| Sir2 family | |||||
|---|---|---|---|---|---|
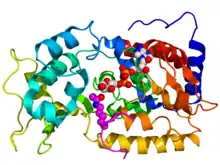 | |||||
| الهيكل البلوري لسرتوين sir2 الخميرة (رسم ملون، الطرف-N = أزرق، الطرف-C = أحمر) مشتبك مع ADP ( يملء الفراغات : كربون = أبيض، أكسجين = أحمر، نيتروجين = أزرق، فوسفور = برتقالي) وهستون ببتيد H4 (أرجواني) يحتوي على بقايا ليسين أسيل (مرسوم على شكل كرات).[1] | |||||
| معرف | |||||
| رمز | SIR2 | ||||
| قاعدة بيانات عوائل البروتينات | PF02146 | ||||
| قاعدة بيانات عوائل البروتينات clan | CL0085 | ||||
| إنتربرو | IPR003000 | ||||
| بروسايت | PS50305 | ||||
| قاعدة بيانات التصنيف الهيكلي للبروتينات | 1j8f | ||||
| |||||
من الدراسات في المختبر، تشارك السرتوينات في التأثير على العمليات الخلوية الخاصة بالشيخوخة، والنسخ، والاستماتة، والالتهاب[8] ومقاومة الإجهاد، فضلاً عن كفاءة الطاقة واليقظة أثناء المواقف منخفضة السعرات الحرارية.[9] اعتبارًا من عام 2018، لم يكن هناك دليل سريري على أن السرتوينات تؤثر على شيخوخة الإنسان.[10]
السرتوين Sir2 (سرتوين الخميرة) وبعض السرتوينات هي بروتينات ديسيتيلاز. خلافا لغيرها من ديستيلازات البروتين المعروفة، والتي تحلل ببساطة بقايا الأسيتيل - ليسين، فإن تفاعل نزع الأسيتيل بوساطة السيرتوين يشبك نزع أسيتيل الليسين إلى +NAD في التحلل المائي.[11] ينتج عن هذا التحلل المائي O-acetyl-ADP-ribose، الركيزة المنزوعة الأسيتيل والنيكوتيناميد، وهو مثبط لنشاط السرتوين نفسه. تستخدم هذه البروتينات +NAD للحفاظ على الصحة الخلوية وتحويل +NAD إلى نيكوتيناميد (NAM).[12] يربط اعتماد السرتوينات على +NAD يربط نشاطها الأنزيمي مباشرة بحالة طاقة الخلية عبر نسبة NAD+ : NADH أو المستويات المطلقة لـ +NAD أو NADH أو NAM أو لمزيج من هذه المتغيرات.
السرتوينات التي هيستونات نزع الأسيتيل متميزة من الناحية الهيكلية والميكانيكية عن الفئات الأخرى من هيستون ديسيتيلاسز (الفئات ا، IIA، IIB وIV) وهذه هي سرتوينات الإنسان (أربعة سرتوينات)، والتي لها طية بروتين مختلفة وتستخدم +Zn2 كعامل مساعد.[13][14]
النشاطات وتوزيع الأنواع
السرتوينات هي عائلة من بروتينات الإشارة تشارك في تنظيم التمثيل الغذائي.[15][16] وهي تقوم بالمراسلة والتنظيم بين نواة الخلية والمتقدرات. إنها قديمة في تطور الحيوانات ويبدو أنها تمتلك بنية محمية للغاية في جميع ممالك الحياة.[2] في حين أن البكتيريا والجراثيم تشفر إما واحدًا أو اثنين من السرتوينات، فإن حقيقيات النوى ترمز العديد من السرتوينات في جينوماتها. في الخميرة والديدان المستديرة وذباب الفاكهة، sir2 هو اسم أحد البروتينات من نوع سرتوين (انظر الجدول أدناه).[17] تمتلك الثدييات سبعة سرتوينات (SIRT1–7) تشغل حجرات ثانوية مختلفة في الخلية:توجد السرتوينات SIRT1 و SIRT6 و SIRT7 في الغالب في النواة، أما SIRT2 فيوجد في السيتوبلازم، و السرتوينات SIRT3، SIRT4 و SIRT5 في الميتوكوندريا.[2]
التاريخ
بدأ البحوث في بروتين السرتوين في عام 1991 بواسطة ليونارد جوارينتي من معهد ماساتشوستس للتكنولوجيا.[18][19] وازداد الاهتمام بعملية التمثيل الغذائي لـ +NAD بعد اكتشاف "شين-إشيرو إماي " وزملاؤه في مختبر غوارينت في عام 2000 أن السرتوينات تعتمد على +NAD في ديستيلازات البروتين.[20]
الأنواع
تم التعرف على السرتوين الأول في الخميرة (حقيقيات النوى ) وتم تسميته sir2. وهو يوجد أيضا في الثدييات الأكثر تعقيدًا. توجد في المجموع 7 إنزيمات معروفة تعمل في التنظيم الخلوي مثلما يفعل sir2 في الخميرة. تم تصنيف هذه الجينات على أنها تنتمي إلى فئات مختلفة (I-IV)، اعتمادًا على هيكل تسلسل الأحماض الأمينية.[21] تمتلك العديد من بدائيات النوى الموجبة الجرام بالإضافة إلى بكتيريا بحرية تسمى ثيرموتوغا ماريتيما سالبة الجرام السرتوينات التي هي وسيطة في التسلسل بين الفئات، وقد وضعت في فئة "غير متمايزة" أو فئة "U". بالإضافة إلى ذلك، فإن العديد من البكتيريا موجبة الجرام، بما في ذلك ستافيلوكوكوس أوروس و ستربتوكوكوس بيوجينيس، بالإضافة إلى العديد من الفطريات تحمل السرتوينات المرتبطة بالنطاق الكبير macrodomain (يطلق عليها "الفئة M" من السرتوينات).[22]
| فصل | فئة فرعية | صِنف | داخل الخلايا <br /> الموقع |
نشاط | وظيفة | |||
|---|---|---|---|---|---|---|---|---|
| بكتيريا | خميرة | الفأر | الإنسان | |||||
| I | أ | Sir2 ، <br /> Hst1 |
Sirt1 | SIRT1 | النواة، السيتوبلازم | ديسيتيلاز | التهاب التمثيل الغذائي | |
| ب | Hst2 | Sirt2 | SIRT2 | النواة والسيتوبلازم | ديسيتيلاز | دورة الخلية، تكون الأورام | ||
| Sirt3 | SIRT3 | الميتوكوندريا | ديسيتيلاز | الاسْتِقْلاب | ||||
| ج | Hst3 ، <br /> Hst4 |
|||||||
| II | سرت 4 | SIRT4 | الميتوكوندريا | ADP-الريبوسيل ترانسفيراز | إفراز الأنسولين | |||
| III | Sirt5 | SIRT5 | الميتوكوندريا | ديمالونيلاز، ديسكسينيلاز و ديسيتيلاز | إزالة السموم من الأمونيا | |||
| IV | أ | سرت 6 | SIRT6 | نواة | ديميرستويلاز، ديبالميتويليز، أدب-ريبوسيل ترانسفيراز و ديسيتيلاز | إصلاح الحمض النووي، والتمثيل الغذائي، وإفراز عامل نخر الورم | ||
| ب | سرت 7 | SIRT7 | نوية | ديسيتيلاز | نسخ الرنا الريباسي | |||
| U | كوب ب[23] | تنظيم إنزيم أسيتيل CoA المركب[24] | الاسْتِقْلاب | |||||
| M | SirTM[22] | ADP-الريبوسيل ترانسفيراز | إزالة السموم ROS | |||||
يلعب SIRT3، وهو بروتين ميتوكوندريا ديستيلاز، دورًا في تنظيم العديد من البروتينات الأيضية مثل نازعة هيدروجين الإيزوسيترات لدورة TCA. كما أنه يلعب دورًا في العضلات الهيكلية كاستجابة تكيفية أيضية. نظرًا لأن الجلوتامين هو مصدر a-ketoglutarate المستخدم لتجديد دورة TCA، فإن SIRT4 يشارك في استقلاب الجلوتامين.[25]
في الشيخوخة
على الرغم من أن الدراسات الأولية مع ريسفيراترول، وهو منشط لانزيمات الأسيتيل مثل SIRT1،[26] هو ما دفع بعض العلماء إلى التكهن بأن ريسفيراترول قد يطيل العمر، لم يكن هناك دليل سريري على هذا التأثير ( بواقع 2018).[27]
تليف الأنسجة
أشارت مراجعة أجريت عام 2018 إلى أن مستويات SIRT أقل في أنسجة الأشخاص المصابين بتصلب الجلد، وقد تزيد مستويات SIRT المنخفضة من خطر الإصابة بالتليف من خلال تعديل مسار إشارات TGF-β.[28]
إصلاح الحمض النووي
يتم استخدام بروتينات SIRT1 و SIRT6 و SIRT7 في إصلاح الحمض النووي.[29] يعزز بروتين SIRT1 إعادة التركيب المتماثل في الخلايا البشرية ويشارك في إصلاح تقطعات تحدث في الحمض النووي.[30]
SIRT6 هو بروتين مرتبط بالكروماتين وفي خلايا الثدييات مطلوب لإصلاح تلف الحمض النووي باستئصال القاعدة.[31] يؤدي نقص SIRT6 في الفئران إلى نمط ظاهري تنكسي شبيه بالشيخوخة.[31] بالإضافة إلى ذلك، يعزز SIRT6 إصلاح تقطعات في الحمض النووي.[32] علاوة على ذلك، يمكن أن يؤدي الإفراط في تعبير SIRT6 إلى تحفيز الإصلاح التأشبي المتماثل.[33]
تعرضت الفئران من SIRT7 بضربة قاضية أظهرت شيخوخة مبكرة.[34] بروتين SIRT7 مطلوب لإصلاح تقطعات مزدوجة في الحمض النووي عن طريق انضمام غير المتماثل للطرف.[34]
المثبطات
يتم تثبيط نشاط سيرتوين معين بواسطة النيكوتيناميد، والذي يرتبط بموقع مستقبل معين.[35] وهو مثبط لـ SIRT1 في المختبر، ولكن يمكن أن يكون محفزًا في الخلايا.[36]
المنشطات
| مُجَمَّع | الهدف / الخصوصية | مراجع |
|---|---|---|
| Piceatannol | SIRT1 | [37] |
| SRT1720 (بايونول) | SIRT1 | [37] |
| SRT2104 | SIRT1 | [37] |
| β-Lapachone | SIRT1 | [37] |
| سيلوستازول | SIRT1 | [37] |
| سيانيدين وأليغومريك بروانثوسيانيدينز (OPC) | SIRT6 | [38] |
| مشتقات كيرسيتين وروتين | SIRT6 | [38] |
| لوتولين | SIRT6 | [38] |
| كاتشين وإيبيكاتشين | SIRT6 | [38] |
| فيستين | SIRT6 | [38] |
| أحماض الفينول | SIRT6 | [38] |
| الفوكويدان | SIRT6 | [39] |
| الكركمين | SIRT1، SIRT6 | [40] |
| بيرفينيدون | SIRT1 | [41] |
| ميريستين | SIRT6 | [38] |
| سيانيدين | SIRT6 | [38] |
| دلفيندين | SIRT6 | [38] |
| ابيجينين | SIRT6 | [38] |
| البيوتين | SIRT6 | [42] |
| إيزوليكويريتيجينين | SIRT6 | [42] |
| حمض الفيرليك | SIRT1 | [42] |
| بربرين | SIRT1 | [42] |
| كاتشين | SIRT1 | [42] |
| مالفيدين | SIRT1 | [42] |
| بتروستيلبين | SIRT1 | [42] |
| التيروسول | SIRT1 | [42] |
انظر أيضًا
المراجع
- ببب: 1szd; Zhao K، Harshaw R، Chai X، Marmorstein R (يونيو 2004). "Structural basis for nicotinamide cleavage and ADP-ribose transfer by NAD(+)-dependent Sir2 histone/protein deacetylases". Proceedings of the National Academy of Sciences of the United States of America. ج. 101 ع. 23: 8563–8. Bibcode:2004PNAS..101.8563Z. DOI:10.1073/pnas.0401057101. PMC:423234. PMID:15150415.
- Ye، X؛ Li، M؛ Hou، T؛ Gao، T؛ Zhu، WG؛ Yang، Y (3 يناير 2017). "Sirtuins in glucose and lipid metabolism". Oncotarget (Review). ج. 8 ع. 1: 1845–1859. DOI:10.18632/oncotarget.12157. PMC:5352102. PMID:27659520.
- "Sirtuin functions in health and disease". Molecular Endocrinology. ج. 21 ع. 8: 1745–55. أغسطس 2007. DOI:10.1210/me.2007-0079. PMID:17456799.
- "Sirt5 is a NAD-dependent protein lysine demalonylase and desuccinylase". Science. ج. 334 ع. 6057: 806–9. نوفمبر 2011. Bibcode:2011Sci...334..806D. DOI:10.1126/science.1207861. PMC:3217313. PMID:22076378.
- "SIRT6 regulates TNF-α secretion through hydrolysis of long-chain fatty acyl lysine". Nature. ج. 496 ع. 7443: 110–3. أبريل 2013. Bibcode:2013Natur.496..110J. DOI:10.1038/nature12038. PMC:3635073. PMID:23552949.
- "Identification of a Class of Protein ADP-Ribosylating Sirtuins in Microbial Pathogens". Molecular Cell. ج. 59 ع. 2: 309–20. يوليو 2015. DOI:10.1016/j.molcel.2015.06.013. PMC:4518038. PMID:26166706.
- EntrezGene 23410
- "Sirtuin deacylases: a molecular link between metabolism and immunity". Journal of Leukocyte Biology. ج. 93 ع. 5: 669–80. مايو 2013. DOI:10.1189/jlb.1112557. PMID:23325925.
- "SIRT1 promotes the central adaptive response to diet restriction through activation of the dorsomedial and lateral nuclei of the hypothalamus". The Journal of Neuroscience. ج. 30 ع. 30: 10220–32. يوليو 2010. DOI:10.1523/JNEUROSCI.1385-10.2010. PMC:2922851. PMID:20668205.
- Shetty، Ashok K.؛ Kodali، Maheedhar؛ Upadhya، Raghavendra؛ Madhu، Leelavathi N. (2018). "Emerging anti-aging strategies - scientific basis and efficacy (Review)". Aging and Disease. ج. 9 ع. 6: 1165–1184. DOI:10.14336/ad.2018.1026. ISSN:2152-5250. PMC:6284760. PMID:30574426.
- "Biological and catalytic functions of sirtuin 6 as targets for small-molecule modulators". Journal of Biological Chemistry. ج. 295 ع. 32: 11021–11041. 2020. DOI:10.1074/jbc.REV120.011438. PMC:7415977. PMID:32518153.
- "NMN vs NR: The Differences Between These 2 NAD+ Precursors". www.nmn.com. مؤرشف من الأصل في 2023-07-14. اطلع عليه بتاريخ 2021-01-04.
- "Structural and chemical biology of deacetylases for carbohydrates, proteins, small molecules and histones". Communications Biology. ج. 1: 217. 2018. DOI:10.1038/s42003-018-0214-4. PMC:6281622. PMID:30534609.
- "Histone deacetylase inhibitors: Potential in cancer therapy". Journal of Cellular Biochemistry. ج. 107 ع. 4: 600–8. يوليو 2009. DOI:10.1002/jcb.22185. PMC:2766855. PMID:19459166.
- Ye، X؛ Li، M؛ Hou، T؛ Gao، T؛ Zhu، WG؛ Yang، Y (3 يناير 2017). "Sirtuins in glucose and lipid metabolism". Oncotarget (Review). ج. 8 ع. 1: 1845–1859. DOI:10.18632/oncotarget.12157. PMC:5352102. PMID:27659520.Ye, X; Li, M; Hou, T; Gao, T; Zhu, WG; Yang, Y (3 January 2017).
- "Sirtuin functions in health and disease". Molecular Endocrinology. ج. 21 ع. 8: 1745–55. أغسطس 2007. DOI:10.1210/me.2007-0079. PMID:17456799.Yamamoto H, Schoonjans K, Auwerx J (August 2007).
- "The Sir2 family of protein deacetylases". Annual Review of Biochemistry. ج. 73 ع. 1: 417–35. 2004. DOI:10.1146/annurev.biochem.73.011303.073651. PMID:15189148. مؤرشف من الأصل في 2021-04-30.
- Wade N (8 نوفمبر 2006). "The quest for a way around aging". Health & Science. International Herald Tribune. مؤرشف من الأصل في 2020-07-20. اطلع عليه بتاريخ 2008-11-30.
- "MIT researchers uncover new information about anti-aging gene". Massachusetts Institute of Technology, News Office. 16 فبراير 2000. مؤرشف من الأصل في 2016-08-28. اطلع عليه بتاريخ 2008-11-30.
- "Transcriptional silencing and longevity protein Sir2 is an NAD-dependent histone deacetylase". Nature. ج. 403 ع. 6771: 795–800. 2000. Bibcode:2000Natur.403..795I. DOI:10.1038/35001622. PMID:10693811.
- "Role for human SIRT2 NAD-dependent deacetylase activity in control of mitotic exit in the cell cycle". Molecular and Cellular Biology. ج. 23 ع. 9: 3173–85. مايو 2003. DOI:10.1128/MCB.23.9.3173-3185.2003. PMC:153197. PMID:12697818.
- "Identification of a Class of Protein ADP-Ribosylating Sirtuins in Microbial Pathogens". Molecular Cell. ج. 59 ع. 2: 309–20. يوليو 2015. DOI:10.1016/j.molcel.2015.06.013. PMC:4518038. PMID:26166706.Rack JG, Morra R, Barkauskaite E, Kraehenbuehl R, Ariza A, Qu Y, Ortmayer M, Leidecker O, Cameron DR, Matic I, Peleg AY, Leys D, Traven A, Ahel I (July 2015).
- "Structure and substrate binding properties of cobB, a Sir2 homolog protein deacetylase from Escherichia coli". Journal of Molecular Biology. ج. 337 ع. 3: 731–41. مارس 2004. DOI:10.1016/j.jmb.2004.01.060. PMID:15019790.
- "Conserved metabolic regulatory functions of sirtuins". Cell Metabolism. ج. 7 ع. 2: 104–12. فبراير 2008. DOI:10.1016/j.cmet.2007.11.006. PMID:18249170.
- "Sirtuins, metabolism, and DNA repair". Current Opinion in Genetics & Development. ج. 26: 24–32. يونيو 2014. DOI:10.1016/j.gde.2014.05.005. PMC:4254145. PMID:25005742.
- Aunan، JR؛ Watson، MM؛ Hagland، HR؛ Søreide، K (يناير 2016). "Molecular and biological hallmarks of ageing". The British Journal of Surgery (Review (in vitro)). ج. 103 ع. 2: e29-46. DOI:10.1002/bjs.10053. PMID:26771470.
- Shetty، Ashok K.؛ Kodali، Maheedhar؛ Upadhya، Raghavendra؛ Madhu، Leelavathi N. (2018). "Emerging anti-aging strategies - scientific basis and efficacy (Review)". Aging and Disease. ج. 9 ع. 6: 1165–1184. DOI:10.14336/ad.2018.1026. ISSN:2152-5250. PMC:6284760. PMID:30574426.Shetty, Ashok K.; Kodali, Maheedhar; Upadhya, Raghavendra; Madhu, Leelavathi N. (2018).
- "Sirtuins and accelerated aging in scleroderma". Current Rheumatology Reports. ج. 20 ع. 4: 16. مارس 2018. DOI:10.1007/s11926-018-0724-6. PMC:5942182. PMID:29550994.
- "Sirtuins and DNA damage repair: SIRT7 comes to play". Nucleus. ج. 8 ع. 2: 107–115. مارس 2017. DOI:10.1080/19491034.2016.1264552. PMC:5403131. PMID:28406750.
- "Role of SIRT1 in homologous recombination". DNA Repair. ج. 9 ع. 4: 383–93. أبريل 2010. DOI:10.1016/j.dnarep.2009.12.020. PMID:20097625.
- "Genomic instability and aging-like phenotype in the absence of mammalian SIRT6". Cell. ج. 124 ع. 2: 315–29. يناير 2006. DOI:10.1016/j.cell.2005.11.044. PMID:16439206.
- "SIRT6 stabilizes DNA-dependent protein kinase at chromatin for DNA double-strand break repair". Aging. ج. 1 ع. 1: 109–21. يناير 2009. DOI:10.18632/aging.100011. PMC:2815768. PMID:20157594.
- "Sirtuin 6 (SIRT6) rescues the decline of homologous recombination repair during replicative senescence". Proceedings of the National Academy of Sciences of the United States of America. ج. 109 ع. 29: 11800–5. يوليو 2012. Bibcode:2012PNAS..10911800M. DOI:10.1073/pnas.1200583109. PMC:3406824. PMID:22753495.
- "SIRT7 promotes genome integrity and modulates non-homologous end joining DNA repair". The EMBO Journal. ج. 35 ع. 14: 1488–503. يوليو 2016. DOI:10.15252/embj.201593499. PMC:4884211. PMID:27225932.
- "Mechanism of sirtuin inhibition by nicotinamide: altering the NAD(+) cosubstrate specificity of a Sir2 enzyme". Molecular Cell. ج. 17 ع. 6: 855–68. مارس 2005. DOI:10.1016/j.molcel.2005.02.022. PMID:15780941.
- "Nicotinamide is an inhibitor of SIRT1 in vitro, but can be a stimulator in cells". Cell Mol Life Sci. ج. 74 ع. 18: 3347–3362. سبتمبر 2017. DOI:10.1007/s00018-017-2527-8. PMID:28417163.
- Manjula، Ramu؛ Anuja، Kumari؛ Alcain، Francisco J. (12 يناير 2021). "SIRT1 and SIRT2 Activity Control in Neurodegenerative Diseases". Frontiers in Pharmacology. ج. 11: 585821. DOI:10.3389/fphar.2020.585821. PMC:7883599. PMID:33597872.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - Rahnasto-Rilla, Minna; Tyni, Jonna; Huovinen, Marjo; Jarho, Elina; Kulikowicz, Tomasz; Ravichandran, Sarangan; A. Bohr, Vilhelm; Ferrucci, Luigi; Lahtela-Kakkonen, Maija (7 Mar 2018). "Natural polyphenols as sirtuin 6 modulators". Scientific Reports (بالإنجليزية). 8 (1): 4163. Bibcode:2018NatSR...8.4163R. DOI:10.1038/s41598-018-22388-5. PMC:5841289. PMID:29515203.
- Rahnasto-Rilla، Minna K.؛ McLoughlin، Padraig؛ Kulikowicz، Tomasz؛ Doyle، Maire؛ Bohr، Vilhelm A.؛ Lahtela-Kakkonen، Maija؛ Ferrucci، Luigi؛ Hayes، Maria؛ Moaddel، Ruin (21 يونيو 2017). "The Identification of a SIRT6 Activator from Brown Algae Fucus distichus". Marine Drugs. ج. 15 ع. 6: 190. DOI:10.3390/md15060190. PMC:5484140. PMID:28635654.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - Grabowska، Wioleta؛ Suszek، Małgorzata؛ Wnuk، Maciej؛ Lewinska، Anna؛ Wasiak، Emilia؛ Sikora، Ewa؛ Bielak-Zmijewska، Anna (28 مارس 2016). "Curcumin elevates sirtuin level but does not postpone in vitro senescence of human cells building the vasculature". Oncotarget. ج. 7 ع. 15: 19201–19213. DOI:10.18632/oncotarget.8450. PMC:4991376. PMID:27034011.
- Sandoval-Rodriguez، Ana؛ Monroy-Ramirez، Hugo Christian؛ Meza-Rios، Alejandra؛ Garcia-Bañuelos، Jesus؛ Vera-Cruz، Jose؛ Gutiérrez-Cuevas، Jorge؛ Silva-Gomez، Jorge؛ Staels، Bart؛ Dominguez-Rosales، Jose (مارس 2020). "Pirfenidone Is an Agonistic Ligand for PPARα and Improves NASH by Activation of SIRT1/LKB1/pAMPK". Hepatology Communications. ج. 4 ع. 3: 434–449. DOI:10.1002/hep4.1474. PMC:7049672. PMID:32140659.
- da Silva, Julie Pires (31 May 2018). Rôle de la sirtuine 1 dans la modulation des réponses apoptotique et autophagique du coeur au stress du réticulum endoplasmique (phdthesis thesis) (بالفرنسية). Université Paris Saclay (COmUE). Archived from the original on 2021-09-05.
روابط خارجية
- Sirtuins في المكتبة الوطنية الأمريكية للطب نظام فهرسة المواضيع الطبية (MeSH).
- بوابة الكيمياء الحيوية
- بوابة طب
- بوابة علم الأحياء