ديوكسي ريبو نوكلياز
ديوكسي ريبو نوكلياز Deoxyribonuclease (باختصار DNase) خاصيته الكيميائية (EC 3.1.21). وهو إنزيم يعمل على تحفيز الحلمهة في عملية (إِزالة البلمرة) من ديوكسي ريبونوكليوتيد (الدنا), والذي يختصر بصيغة دناز أو (ديوكسي ريبو نوكلياز).[1]

توجد مجموعة واسعة من ديوكسيريبونوكلياز معروفة وتقع ضمن إحدى العائلتين (DNase I أو DNase II)،التي تختلف في خصائص الركيزة، والآليات الكيميائية، والوظائف البيولوجية. تشمل التطبيقات المخبرية لـ DNase تنقية البروتينات عند استخلاصها من الكائنات بدائية النواة. بالإضافة إلى ذلك، تم تطبيق DNase كعلاج للأمراض التي يسببها ecDNA في بلازما الدم. تظهر فحوصات الدناز في مجال البحث أيضًا.
الآلية
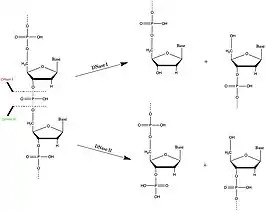
تقوم بعض الدنازات بقطع أو "تقطيع" البقايا الموجودة في نهايات جزيئات الدنا فقط. يُعرف هذا النوع من نوكلياز خارجي باسم exodeoxyribonucleases. البعض الآخر ينشق في أي مكان على طول السلسلة، والمعروف باسم endodeoxyribonucleases (مجموعة فرعية من endonucleases.) [2] بعض DNases عشوائية إلى حد ما فيما يتعلق بتسلسل الحمض النووي الذي تقطع فيه، في حين أن البعض الآخر، بما في ذلك إنزيمات التقييد، تكون محددة للغاية للتسلسل. تلتصق DNases أخرى بالحمض النووي المزدوج فقط، والبعض الآخر خاص بالجزيئات المفردة، والبعض الآخر ينشط تجاه كليهما.
يحدث عمل DNase على ثلاث مراحل. تقدم المرحلة الأولية العديد من النكات في العمود الفقري للفوسفودستر. المرحلة الثانية تنتج النيوكليوتيدات القابلة للذوبان في الأحماض. المرحلة الثالثة، وهي المرحلة النهائية، تتكون من تقليل أليغنوكليوتيدات، مما يسبب تحولًا مفرطًا في اللون في بيانات الأشعة فوق البنفسجية.[3]
آلية الدناز I
يستهدف DNase I في الغالب الحمض النووي المزدوج الجديلة، وبدرجة أقل، بعض الحمض النووي المفرد الذي لا يقوي علىالانقسام. يحفز DNase I انقسام الحمض النووي غير المحدد عن طريق خدش روابط فوسفوديستر في أحد الخيوط. يقع موقع انقسامها بين ذرة الأكسجين 3′ وذرة الفوسفور المجاورة، مما ينتج عنه أليغنوكليوتيدات 3′-هيدروكسيل و5′-فوسفوريل مع انعكاس التكوين عند الفسفرة. يعتمد إنزيم DNase على وجود كاتيون ثنائي التكافؤ، والذي عادة ما يكون Ca2+، للقيام بوظيفة مناسبة. يتضمن الموقع النشط لـ DNase I اثنين من بقايا الهيستيدين (His134 وHis252) واثنين من البقايا الحمضية (Glu78 وAsp 212)، وكلها ضرورية للتحفيز العام للحمض والقاعدة لروابط فوسفوديستر.
آلية الدناز II
يُعرف أيضًا ديوكسي ريبونوكلياز II (أي DNase II ) باسم ديوكسي ريبونوكلياز الحمضي لأنه يتمتع بنشاط مثالي في بيئة درجة الحموضة المنخفضة ، حيث يوجد عادةً في حقيقيات النوى الأعلى. تُظهر بعض أشكال DNase II المؤتلف مستوى عالٍ من النشاط في درجة حموضة منخفضة في غياب أيونات معدنية ثنائية التكافؤ، على غرار DNase II في حقيقيات النواة.[4] على عكس DNase I، يشق DNase II رابطة فوسفوديستر بين ذرة الأكسجين 5' وذرة الفوسفور المجاورة، مما ينتج عنه نيوكليوتيدات 3΄-فسفوريل و5΄-هيدروكسيل.
التطبيقات
التطبيقات المخبرية
يستخدم الدناز عادة عند تنقية البروتينات المستخرجة من الكائنات بدائية النواة. غالبًا ما يصاحب استخراج البروتين تدهور في غشاء الخلية. في العادة يتم تحلل غشاء الخلية المتدهور والهش، مما يؤدي إلى إطلاق الحمض النووي غير المرغوب فيه والبروتينات المرغوبة. يكون مستخلص بروتين الحمض النووي الناتج شديد اللزوجة ويصعب تنقيته، وفي هذه الحالة يتم إضافة الدناز لتكسيره.[11] يتم تحلل الحمض النووي ولكن البروتينات لا تتأثر ويمكن أن يخضع المستخلص لمزيد من التنقية.[5]
في العلاج
الحمض النووي خارج الخلية (ecDNA) هو الحمض النووي الموجود في الدورة الدموية. وهو يظهر نتيجة موت الخلايا المبرمج، أو النخر، أو مصائد العدلات خارج الخلية (NET) - داء خلايا الدم والأنسجة، ولكن يمكن أن ينشأ أيضًا من الإفراز النشط من الخلايا الحية. إن الدنا الخارجي EcDNA وبروتينات ربط الحمض النووي المخصصة لها قادرة على تنشيط مستقبلات استشعار الحمض النووي ومستقبلات التعرف على الأنماط (PRRs). إن PRRs قادرة على تحفيز المسارات التي تسبب الاستجابة المناعية الالتهابية. ونتيجة لذلك، فقد وجدت العديد من الدراسات حول الأمراض الالتهابية أن هناك تركيزات عالية من ecDNA في بلازما الدم. لهذا السبب، أثبت DNase أنه علاج محتمل لتقليل الدنا الخارجي ecDNA في بلازما الدم. يمكن أن تفرز الدنازات DNases داخل الخلايا وخارجها ويمكن أن تلتصق برابطة فوسفوديستر الحمض النووي. يمكن استخدام هذه الوظيفة للحفاظ على تركيز منخفض للـ ecDNA، وبالتالي علاج الالتهاب. تم استهداف الأمراض التي تنتج عن بقايا الحمض النووي في الدم باستخدام "خصائص التحلل" للـ DNase. وقد أظهرت الدراسات أن الدناز قادر على العمل كعلاج عن طريق تقليل لزوجة المخاط.[6][7] طريقة تطبيق DNase تختلف تبعا للمرض. يمكن إعطاؤه عن طريق الفم، أو داخل الجنبة، أو عن طريق الوريد، أو داخل الصفاق، أو عن طريق الاستنشاق. لا تزال العديد من الدراسات تعمل في فحص تطبيق DNase كعلاج بالإضافة إلى طرق لمراقبة الصحة. على سبيل المثال، في الآونة الأخيرة، تم استخدام الدناز المشتق من البكتيريا المسببة للأمراض كمؤشر لرصد عدوى الجروح.[8]
أمراض الجهاز التنفسي
التليف الكيسي هو اضطراب وراثي يؤثر على إنتاج المخاط والعرق والسوائل الهضمية، مما يجعلها أكثر لزوجة بدلا من أن تكون مواد تشحيم. يمكن استنشاق إنزيمات DNase باستخدام البخاخات من قبل مرضى التليف الكيسي. تساعد إنزيمات DNase لأن خلايا الدم البيضاء تتراكم في المخاط، وعندما تتحلل، فإنها تطلق الحمض النووي، مما يزيد من "لزوجة" المخاط. تقوم إنزيمات DNase بتكسير الحمض النووي، ومن الأسهل بكثير إزالة المخاط من الرئتين. على وجه التحديد، يُستخدم DNase I، المعروف أيضًا باسم عقار Pulmozyme المعتمد من إدارة الغذاء والدواء الأمريكية (المعروف أيضًا باسم dornase alfa) كعلاج لزيادة وظائف الرئة.
كما وجد أن أمراض الجهاز التنفسي الأخرى مثل الربو،[9] الدبيلة الجنبية،[6] ومرض الانسداد الرئوي المزمن تتأثر بشكل إيجابي بخصائص DNases.
علاوة على ذلك، تظهر الدراسات الحديثة أن منشط البلازمينوجين في الأنسجة داخل الجنبة (tPA)، وهو البروتين المسؤول عن تحلل جلطات الدم، بالاشتراك مع ديوكسيريبونوكلياز يزيد من التصريف الجنبي، ويقلل من مدة الإقامة في المستشفى، ويقلل من الحاجة إلى الجراحة في حالات الانصبابات المجاورة الرئوية والدبيلة.
أمراض أخرى
الإنتان هو مرض التهابي يهدد الحياة وينتج عن استجابة الجسم الشديدة للعدوى. يبدأ الجسم بمهاجمة نفسه كاستجابة التهابية تشمل جسم الإنسان. ونتيجة لذلك، ارتبطت المستويات العالية من ecDNA بمجرى الدم، وبالتالي، نظر الباحثون إلى DNase كعلاج مناسب. أظهرت الدراسات أن DNase كان ناجحًا في تعطيل الشبكات وتقليل الاستجابات الالتهابية. هناك حاجة إلى مزيد من البحث حول نوع ووقت التطبيق لتعزيز DNase كعلاج رسمي.[10][11][12]
الذئبة الحمامية الجهازية (SLE) هي أحد أمراض المناعة الذاتية التي تؤدي إلى إنتاج أجسام مضادة ذاتية تسبب التهابًا يؤدي إلى تلف الأعضاء والمفاصل والكلى. تم ربط مرض الذئبة الحمراء (SLE) بمستويات منخفضة من DNase I حيث تصبح الخلايا المبرمجية مستضدات ذاتية في هذا المرض. لقد تم البحث في DNase I كعلاج محتمل لتقليل كمية حطام موت الخلايا المبرمج في النظام البشري. وقد اقترح أن الصعوبة قد تكون بسبب عدم قدرة الإنزيم على تحطيم غشاء الخلية للكروماتين. أظهرت الدراسات نتائج متضاربة حول هذا العلاج، ومع ذلك، يتم إجراء المزيد من الأبحاث لفحص الفوائد العلاجية لـ DNase I.[11][13][14]
العلاج المضاد للورم. ومن المعروف أن DNase يحمل تأثيرات مضادة للورم بسبب قدرته على تحطيم الحمض النووي. تم العثور على مستويات عالية من الحمض النووي في دم مرضى السرطان، مما يشير إلى أن DNase I قد يكون علاجًا محتملاً. لا يزال هناك نقص في الفهم لسبب وجود مثل هذه المستويات العالية من ecDNA وما إذا كان DNase سيكون بمثابة علاج فعال أم لا. وقد أظهرت العديد من دراسات الفئران نتائج إيجابية في تطور مكافحة الورم باستخدام DNase I عن طريق الوريد. ومع ذلك، يجب إجراء المزيد من الفحوص قبل تقديمه للجمهور.[13][15]
الفحوص
يمتص الحمض النووي الضوء فوق البنفسجي بطول موجة يبلغ الحد الأقصى للامتصاص بالقرب من 260 نانومتر. ويرجع هذا الامتصاص إلى "إلكترونات باي" pi electrons الموجودة في القواعد العطرية للحمض النووي. في dsDNA، أو حتى مناطق الحمض النووي الريبي (RNA) حيث يحدث هيكل مزدوج الجديلة، يتم تكديس القواعد بالتوازي مع بعضها البعض، ويؤدي تداخل المدارات الجزيئية الأساسية إلى انخفاض في امتصاص الضوء فوق البنفسجي. وتسمى هذه الظاهرة تأثير نقص اللون. عندما يحرر DNase النيوكليوتيدات من dsDNA، لا تعد القواعد مكدسة كما هي في dsDNA، بحيث يتم تقليل التداخل المداري للذرات إلى الحد الأدنى ويزيد امتصاص الأشعة فوق البنفسجية. هذه الزيادة في الامتصاص تكمن وراء أساس وحدة كونيتز لنشاط DNase. يتم تعريف وحدة كونيتز Kunitz unit على أنها كمية الإنزيم المضافة إلى 1 ملغم/مل من الحمض النووي للحيوانات المنوية لسمك السلمون والذي يسبب زيادة في الامتصاص بمقدار 0.001 في الدقيقة عند الطول الموجي 260 نانومتر عند العمل على الحمض النووي عالي البلمرة عند درجة حرارة 25 درجة مئوية في 0.1 مولار NaOAc (عند الرقم الهيدروجيني 5.0) كمهديء. اسم الوحدة يشير إلى عالم الكيمياء الحيوية الروسي الأمريكي موسى كونيتز، الذي اقترح الاختبار القياسي في عام 1946.[16]
يجب تشغيل تحضير الإنزيم القياسي بالتوازي مع عينة مجهولة لأن توحيد مستحضرات الحمض النووي ودرجة بلمرتها في المحلول تكون غير ممكنة.
انتشار الإنزيم الشعاعي الفردي (SRED)
تم تقديم هذه الطريقة البسيطة لقياس نشاط DNase I بواسطة الباحث ندانو وزملائه. ويعتمد على خلاصة الحمض النووي في هلام الاغاروز بواسطة الدناز، والذي يوجد في العينات المسقطة في الهلام.[13][17] يتم تمثيل نشاط الدناز بحجم البئر الدائرية الموزعة في طبقة هلام الاغاروز، حيث يتم توزيع الحمض النووي الملون ببروميد الإيثيديوم بشكل موحد. بعد الحضانة، يتم تشكيل منطقة مظلمة دائرية حيث ينتشر الإنزيم من نقطة السقوط بشكل دوراني شعاعي في الهلام ويشق الحمض النووي. خضع SRED للعديد من التعديلات، مما أدى إلى زيادة في الحساسية والسلامة، مثل استبدال بروميد الإيثيديوم بـ SYBR Green I أو بقع هلام الحمض النووي الأخرى.[17]
فحص نشاط الدناز 1 اللوني
تم تطوير فحص نشاط DNase I اللوني لتقييم استقرار DNase I المؤتلف البشري (Pulmozyme). تم تعديل الطريقة من اختبار نشاط إنزيم نقطة النهاية اللونية استنادًا إلى تدهور مركب الحمض النووي/الميثيل الأخضر.[18]
اقرأ أيضا
- بي دي بي سام
- ديوكسيريبونوكلياز 1
- ديوكسيريبونوكلياز 2
المراجع
- Deoxyribonuclease I - Worthington Enzyme Manual نسخة محفوظة 26 يوليو 2017 على موقع واي باك مشين.
- Bowen RA، Austgen L، Rouge M (20 فبراير 2000). "Restriction Endonucleases and DNA Modifying Enzymes". Nucleases: DNase and RNase. مؤرشف من الأصل في 2004-08-05. اطلع عليه بتاريخ 2017-01-08.
{{استشهاد بكتاب}}:|عمل=تُجوهل (مساعدة) - Bernardi, Giorgio (1 Jan 1971), Boyer, Paul D. (ed.), "11 Spleen Acid Deoxyribonuclease", The Enzymes, Hydrolysis (بالإنجليزية), Academic Press, vol. 4, pp. 271–287, DOI:10.1016/S1874-6047(08)60371-6, ISBN:9780121227043, Archived from the original on 2023-02-14, Retrieved 2022-10-27
- Lazarus, Robert A.; Wagener†, Jeffrey S. (2019), "Recombinant Human Deoxyribonuclease I", Pharmaceutical Biotechnology (بالإنجليزية), Cham: Springer International Publishing, pp. 471–488, DOI:10.1007/978-3-030-00710-2_22, ISBN:978-3-030-00709-6, PMC:7124075
- Simpson، G.؛ Roomes، D.؛ Heron، M. (2006). "Effects of streptokinase and deoxyribonuclease on the viscosity of human surgical and empyema pus". Chest. ج. 117 ع. 6: 1728–1733. DOI:10.1378/chest.117.6.1728. ISSN:0012-3692. PMID:10858409. مؤرشف من الأصل في 2022-10-27.
- J.B. Armstrong, J.C. White Liquefaction of viscous purulent exudates by deoxyribonuclease Lancet, 259 (1950), pp. 739-742
- Xiong Z, Achavananthadith S, Lian S, Madden LE, Ong ZX, Chua W, et al. (2021). "A wireless and battery-free wound infection sensor based on DNA hydrogel". Science Advances (بالإنجليزية). 7 (47): eabj1617. Bibcode:2021SciA....7.1617X. DOI:10.1126/sciadv.abj1617. PMC:8604401. PMID:34797719.
- Boogaard، R.؛ Smit، F.؛ Schornagel، R.؛ Vaessen-Verberne، A. a. P. H.؛ Kouwenberg، J. M.؛ Hekkelaan، M.؛ Hendriks، T.؛ Feith، S. W. W.؛ Hop، W. C. J.؛ de Jongste، J. C.؛ Merkus، P. J. F. M. (2008). "Recombinant human deoxyribonuclease for the treatment of acute asthma in children". Thorax. ج. 63 ع. 2: 141–146. DOI:10.1136/thx.2007.081703. ISSN:1468-3296. PMID:17675321. S2CID:309718.
- Chen، QiXing؛ Ye، Ling؛ Jin، YuHong؛ Zhang، Ning؛ Lou، TianZheng؛ Qiu، ZeLiang؛ Jin، Yue؛ Cheng، BaoLi؛ Fang، XiangMing (2012). "Circulating nucleosomes as a predictor of sepsis and organ dysfunction in critically ill patients". International Journal of Infectious Diseases. ج. 16 ع. 7: e558–564. DOI:10.1016/j.ijid.2012.03.007. ISSN:1878-3511. PMID:22609014.
- Janovičová, Ľubica; Čonka, Jozef; Lauková, Lucia; Celec, Peter (1 Oct 2022). "Variability of endogenous deoxyribonuclease activity and its pathophysiological consequences". Molecular and Cellular Probes (بالإنجليزية). 65: 101844. DOI:10.1016/j.mcp.2022.101844. ISSN:0890-8508. PMID:35803442. S2CID:250328196. Archived from the original on 2022-10-27.
- Mai, Safiah H. C†; Khan, Momina*†; Dwivedi, Dhruva J.†‡; Ross, Catherine A.§; Zhou, Ji†; Gould, Travis J†; Gross, Peter L†‡; Weitz, Jeffrey I†‡; Fox-Robichaud, Alison E†‡∥; Liaw, Patricia C†‡∥ for the Canadian Critical Care Translational Biology Group. Delayed but not Early Treatment with DNase Reduces Organ Damage and Improves Outcome in a Murine Model of Sepsis. Shock: August 2015 - Volume 44 - Issue 2 - p 166–172 دُوِي:10.1097/SHK.0000000000000396
- Fernando Martínez Valle, Eva Balada, Josep Ordi-Ros, Miquel Vilardell-Tarres, DNase 1 and systemic lupus erythematosus, Autoimmunity Reviews, Volume 7, Issue 5,2008, Pages 359–363, ISSN 1568-9972, دُوِي:10.1016/j.autrev.2008.02.002.
- Trejo-Becerril, Catalina; Pérez-Cardenas, Enrique; Gutiérrez-Díaz, Blanca; De La Cruz-Sigüenza, Desiree; Taja-Chayeb, Lucía; González-Ballesteros, Mauricio; García-López, Patricia; Chanona, José; Dueñas-González, Alfonso (26 Jul 2016). "Antitumor Effects of Systemic DNase I and Proteases in an In Vivo Model". Integrative Cancer Therapies (بالإنجليزية). 15 (4): NP35–NP43. DOI:10.1177/1534735416631102. ISSN:1534-7354. PMC:5739158. PMID:27146129.
- Rowlett، Russ. "K". A Dictionary of Units of Measurement. University of North Carolina at Chapel Hill. مؤرشف من الأصل في 2023-10-05. اطلع عليه بتاريخ 2022-10-27.
- Yasuda، T.؛ Takeshita، H؛ Nakazato، E.؛ Nakajima، T.؛ Hosomi، O.؛ Nakashima، Y.؛ Kishi، K. (1998). "Activity Measurement for Deoxyribonucleases I and II with Picogram Sensitivity Based on DNA/SYBR Green I Fluorescence". Anal. Biochem. ج. 255 ع. 2: 274–276. DOI:10.1006/abio.1997.2496. PMID:9451514.
- Horney، D.L.؛ Webster، D.A. (1971). "Deoxyribonuclease: A sensitive assay using radial diffusion in agarose containing methyl green-DNA complex". Biochim. Biophys. Acta. ج. 247 ع. 1: 54–61. DOI:10.1016/0005-2787(71)90806-9. PMID:4946282.
وصلات خارجية
http://www.drugs.com/ppa/dornase-alfa-recombinant-human-deoxyribonuclease-dnase.html
http://www.sigmaaldrich.com/catalog/product/sigma/dn25?lang=en®ion=US
- بوابة الكيمياء
- بوابة الكيمياء الحيوية
- بوابة علم الأحياء
- بوابة علم الأحياء الخلوي والجزيئي