حمض سداسي فلورو السيليسيك
حمض سداسي فلورو السيليسيك هو مركب كيميائي يوجد على شكل محلول فقط، ويتكون من عناصر الفلور والسيليكون والهيدروجين، وله الصيغة H2SiF6، ويكون على شكل سائل عديم اللون.
| حمض سداسي فلورو السيليسيك | |
|---|---|
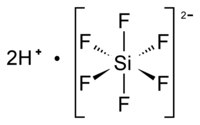 حمض سداسي فلورو السيليسيك | |
 حمض سداسي فلورو السيليسيك | |
| التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية | |
Hexafluorosilicic acid | |
| تسمية الاتحاد الدولي للكيمياء | |
Dihydrogen hexafluorosilicate | |
| أسماء أخرى | |
Fluorosilicic acid, fluosilic acid, hydrofluorosilicic acid, silicofluoride, silicofluoric acid, oxonium hexafluorosilanediuide, oxonium hexafluoridosilicate(2−) | |
| المعرفات | |
| رقم CAS | 16961-83-4 |
| بوب كيم (PubChem) | 21863527 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | H2SiF6 |
| الكتلة المولية | 144.09 غ/مول |
| المظهر | سائل عديم اللون |
| الكثافة | 1.38 غ/سم3 (تركيز 35%) |
| نقطة الانصهار | − 30 °س (تركيز 35%) |
| نقطة الغليان | 110 °س يتفكك |
| الذوبانية في الماء | يمتزج مع الماء |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
تسمى أملاح هذا الحمض باسم سداسي فلوروسيليكات.
التحضير
يحضر حمض سداسي فلورو السيليسيك من تفاعل حمض هيدروفلوريك مع ثنائي أكسيد السيليكون (الكوارتز):
أو من تفاعل الماء مع رباعي فلوريد السيليكون.[2]
الخواص
حمض سداسي فلورو السيليسيك هو سائل عديم اللون يوجد دوماً على شكل محلول له رائحة واخزة. ومن الصعب الحصول على محاليل مركزة له، إذ أنه يتفكك في حالة غياب الماء عند درجة حرارة الغرفة إلى رباعي فلوريد السيليكون وفلوريد الهيدروجين. يمكن إجراء تقطير للمركب دون أن يتفكك فقط عندما يكون التركيز 13.3 % بشكل أعظمي على شكل محلول مائي.[2]
الاستخدامات
تحول الغالبية من حمض سداسي فلورو السيليسيك المنتجة إلى مركبات أخرى، وهي فلوريد الألومنيوم والكريوليت بشكل رئيسي.[3] إذ أن هذه المركبات ضرورية الاستخدام أثناء تعدين فلز الألومنيوم.
كما يستخدم حمض سداسي فلورو السيليسيك في تحضير العديد من أملاح سداسي فلوروسيليكات المفيدة، مثل ملح البوتاسيوم المستخدم في صناعة البورسلان؛ في حين أن ملح المغنيسيوم يمزج مع الاسمنت للتقسية.
اقرأ أيضاً
المراجع
- Hexafluorosilicic acid (بالإنجليزية), QID:Q278487
- G. Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry, 2nd ed., vol. 1, Academic Press 1963, S. 214–215.
- Aigueperse، J.؛ Mollard، P.؛ Devilliers، D.؛ Chemla، M.؛ Faron، R.؛ Romano، R.؛ Cuer، J. P. (2005). "Fluorine Compounds, Inorganic". Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. DOI:10.1002/14356007.a11_307.
- بوابة الكيمياء