ثلاثي فلوريد البورون
ثلاثي فلوريد البورون هو مركب كيميائي من الفلور والبورون له الصيغة الكيميائية BF3، ويكون على شكل غاز عديم اللون.
| ثلاثي فلوريد البورون | |
|---|---|
 ثلاثي فلوريد البورون |
 ثلاثي فلوريد البورون |
| الاسم النظامي (IUPAC) | |
Boron trifluoride | |
| أسماء أخرى | |
ثلاثي فلورو البوران | |
| المعرفات | |
| رقم CAS | 7637-07-2 13319-75-0 ثنائي هيدرات |
| بوب كيم (PubChem) | 6356 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | BF3 |
| الكتلة المولية | 67.81 غ/مول |
| المظهر | غاز عديم اللون |
| الكثافة | 3.1 غ/ل (لا مائي) 1.64 غ/سم3 (ثنائي هيدرات) |
| نقطة الانصهار | −127.1 °س |
| نقطة الغليان | −100.4 °س |
| الذوبانية في الماء | يتفاعل بعنف |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
التحضير
حضر ثلاثي فلوريد البورون لأول مرة سنة 1808 من قبل لوي جوزيف غي لوساك ولوي جاك تينار، واللذان كانا يحاولان تحضير وعزل حمض الفلوريك (أي حمض الهيدروفلوريك) من تفاعل فلوريد الكالسيوم مع حمض البوريك المزجج، حيث كانت الغازات الناتجة غير قادرة على تنميش الزجاج، فأطلقوا اسم غاز الفلوبوريك عليها.[3][4]
يمكن أن يحضّر ثلاثي فلوريد البورون بعدة طرق، منها إجراء تفاعل بين ثلاثي أكسيد البورون مع حمض الهيدروفلوريك:
تقنياً، يحضّر المركب من تسخين أكسيد البورون أو البوراكس مع معدن الفلوريت بوجود حمض الكبريتيك المركز.[5] ينتج على المستوى الصناعي ما يتراوح بين 2300 إلى 4500 طن من ثلاثي فلوريد البورون سنوياً.[6]
أما مخبرياً، فيمكن التحضير من التفكك الحراري لرباعي فلورو بورات أملاح الديازونيوم.[7]
من طرق التحضير الأخرى، إجراء تفاعل بين رباعي فلوروبورات البوتاسيوم أو رباعي فلوروبورات الصوديوم مع أكسيد البورون:
يمكن أن يجري التفاعل بوجود حمض الكبريتيك المركز:[8]
كما يمكن التحضير من تفاعل حمض البوريك مع حمض فلورو الكبريتيك:[9]
الخواص
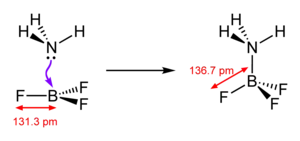
إن مركب ثلاثي فلوريد البورون عبارة عن غاز سام عديم اللون وأكّال، وتبلغ قيمة النقطة الحرجة له −12.3 °س. يعد BF3 من أحماض لويس القوية، ويقوم بتشكيل العديد من المعقّدات التناسقية.
يكون لثلاثي فلوريد البورون بنية جزيئية مستوية ثلاثية، ويكون للرابطة B-F طول مقداره 131.3 بيكومتر، والذي يزداد إلى 136.7 عند تشكيل معقدات تناسقية. تستخدم معقدات ثلاثي فلوريد البورون مع ثنائي إيثيل الإيثر (BF3 · O(Et)2) أو مع كبريتيد ثنائي الميثيل (BF3 · S(Me)2) من أجل الحصول على سائل كمصدر للمركب، مما يسهل التعامل معه في المختبر.
يتفاعل ثلاثي فلوريد البورون مع الماء بعنف، حيث يتفكك إلى حمض البوريك وحمض هيدروفلوروبوريك. على العكس من هاليدات البورون الأخرى، فإن BF3 لا يحدث له تفاعل حلمهة مباشر، إنما تحدث هناك سلسلة من عدة تفاعلات يتشكل فيها نواتج إضافة:
إن تفاعل الحلمهة يكون غير مكتملاً في حال وجود هاليدات أخرى للبورون، وذلك بسبب تشكل أيون رباعي فلوروبورات −BF4 رباعي السطوح الخامل.
كما أن نواتج تفاعل الحلمهة تتفاعل لاحقاً لتشكل حمض رباعي فلورو البوريك، والذي يوجد على شكل ملح أكسونيوم.
الاستخدامات
يستخدم ثلاثي فلوريد البورون ككاشف مهم في الاصطناع العضوي وذلك نظراً لخصائص حمض لويس، حيث يقوم بتحفيز تفاعلات البلمرة في مركبات بولي إيثر غير المشبعة.[6][10]
كما يستخدم المركب كحفاز في العديد من تفاعلات التماكب والألكلة والتكاثف، بالإضافة إلى تفاعل إضافة ألدول موكاياما.[11]
المراجع
- BORON TRIFLUORIDE (بالإنجليزية), QID:Q278487
- ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- Gay-Lussac, J. L.; Thénard, L. J. (1809). "Sur l'acide fluorique". Annales de Chimie. ج. 69: 204–220.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - Gay-Lussac, J. L.; Thénard, L. J. (1809). "Des propriétés de l'acide fluorique et sur-tout de son action sur le métal de la potasse". Mémoires de Physique et de Chimie de la Société d’Arcueil. ج. 2: 317–331. مؤرشف من الأصل في 2020-01-24.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN:0-12-352651-5.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - Brotherton, R. J.; Weber, C. J.; Guibert, C. R.; Little, J. L. (2005), "Boron Compounds", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a04_309
- Flood, D. T.(1933)."Fluorobenzene". Org. Synth.13: 46; Coll. Vol. 2: 295.
- Brauer، Georg (1963). Handbook of Preparative Inorganic Chemistry Vol. 1, 2nd Ed. Newyork: Academic Press. ص. 220 & 773. ISBN:978-0121266011. مؤرشف من الأصل في 2019-12-15.
- Georg Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry. 2nd edition. Band 1. Academic Press, New York NY u. a. 1963, S. 219–221.
- Heaney, H. (2001). "Boron Trifluoride". Encyclopedia of Reagents for Organic Synthesis. DOI:10.1002/047084289X.rb250. ISBN:0-471-93623-5.
- "Boron Trifluoride (BF3) Applications". Honeywell. مؤرشف من الأصل في 2013-09-08.
- بوابة الكيمياء