تيريباراتيد
التيريباراتايد أو فوريتو هو شكل مأشوب من الهرمون الدريقي. فعال في عمليات البناء داخل الجسم مثل نمو العظم [2] يستخدم في علاج بعض أنواع هشاشة العظام.[ [3] يستخدم بدون تصريح كمسرّع من عملية التئام الكسور، وهو مطابق لجزء من الهرمون الدريقي البشري (PTH) واستخدامه بشكل متقطع ينشط الخلايا البانية للعظم أكثر من الخلايا الناقضة للعظم، الأمر الذي يؤدي إلى زيادة عامة في الكثافة العظمية.
| تيريباراتيد | |
|---|---|
 | |
| يعالج | |
| اعتبارات علاجية | |
| اسم تجاري | Forteo |
| ASHPDrugs.com | أفرودة |
| فئة السلامة أثناء الحمل | C |
| طرق إعطاء الدواء | SubQ |
| بيانات دوائية | |
| توافر حيوي | 95% |
| استقلاب (أيض) الدواء | Hepatic (nonspecific proteolysis) |
| عمر النصف الحيوي | SubQ: 1 hour |
| إخراج (فسلجة) | Renal (metabolites) |
| معرّفات | |
| CAS | 52232-67-4 |
| ك ع ت | H05H05AA02 AA02 |
| بوب كيم | CID 16132393 |
| ECHA InfoCard ID | 100.168.733 |
| درغ بنك | DB06285 |
| كيم سبايدر | 17289052 |
| المكون الفريد | 10T9CSU89I |
| كيوتو | D06078 |
| ChEMBL | CHEMBL525610 |
| بيانات كيميائية | |
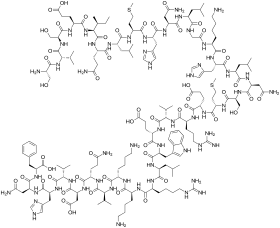
| الصيغة الكيميائية | C181H291N55O51S2 |
| الكتلة الجزيئية | 4117.72 g/mol |
الاستخدمات الطبية
مع هشاشة العظام عرضة لمخاطر عالية للكسر [2] أو الذين لديهم تاريخ من كسر هشاشة العظام، والمرضى مع أخطار الإصابة بالكسور أو لديهن تاريخ طبي في العائلة للإصابة بالهشاشة أو المرضى اللذين لم تفلح في علاجهم الادوية الأخرى ولم يتوقف مسلسل الكسور لديهم.[4] حصل على موافقة هيئة الغذاء والدواء FDA عام 2002م،[5] لديه فعالية كبيرة في نمو العظام حيث لديه القدرة على رفع الكثافة العظمية في العمود الفقري بنسبة 8% خلال سنة واحدة،[6] والحد من خطورة الإصابة بكسور الهشاشة.[5][7] أدوية هشاشة العظام هي آمنة عموما، ولكنها تشمل بعض الآثار الجانبية للteriparatide الصداع، والغثيان، والدوخة، وألم أطرافهم.[5]
في تجربة عشوائية على نساء في سن اليأس ممن كان لديهن كسر في الفقرات لمقارنة تأثير تيرباراتايد بجرعة 20أو 40 ميكروغرام لكل يوم مع غُفل (دواء وهمي= لا يحتوي على مادة فعالة) وبعد 19شهر فقد لوحظ زيادة كسور الفقرات بنسبة 14% عند النساء اللاتي أخذن الغُفل (دواء وهمي= لا يحتوي على مادة فعالة)، أما النساء اللاتي أخذن التيرباراتايد فإن نسبة زيادة الكسور كانت 5% على جرعة 20 ميكروغرام يوميا من التيرباراتايد وبنسبة 4% على جرعة 40 كيروغرام من التيرباراتايد. وهانك أيضا عدد كسور (غير فقرية) أقل بكثير عند المجموعة التي عولجت بالتيرباراتايد. لان 20 ميكروغرام منه يزيد من كثافة المعادن في عظام العمود الفقري والورك.[4]
كما ويستخدم لزيادة كتلة عظام الرجال اللذين يعانون من هشاشة العظام الناتجة عن قصور الغدد التناسلية hypogonadal osteoporosis)) أو لديهم الخطر للإصابة بكسور الهشاشة أو فشلت الادوية الأخرى أو غير مسموحة في علاجهم.
وكذلك لعلاج الرجال والنساء المصابين بهشاشة العظام المرتبطة بالعلاج الاستيرويدي النظامي المستدام (sustained systemic glucocorticoid therapy).
لا ينبغي ان يوصف للمرضى اللذين لديهم خطر الإصابة بسرطانات عظمية ومرض باجيت وارتفاعات غير مبررة في مستويات الفوسفات في الدم، والمشاشة المفتوحة (open epiphyses)، واللذين تعرضوا لعلاج اشعاعي مسبق.
الاستخدمات الأخرى
يستخدم التيرباراتايد كعلاج للتسريع إصلاح الكسر وعلاج حالات عدم الانجبار [8] وقد أفيد أن يكون قد استخدم بنجاح لعلاج حالات عدم الانجبار.[9] وبشكل عام من باب الخصوصية بسبب HIPAA، لم يتم نشر ذلك عندما استخدم من قبل الرياضيين الامريكان حيث يتلقي اللاعب هذا العلاج لتحسين التئام الكسر.[8] ولكن لاعب كرة القدم الإيطالي فرانشيسكو توتي اعطي تيرابيرايتاد بعد كسر عظمتي الظُنوب والشظية وقد لوحظ انه تعافى بشكل غير متوقع في الوقت المناسب لكأس العالم 2006 [8] ]وقد أفيد أن مارك مولدر استخدمه للتعافي من كسر الورك أوكلاند في التصفيات [MLB 2003] [10] وتيريل اوينز للتعافي من كسر في الكاحل قبل مباراة السوبر بول 2005 [10]
الآثار السلبية
سرطان العظم من اخطر الاثار الجانبية التي يسببها التيرباراتايد حيث اجريت دراسات على الجرذان واثبتت انه يسبب سرطانات في العظم ولم يثبت ذلك على الإنسان [2] ويعزى ذلك إلى اختلاف طبيعة نمو العظم في الكائنين فبخلاف الإنسان، تنمو عظام الجرذان طوال فترة حياتها.[2] حيث وجدت الدراسات بان الاورام تقع في نهاية العظام التي نمت بعد الحقن [11] وبعد تسع سنوات في السوق، سُجلت حالتين من الإصابة بسرطان العظم.[6] واعتبر هذا الخطر نادر للغاية من قبل FDA (1 في 100,000شخص) [5] وهذه النسبة ليست سوى أكثر قليلا من الإصابة في عدد السكان الذين أعمارهم أكثر من 60 سنة (0.4 في 100,000).[5]
الية العمل
هو جزء من الهرمون الدريقي البشري (PTH)، تسلسل الأحماض الأمينية من 1 إلى 34، من الجزيء الكامل (الذي يحتوي على 84 حمض اميني).PTH الداخلي هو المنظم الرئيسي لأيض الكالسيوم والفوسفات في العظام والكلى. الهرمون الدريقي يزيد الكالسيوم في الدم، ويتم ذلك جزئيا من خلال زيادة ارتشاف العظام. وبالتالي، ارتفاع PTH المزمن يستنفد مخازن العظام. ومع ذلك، فإن التعرض المتقطع للPTH ينشيط الخلايا البانية للعظم أكثر من الخلايا الآكلة. والأثر الصافي للحقن مرة واحدة يوميا من التيرباراتايد يحفز تكوين العظام مما يؤدي إلى زيادة كثافة المعادن في العظام.[12][13][14]
Teriparatide هو أول وكيل إدارة الاغذية والعقاقير المعتمدة لعلاج هشاشة العظام التي تحفز تكوين العظام الجديدة.[15]
موافقة إدارة الاغذية والعقاقير FDA
وتمت الموافقة من قبل إدارة الغذاء والدواء (FDA) في 26 تشرين الثاني 2002، لعلاج هشاشة العظام لدى الرجال والنساء بعد سن اليأس الذين هم في خطر كبير عن وجود كسر. تمت الموافقة على انه أيضا يؤدي إلى زيادة كتلة العظام في الرجال الذين يعانون من هشاشة العظام الأولية أو الناتجة عن قصور الغدد التناسلية الذين هم عرضة للكسر.
استخدام التيرباراتايد مع الدينوزوماب
وجد ان استخدام التيرباراتايد مع الدينوزوماب جنبا إلى جنب يزيد من كثافة العظم أكثر من استخدام كل دواء على حدة وقد وجد ان الجمع بين العلاجين أكثر فائدة لعلاج المرضى الأكثر عرضة لخطر الكسر.[ [16]
المراجع
- Drug Indications Extracted from FAERS، DOI:10.5281/ZENODO.1435999، QID:Q56863002
- Riek AE and Towler DA (2011). "The pharmacological management of osteoporosis". Missouri Medicine. ج. 108 ع. 2: 118–23. PMC:3597219. PMID:21568234. مؤرشف من الأصل في 2020-01-09.
- Saag KG، Shane E، Boonen S، وآخرون (نوفمبر 2007). "Teriparatide or alendronate in glucocorticoid-induced osteoporosis". The New England Journal of Medicine. ج. 357 ع. 20: 2028–39. DOI:10.1056/NEJMoa071408. PMID:18003959. مؤرشف من الأصل في 2019-12-15.
- Estébanez، P.؛ Sarasqueta، C.؛ Nájera، R.؛ Contreras، G.؛ Pérez، L.؛ Fitch، K.؛ Vicente، A. (1992). "Prevalence of HIV-1, HIV-2, and HTLV-I/II in Spanish seamen". Journal of acquired immune deficiency syndromes. ج. 5 ع. 3: 316–317. DOI:10.1097/00126334-199203000-00015. PMID:1346808.
- Rizzoli، R.؛ Reginster، J. Y.؛ Boonen، S.؛ Bréart، G. R.؛ Diez-Perez، A.؛ Felsenberg، D.؛ Kaufman، J. M.؛ Kanis، J. A.؛ Cooper، C. (2011). "Adverse Reactions and Drug–Drug Interactions in the Management of Women with Postmenopausal Osteoporosis". Calcified Tissue International. ج. 89 ع. 2: 91–104. DOI:10.1007/s00223-011-9499-8. PMC:3135835. PMID:21637997.
- Kawai، M.؛ Mödder، U. I.؛ Khosla، S.؛ Rosen، C. J. (2011). "Emerging therapeutic opportunities for skeletal restoration". Nature Reviews Drug Discovery. ج. 10 ع. 2: 141–156. DOI:10.1038/nrd3299. PMC:3135105. PMID:21283108.
- Murad، M. H.؛ Drake، M. T.؛ Mullan، R. J.؛ Mauck، K. F.؛ Stuart، L. M.؛ Lane، M. A.؛ Abu Elnour، N. O.؛ Erwin، P. J.؛ Hazem، A.؛ Puhan، M. A.؛ Li، T.؛ Montori، V. M. (2012). "Comparative Effectiveness of Drug Treatments to Prevent Fragility Fractures: A Systematic Review and Network Meta-Analysis". Journal of Clinical Endocrinology & Metabolism. ج. 97 ع. 6: 1871–1880. DOI:10.1210/jc.2011-3060. PMID:22466336.
- Bruce Jancin (12 ديسمبر 2011). "Accelerating Fracture Healing With Teriparatide". Internal Medicine News Digital Network. مؤرشف من الأصل في 2013-10-23. اطلع عليه بتاريخ 2013-09-20.
- Giannotti، S.؛ Bottai، V.؛ Dell’Osso، G.؛ Pini، E.؛ De Paola، G.؛ Bugelli، G.؛ Guido، G. (2013). "Current medical treatment strategies concerning fracture healing". Clinical cases in mineral and bone metabolism : the official journal of the Italian Society of Osteoporosis, Mineral Metabolism, and Skeletal Diseases. ج. 10 ع. 2: 116–120. PMC:3796998. PMID:24133528.
- William L. Carroll (2005). "Chapter 1: Defining the Issue". The Juice: The Real Story of Baseball's Drug Problems. ISBN:1-56663-668-X. مؤرشف من الأصل في 2019-12-15. اطلع عليه بتاريخ 2013-09-23.
- Forteo - FDA prescribing information, side effects and uses نسخة محفوظة 15 يونيو 2018 على موقع واي باك مشين.
- Bauer E, Aub JC, Albright F. Studies of calcium and phosphorus metabolism: V. Study of the bone trabeculae as a readily available reserve supply of calcium. J Exp Med. 1929;49:145-162.
- Selye H. On the stimulation of new bone formation with parathyroid extract and irradiated ergosterol. Endocrinology. 1932;16:547-558.
- Dempster، D. W.؛ Cosman، F.؛ Parisien، M.؛ Shen، V.؛ Lindsay، R. (1993). "Anabolic actions of parathyroid hormone on bone". Endocrine reviews. ج. 14 ع. 6: 690–709. DOI:10.1210/edrv-14-6-690. PMID:8119233.
- Fortéo: teriparatide (rDNA origin) injection نسخة محفوظة 03 مارس 2016 على موقع واي باك مشين.
- Joy N Tsai MD,Alexander V Uihlein MD,Hang Lee PhD,Ruchit Kumbhani BA,Erica Siwila-Sackman BA,Elizabeth A McKay BA,Sherri-Ann M Burnett-Bowie MD,Robert M Neer MD,Dr Benjamin Z Leder MD. Teriparatide and denosumab, alone or combined, in women with postmenopausal osteoporosis: the DATA study randomised trial. The Lancet - 15 May 2013 دُوِي:10.1016/S0140-6736(13)60856-9
وصلات خارجية
- بوابة الكيمياء
- بوابة الكيمياء الحيوية
- بوابة صيدلة
- بوابة طب