تكدس البروتين
تكدس البروتين أو تجمع البروتين أو تكتل البروتين هو ظاهرة حيوية تكمن في خطأ تكويني للبروتين ينتج عنه تكتل بمعنى تجمع لكتلات من البروتين وذلك يكون داخل أو خارج الخلايا[1][2] 2. تكتل هذه البروتينات ينتج عنه غالبا تاثير سميّ ضار أي ان تكتل هذه البروتينات قد يظهر في مجموعه كبيرة من الامراض معروفه باسم الداء النشواني ومنها امراض أخرى مثل التصلب الجانبي الضموري والزهايمر وباركنسون ومرض برايون 3[3][4]
مقدمة
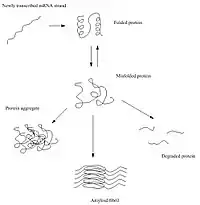
عند مراحل تصنيع البروتينات تحدث انطواءات تجعل البروتين المتكون مجسم ثلاثي الأبعاد ويصبح فعالا حيويا فقط عند تكونه بتلك الصيغة. مرحلة الانطواءات في عملية تكون البروتينات تحدث بسبب الخاصيه الطارده لجزيئات الماء. ان وجود اجزاء من البروتين جاذبه أو محبه واجزاء نافره أو طارده سبب لتكون البروتين في حالته الحيوية بحيث يصبح الجزء الخارجي للبروتين جاذب للماء والداخلي طارد للماء.
على كلا بعض الانطواءات الخاطئة قد تحدث في عملية تكون البروتين أو انطواءات خاطئه في بروتين مصنع مسبقا في حادثه مرتجله. في مثل هذه الحالات قد لاتتمكن الخلية في المساعدة لاعادة طي البروتين لتشكله الطبيعي أو لاتتمكن من تفكيك البروتين المعاب مسبقا فيبدأ بالتكتل داخلها.[5][6] في خلال هذه العملية فان الجزء ذو الخاصية النافره للماء في البروتين يصبح مكشوفا ويتفاعل مع اجزاء تنافريه من بروتينات معطوبه أخرى وبالتالي تتكتل تلك البروتينات مع بعضها
الأسباب
ان تكتل البروتينات قد تحدث لاسباب متعددة. بعض الاشخاص قد تكون لديهم طفرات جينية تجعلهم أكثر عرضه وقابليه لاخطاء في طي البروتينات خلال تكونه وتجعله قابل للتكتل. وفي المقابل خلل في عملية إعادة طي البروتين المعاب المعروفه ب (تشابرون) أو خلل في تفكك البروتين المعاب (اوبقيوتين بروتيسوم) قد يؤدي إلى تكتل في البروتينات. وكما يبدوا ان كثيرا من الامراض تكون مصاحبه لتكتل في البروتينات عند تقدم العمر بحيث تصبح الخلية اقل قدرة لتصفية البروتينات المعابه وبالتالي تتكتل. الجدير بالذكر ان هنالك عدة ابحاث جديده تفترض ان تكتل البروتينات عباره عن خطوه ثانيه من قبل الخلية كرد فعل لعدم وجود توازن في دورة البروتينات. بعيدا عن الضرر أو محض الصدفة [7] ، فقد كان هنالك بحث رائد [8] وقد اوضح ان تجمع البروتينات المتكتله بسبب اخطاء في طيها أو قابليتها العاليه للتكتل تحدث بعمليه منظمه من قبل الخلية وتوضع في اماكن معيينة لها وذلك يعتمد على جودة الاجزاء المتحكمة في اصلاح تلك الاعطاب ومنها ال اتش اس بي وكو تشابرون. وبالإضافة لذلك فقد تبين ان الخلايا حقيقة النوى لها القدرة على فرز البروتينات المعطوبه إلى مجموعتين منفصلتين بناء على جودة التحكم. 1- مجموعة التحكم في جودة الجكستا نيوكللير 2- مجموعة التحكم في وديعة البروتين الغير مذاب ان وجود مجموعتين منفصلتين يعود إلى سبب وجود طريقتين مختلفتين في التعامل والتفاعل مع مختلف أنواع البروتينات معطوبة الطي والمتكتله. ان النوع الثاني من مجموعة التحكم تعمل كمكان لتكتل نون اوبقينتن بروتين مثل هنتقتون بروتين. وفي ظل الظروف الصعبه مثل ارتفاع درجة الحرارة فان العمل الخلوي للتحكم بالجودة يصبح غير قادر لمجاراة العمل فيبدا الاوبقينتن بروتين بالتجمع في مجموعة التحكم الأولى وهي الجكستا نيوكللير وفي النهاية تبدا بالتفكك، وذلك يعني ان التكتل هو عمليه منظمه ومحكومه من قبل الخلية.
تكتل البروتين والتقدم في العمر
وبحسب إحدى النظريات فان تكتل البروتينات سبب من اسباب التقدم في العمر وقد تبدوا هذه النظرية قابله للتجارب بحكم وجود طرق لتاخير التقدم في العمر. وبالتالي فاذا كان الازدياد في تكتل البروتينات سبب غير مرتبط بتقدم العمر فان ابطاء عملية التقدم في العمر لن تنتج أي تغيير في نسبة الاضرار الجانبيه لتكتل البروتينات مع تقدم الوقت. وعلى كلا فان التقدم في العمر مرتبط بتراجع في نظام الحماية من اضرار التكتل البروتيني. لحل المشكله فقد وجدت طرق مختلفه لفحص السميه من تكتل البروتينات في سي اليقانس. ومن خلال هذه الابحاث فقد تبين ان التقليل من عمل أحد أهم المسارات التنظيميه ومنها الانسولين قروث فاكتور سجنلج 2س قد ينتج عنه حماية من الاضمحلال العصبي المصاحب لسمية البروتين المتكتل. ان مصداقية هذه الطريقة قد اثبتت علميا في فئة الثدييات عن طريق تقليل المسار التنظيمي في نشاط الانسولين قروث فاكتور-1 والذي نتج عنه حماية أكثر من مرض الزهايمر في الفئران من ناحية السلوكيه والكيمياء العضوية المصاحبة للخلل الموجود في المرض.[9]
السميّه
بالرغم من وجود فكرة مفادها ان تكتل البروتين الكامل التكون قد يكون سمي الا ان الابحاث الجديده قد بينت ان البروتينات الغير مكتمله ومتكتله تكون هيا الأكثر سميه[10][11] . ان الأجزاء الطارده للماء من هذي البروتينات المتكتله قد تكون سبب للتفاعل مع مكونات أخرى من الخلية وتحدث عطبا فيها. وفي أحد النظريات عن كيفية حدوث الضرر الخلوي من قبل البروتين المتكتل فيرجح إلى انها تحدث بسبب اضطراب في الجدار الخلوي. وانه من المعروف ان البروتين المتكتل في الانابيب المختبريه قادر على تفكك استقرارية الطبقة ثنائيه الدهون المصنعه والتي تكون مشابه لتلك الموجوده في الخلية الحيه وبالتالي يودي إلى زيادة التفكك في الجدار الخلوي.
انظر أيضًا
روابط خارجية
- http://www.kaganovichlab.com/research.html
مراجع
- Aguzzi، A.؛ O'Connor، T. (مارس 2010). "Protein aggregation diseases: pathogenicity and therapeutic perspectives". Nature Reviews Drug Discovery. ج. 9 ع. 3: 237–48. DOI:10.1038/nrd3050. PMID:20190788.
- Stefani، M.؛ Dobson، CM. (نوفمبر 2003). "Protein aggregation and aggregate toxicity: new insights into protein folding, misfolding diseases and biological evolution". J Mol Med (Berl). ج. 81 ع. 11: 678–99. DOI:10.1007/s00109-003-0464-5. PMID:12942175.
- De Felice، FG.؛ Vieira، MN.؛ Meirelles، MN.؛ Morozova-Roche، LA.؛ Dobson، CM.؛ Ferreira، ST. (يوليو 2004). "Formation of amyloid aggregates from human lysozyme and its disease-associated variants using hydrostatic pressure". FASEB J. ج. 18 ع. 10: 1099–101. DOI:10.1096/fj.03-1072fje. PMID:15155566.
- Tanzi، RE.؛ Bertram، L. (فبراير 2005). "Twenty years of the Alzheimer's disease amyloid hypothesis: a genetic perspective". Cell. ج. 120 ع. 4: 545–55. DOI:10.1016/j.cell.2005.02.008. PMID:15734686.
- Roberts، CJ. (ديسمبر 2007). "Non-native protein aggregation kinetics". Biotechnol Bioeng. ج. 98 ع. 5: 927–38. DOI:10.1002/bit.21627. PMID:17705294.
- Gething، MJ.؛ Sambrook، J. (يناير 1992). "Protein folding in the cell". Nature. ج. 355 ع. 6355: 33–45. DOI:10.1038/355033a0. PMID:1731198.
- "Cellular strategies for controlling protein aggregation" (بالإنجليزية). Archived from the original on 2020-03-08. Retrieved 2022-03-19.
- NCBI - WWW Error Blocked Diagnostic نسخة محفوظة 15 ديسمبر 2019 على موقع واي باك مشين.
- "The threshold for polyglutamine-expansion protein aggregation and cellular toxicity is dynamic and influenced by aging in Caenorhabditiselegans". PNAS. 2002. DOI:10.1073/pnas.152161099. مؤرشف من الأصل في 2018-12-05.
- Nilsberth، C.؛ Westlind-Danielsson، A.؛ Eckman، CB.؛ Condron، MM.؛ Axelman، K.؛ Forsell، C.؛ Stenh، C.؛ Luthman، J.؛ Teplow، DB.؛ وآخرون (سبتمبر 2001). "The 'Arctic' APP mutation (E693G) causes Alzheimer's disease by enhanced Abeta protofibril formation". Nat Neurosci. ج. 4 ع. 9: 887–93. DOI:10.1038/nn0901-887. PMID:11528419.
- Zhu، YJ.؛ Lin، H.؛ Lal، R. (يونيو 2000). "Fresh and nonfibrillar amyloid beta protein(1-40) induces rapid cellular degeneration in aged human fibroblasts: evidence for AbetaP-channel-mediated cellular toxicity". FASEB J. ج. 14 ع. 9: 1244–54. PMID:10834946.
- بوابة طب
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة الكيمياء الحيوية