تسمم بالأكسجين
ينجم التسمم بالأكسجين عن الآثار الضائرة لتنفس الأكسجين الجزيئي (O2) عند ضغوط جزئية مرتفعة. قد تؤدي الحالات الشديدة من التسمم إلى تلف الخلايا وموتها، مع تأثيرات تُلاحظ غالبًا في الجهاز العصبي المركزي والرئتين والعينين. تاريخيًا، عُرف تسمم الجهاز العصبي المركزي باسم تأثير بول بيرت، بينما سُمي التسمم الرئوي بتأثير لورين سميث، وذلك تيمنًا بأسماء الباحثين الذين قادوا الاكتشافات والكتابات الوصفية في أواخر القرن التاسع عشر. تمثل سمية الأكسجين مصدر قلق للغواصين تحت الماء، وأولئك المعالجين بتراكيز عالية من الأكسجين الإضافي (خاصة الأطفال الخدج)، والمعالجون بالأكسجين عالي الضغط.
| تسمم بالأكسجين | |
|---|---|
| تسميات أخرى | متلازمة التسمم بالأكسجين |
| معلومات عامة | |
| الاختصاص | طب الطوارئ |
| من أنواع | تسمم |
| التاريخ | |
| سُمي باسم | بول بيرت |
يؤدي تنفس الأوكسجين مرتفع الضغط الجزئي إلى فرط الأكسجة، أي زيادة الأكسجين في أنسجة الجسم. يتأثر الجسم بطرق مختلفة حسب نوع التعرض. تحدث سمية الجهاز العصبي المركزي بسبب التعرض قصير الأمد لضغوط جزئية عالية من الأكسجين عند قيم أعلى من الضغط الجوي. ينجم التسممان الرئوي والعيني عن التعرض فترةً أطول لمستويات الأكسجين المتزايدة عند قيم الضغط الطبيعي. قد تشمل أعراض التسمم كلًا من التخليط الذهني ومشكلات تنفسية وأخرى بصرية مثل قصر البصر. قد يؤدي التعرض الطويل لضغوط الأكسجين الجزئية المرتفعة عند الضغط الطبيعي، أو التعرض الأقصر لضغوط جزئية عالية جدًا، إلى حدوث أضرار تأكسدية في أغشية الخلايا، وانهيار الحويصلات الهوائية في الرئتين، وانفصال شبكية العين، والنوبات المرضية. يمكن تدبير التسمم بالأكسجين من طريق تقليل التعرض لمستويات الأكسجين المرتفعة. تشير الدراسات إلى إمكانية التعافي بصورة كاملة من معظم أنواع التسمم بالأوكسجين على المدى الطويل.
توجد بروتوكولات لتجنب آثار فرط الأكسجة في حالات استنشاق الأكسجين عند ضغوط جزئية أعلى من المعتاد، مثل الغوص تحت الماء باستخدام أسطوانات غازات التنفس المضغوطة، والعلاج بالأوكسجين عالي الضغط، ورعاية الأطفال حديثي الولادة، ورحلات البشر إلى الفضاء. أثمرت هذه البروتوكولات عبر خفض معدل حدوث النوبات المرضية بسبب التسمم بالأكسجين إلى حده الأدنى، مع اقتصار الضرر الرئوي والعيني بصورة أساسية على حالات رعاية الأطفال الخدج.
أصبح الأكسجين متاحًا للاستخدام الترفيهي في السنوات الأخيرة عبر ارتياد حانات الأكسجين. حذرت إدارة الغذاء والدواء الأمريكية أولئك الذين يعانون مشكلات قلبية أو رئوية من هذه الحانات. يستخدم الغواصون غازات التنفس التي تحتوي على أكسجين يصل تركيزه إلى 100%، على أن يُدربوا تدريبات خاصة لاستخدام هذه الغازات.
التصنيف
يمكن تصنيف التأثيرات السامة للأكسجين وفقًا للأعضاء المصابة، ما يعطي ثلاثة أنواع رئيسية: [2][3][4]
- الجهاز العصبي المركزي، الذي يحدث تسممه تحت ظروف الضغط العالي ويتظاهر بالتشنجات التي يتبعها فقدان الوعي.
- الرئتان، يتجلى تسممها بصعوبة التنفس وألم في الصدر، ويحدث عند التنفس مع زيادة ضغط الأكسجين لفترات طويلة.
- العين (حالات اعتلال الشبكية)، تتميز بتغيرات في العين والرؤية، تحدث عند التنفس مع زيادة ضغط الأكسجين لفترات طويلة.
قد يسبب تسمم الجهاز العصبي المركزي بالأكسجين نوبات مرضية، وصلابة تستمر فترات قصيرة، تليها تشنجات وفقدان للوعي؛ يمثل هذا الشكل من التسمم مصدر قلق للغواصين الذين يختبرون ضغوطًا أكبر من الضغط الجوي. يؤدي تسمم الرئتين بالأكسجين إلى تلفهما، ما يسبب ألمًا وصعوبة في التنفس. قد يؤدي الضرر التأكسدي في العين إلى قصر النظر أو انفصال الشبكية الجزئي. يشيع حدوث الإصابات الرئوية والعينية عند إعطاء الأكسجين الإضافي في سياق العلاج الطبي، خاصةً عند الرضع حديثي الولادة، لكنها قد تحدث أيضًا في أثناء العلاج بالأكسجين عالي الضغط.
قد يحدث الضرر التأكسدي في أي خلية في الجسم، لكن التأثيرات في الأعضاء الثلاثة الأكثر حساسية تمثل الشواغل الأساسية. قد يسبب التسمم بالأكسجين تلف خلايا الدم الحمراء (انحلال الدم)،[5][6] وإصابة في الكبد،[7] أو القلب،[8] أو الغدد الصماء (الغدد الكظرية، والغدد التناسلية، والغدة الدرقية)،[9][10][11] أو الكلى،[12] إضافةً إلى أضرار عامة في خلايا الجسم.[2][13]
في ظروف غير اعتيادية، يمكن ملاحظة تأثيرات الأكسجين السامة على الأنسجة الأخرى: يُشتبه في تسببه بحدوث تلف في العظام في أثناء رحلات الفضاء.[14] قد يسبب فرط الأكسجة أيضًا بصورة غير مباشرة تخدرًا نتيجة ارتفاع قيمة ثاني أكسيد الكربون عند مرضى الرئة، مثل مرضى داء الانسداد الرئوي المزمن أو المصابين بنقص التهوية بفعل تثبيط الجهاز التنفسي مركزيًا.[14] لا يسبب هواء الغلاف الجوي عند الضغط الجوي تسممًا بالأكسجين في حالات فرط التهوية، لأن ضغط الأكسجين الجزئي في الهواء على مستوى سطح البحر يبلغ 0.21 بار (21 كيلو باسكال) بينما يتطلب حدوث التسمم ضغطًا جزئيًا لا يقل عن 0.3 بار (30 كيلو باسكال).[15]
الأعراض والعلامات
| مدة التعرض (بالدقائق) | عدد الأفراد المتعرضين | الأعراض |
|---|---|---|
| 96 | 1 | انبهار متطاول، وإقياء شديد متقطع |
| 60–69 | 3 | نفضان شديد في الشفاه، وشمق، وغثيان ودوار، ونفضان في الذراع. |
| 50–55 | 4 | نفضان شديد في الشفاه، وانبهار، وتورم الشفاه، والنوم، والذهول. |
| 31–35 | 4 | غثيان ودوار ونفضان الشفاه وتشنجات. |
| 21–30 | 6 | تشنجات، ونعاس ونفضان شفاه شديد، وأورة شرسوفية، ونفضان الذراع الأيسر، وفقدان الذاكرة. |
| 16–20 | 8 | تشنجات، ودوار، ونفضان شفاه شديد، وأورة شرسوفية، وتنفس تشنجي. |
| 11–15 | 4 | سيطرة شهيقية، ونفضان شفاه، وغشي، وغثيان وتخليط. |
| 6–10 | 6 | ذهول ونفضان شفاه، وإحساس بالخدر، ودوار، وتشنج حجابي وغثيان شديد. |
يظهر تسمم الجهاز العصبي المركزي بالأوكسجين عبر أعراض متنوعة، مثل التغيرات البصرية (خاصة الرؤية النفقية)، وسماع رنين في الأذنين (طنين الأذن)، والغثيان، والنفضان (خاصة في الوجه)، والتغيرات السلوكية (التهيج، والقلق، والارتباك)، والدوخة. قد يتبع ذلك نوبة توترية رمعية تتكون من مرحلتين: تقلص شديد للعضلات يستمر عدة ثوان (طور توتري)، يليه تشنجات سريعة من ارتخاء العضلات وتقلصها بصورة متناوبة ما ينتج عنه ارتعاش اختلاجي (طور رمعي). تنتهي النوبة بفترة من اللاوعي (حالة ما بعد النوبة).[16] يعتمد بدء النوبة على الضغط الجزئي للأكسجين في غاز التنفس ومدة التعرض. على أي حال، لا يمكن التنبؤ بفترة التعرض قبل بدء النوبة، إذ أظهرت الاختبارات تباينًا كبيرًا، بين نتائج الأفراد أو بين نتائج الفرد الواحد من يوم لآخر.[16][19] إضافةً إلى ذلك، تقلل العديد من العوامل الخارجية، مثل الغمر تحت الماء، والتعرض للبرد، وممارسة الرياضة، الفترة التي تسبق ظهور أعراض الجهاز العصبي المركزي.[1] يرتبط نقص التحمل ارتباطًا وثيقًا باحتباس ثنائي أكسيد الكربون.[20][21][22] توجد عوامل أخرى، مثل الظلام والكافيين، تزيد من التحمل لدى الحيوانات التي جرى اختبارها، لكن دون إثبات تأثيرها في البشر.[23][24]
الرئتين
تنجم أعراض التسمم الرئوي بالأكسجين عن التهاب يبدأ في الشعب الهوائية المؤدية إلى الرئتين ثم ينتشر في الرئتين (الشجرة الرغامية القصبية). تظهر الأعراض في الجزء العلوي من الصدر (المناطق تحت القص وجؤجؤ القصبة الهوائية)،[25][26][27] وتبدأ بدغدغة خفيفة مع الشهيق وتتطور إلى سعال متكرر.[25] إذا استمر التنفس في ظل ضغط الأكسجين الجزئي المرتفع، يعاني المرضى حرقةً خفيفةً عند الاستنشاق مع سعال غير مضبوط عليه وضيق عرضي في التنفس (زلة تنفسية).[25] تضمنت الموجودات السريرية المتعلقة بالتسمم الرئوي أصوات فقاعات تُسمع بسماعة الطبيب (خرخرة فقاعية)، وحمى، وزيادة تدفق الدم إلى بطانة الأنف (فرط الدم في الغشاء المخاطي للأنف).[27] يظهر تصوير الرئتين بالأشعة السينية تغيرًا طفيفًا على المدى القصير، لكن التعرض الطويل يؤدي إلى زيادة انتشار الظلال الساحتين الرئويتين.[25] تنخفض قيم اختبارات وظائف الرئة، نتيجة نقص كمية الهواء التي يمكن أن تحتفظ بها الرئتان (السعة الحيوية) والتغيرات في وظيفة الزفير ومرونة الرئة.[27][28] أشارت الاختبارات التي أُجريت على الحيوانات إلى تباين في التحمل مشابه للتباين الملاحظ في حالات تسمم الجهاز العصبي المركزي، إضافةً إلى اختلافات كبيرة بين الأنواع. إن التعرض المتقطع للأكسجين عند تجاوزه 0.5 بار (50 كيلو باسكال) يسمح للرئتين بالتعافي ويؤخر ظهور أعراض التسمم.[29]
الأعين
يمكن ملاحظة علامات إصابة العين (اعتلال الشبكية عند الأطفال الخدج) في الأطفال الخدج، باستخدام منظار العين للتمييز بين المناطق ذات الانتشار الوعائي والمناطق غير الحاوية على الأوعية الدموية في شبكية الرضيع، ومن ثم تحديد أربع مراحل: (1) يوجد خط فاصل بين المناطق؛ (2) يأخذ الفاصل شكل سلسلة من المنحنيات؛ (3) يحدث نمو أوعية دموية جديدة حول المنحنيات. (4) تبدأ الشبكية بالانفصال عن الجدار الداخلي للعين (المشيمية).[30]
الأسباب
يحدث التسمم بالأكسجين بسبب التعرض له عند ضغوط جزئية أكبر من تلك التي يتعرض لها الجسم عادة، وذلك في ثلاث حالات رئيسية: الغوص تحت الماء، والعلاج بالأكسجين عالي الضغط، وتوفير الأكسجين الإضافي، خاصة للأطفال الخدج. تختلف عوامل الخطر اختلافًا ملحوظًا في كل حالة.
تسمم الجهاز العصبي المركزي
يحدث هذا النوع من التسمم بالأوكسجين عادةً عند التعرض لضغوط جزئية من الأكسجين أعلى من 1.6 بار (160 كيلو باسكال) -نحو ثمانية أضعاف الضغط الجزئي الجوي العادي– لفترة تتراوح من دقائق إلى بضع ساعات، تعرض يُرجح حدوثه بين المرضى المعالجين بالأكسجين عالي الضغط والغواصين. يحدث تسمم الجهاز العصبي المركزي فقط في ظروف الضغط العالي، حيث يكون الضغط المحيط أعلى من المعدل الطبيعي، وذلك لأن الضغط الجوي لمستوى سطح البحر يبلغ نحو 1 بار (100 كيلو باسكال).[31][32] يواجه الغواصون الذين يتنفسون الهواء عند أعماق تتجاوز 60 مترًا (200 قدم) خطرًا متزايدًا للإصابة بما يسمى «نوبة» تسمم بالأكسجين. قد يتعرض الغواصون الذين يتنفسون خليطًا غازيًا غنيًا بالأكسجين، مثل النيتروكس، لنوبة تسمم عند أعماق ضحلة نسبيًا، وذلك في حال نزولهم تحت عمق التشغيل الأقصى للخليط.[33]
تسمم الرئة
تتعرض الرئتان وبقية الجهاز التنفسي لأعلى تراكيز الأكسجين في جسم الإنسان، وعليه تكون أول الأعضاء التي تظهر أعراض التسمم. يحدث التسمم الرئوي فقط عند التعرض لضغوط جزئية من الأكسجين أكبر من 0.5 بار (50 كيلو باسكال)، أي ما يقابل التعرض لأكسجين نسبته 50% عند الضغط الجوي العادي. تبدأ العلامات المبكرة للتسمم الرئوي بآثار التهاب الرغامى والقصبات، أو التهاب الشعب الهوائية العليا، بعد فترة لا عرضية تستمر بين 4 و22 ساعة عند نسبة أكسجين تزيد عن 95%،[34] مع إشارة بعض الدراسات إلى بدء ظهور الأعراض بعد نحو 14 ساعة عند نسبة الأكسجين هذه.[35]
قد تبدأ هذه الأعراض في وقت أبكر، تحديدًا بعد 3 ساعات من التعرض للأكسجين في حال ارتفاع ضغطه الجزئي إلى 2-3 بار (200-300 كيلو باسكال) –أكسجين بنسبة 100% عند قيمة ضغط تعادل 2-3 أضعاف الضغط الجوي-.[34] عند إجراء تجارب على الفئران تضمنت تنفس الأكسجين عند ضغوط تتراوح بين 1 و3 بار (100 و300 كيلو باسكال)، تبين أن المظاهر الرئوية للتسمم بالأكسجين قد تختلف عند ظروف الضغط الطبيعي مقارنةً بحالات الضغط العالي.[36] ترصد اختبارات وظائف الرئة التدهور الرئوي خلال 24 ساعة من التعرض المستمر للأكسجين بنسبة 100%،[35] مع وجود دليل على حدوث تلف سنخي منتشر وبداية متلازمة الضائقة التنفسية الحادة التي تحدث عادةً بعد 48 ساعة من التعرض للأكسجين بنسبة 100%،[34] تعرض يؤدي في النهاية إلى انهيار الحويصلات الهوائية (انخماص الرئة)، بينما وجود ضغوط جزئية كبيرة من الغازات الخاملة، مثل النيتروجين عادةً، سيمنع حدوق مثل هذه التأثيرات الضارة عند ضغط الأكسجين الجزئي نفسه.[37]
من المعروف أن الأطفال الخدج أكثر عرضة للإصابة بخلل التنسج القصبي الرئوي عند التعرض طويل المدة لتراكيز عالية من الأكسجين.[38] يُذكر من المجموعات الأخرى الأكثر عرضة لخطر التسمم بالأكسجين كل من المرضى الموضوعين على التهوية الميكانيكية والمعرضين لمستويات أكسجين أعلى من 50%، والمرضى المعرضين لمواد كيميائية تزيد من خطر التسمم بالأكسجين مثل العلاج الكيميائي بالبليومايسين،[35] وعليه توصي الدلائل الإرشادية الحالية الخاصة بالمرضى الموضوعين على التهوية الميكانيكية في العناية المركزة بالحفاظ على تركيز الأكسجين تحت نسبة 60%.[34] وبالمثل، يزداد خطر التسمم بالأكسجين عند الغواصين الذين تلقوا علاج مرض تخفيف الضغط، علاج يتضمن تنفس الأكسجين تحت ظروف الضغط العالي، دون نسيان تعرضهم للأكسجين في أثناء الغوص.[31]
تسمم العين
يؤدي التعرض الطويل لنسب عالية من الأكسجين إلى تلف شبكية العين.[39][40][41] يختلف الضرر الذي يصيب العين النامية عند الرضع المعرضين لنسب عالية من الأكسجين تحت ظروف الضغط الطبيعي عن تلف العين الذي يتعرض له الغواصون البالغون تحت ظروف الضغط العالي،[42][43] اختلاف يظهر في ناحيتي الآلية والتأثير. قد يكون فرط الأكسجة عاملًا مشاركًا في حدوث التنسج الليفي خلف العدسة أو اعتلال الشبكية الخداجي (آر أو بّي) عند الرضع.[42][44] لا تكون الشبكية كاملة التوعية الدموية عند الخدج عادةً، ويحدث اعتلال الشبكية الخداجي عندما يتوقف نمو الأوعية الدموية في الشبكية ثم يُستأنف بصورة غير طبيعية، إذ يصاحب نمو هذه الأوعية الجديدة ظهور أنسجة ليفية (نسيج ندبي) قد تتقلص وتسبب بذلك انفصال الشبكية. لا يمثل التعرض للأكسجين الإضافي رغم خطورته عامل الخطر الرئيسي لتطور هذا المرض، ولا يؤدي تقييد استخدام الأكسجين الإضافي بالضرورة إلى تقليل معدل الإصابة باعتلال الشبكية الخداجي، بل قد يزيد خطر حدوث مضاعفات جهازية مرتبطة بنقص الأكسجة.[42]
حدث قصر النظر مفرط التأكسج عند الغواصين الذين يستخدمون أجهزة إعادة دفق الأكسجين ذات الدائرة المغلقة لفترات طويلة،[43][45][46] إضافةً إلى حدوثه المتكرر أيضًا عند المعالجين بالأكسجين عالي الضغط.[40][47] يرجع ذلك إلى زيادة القوة الانكسارية للعدسة، إذ إن نتائج قياس القرنية والطول المحوري لا تكشف عن سبب متعلق بالقرنية أو بطول المحور أدى إلى قصر النظر.[47][48] يُذكر أن هذا الضرر عادةً ما يكون قابلًا للعكس مع مرور الوقت.[40][47]
الآلية
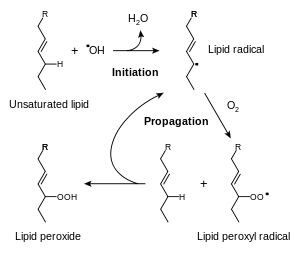
يتمثل الأساس الكيميائي الحيوي للتسمم بالأكسجين في إنقاص الأكسجين جزئيًا بواسطة إلكترون واحد أو إلكترونين ومن ثم تشكيل أنواع الأكسجين التفاعلي؛[49] منتجات ثانوية طبيعية لعملية استقلاب الأكسجين ذات أدوار مهمة في عملية تأشير الخلية.[50] قد يلعب الأنيون الفائق (O2−)، وهو أحد الأنواع التي ينتجها الجسم،[51] دورًا في عملية اكتساب الحديد.[52] تزداد مستويات أنواع الأكسجين التفاعلي عند ازدياد تراكيز الأكسجين فوق مستوياته الطبيعية.[53] يعد الأكسجين عنصرًا ضروريًا لعملية الاستقلاب الخلوي، علمًا أن الدم يوصله إلى جميع أجزاء الجسم. عند استنشاق الأكسجين ذي الضغوط الجزئية العالية، تنتشر حالة فرط التأكسج بسرعة، وتكون أنسجة الأوعية الدموية أكثر عرضة للخطر. قد تزداد مستويات أنواع الأكسجين التفاعلي ازديادًا كبيرًا في فترات الإجهاد الناجم عن أسباب محيطية، ما قد يؤدي بدوره إلى إتلاف الهياكل الخلوية والدخول بحالة الإجهاد التأكسدي.[19][54]
مع أن جميع آليات تفاعل هذه الأنواع داخل الجسم ليست مفهومة فهمًا تامًا بعد،[55] تُعد جذور الهيدروكسيل (OH·) إحدى أكثر المنتجات التفاعلية الناتجة عن الإجهاد التأكسدي شيوعًا، إذ تستطيع إطلاق تفاعل تسلسلي ضار من فوق أكسدة الدهون غير المشبعة داخل أغشية الخلايا.[56] تحفز التراكيز العالية من الأكسجين أيضًا تشكيل الجذور الحرة الأخرى، مثل أكسيد النيتريك والبيروكسينيتريت والتريوكسيدان، التي تضر جميعها الدنا والجزيئات الحيوية الأخرى.[19][57] يملك الجسم مجموعة من النظم المضادة للأكسدة مثل الجلوتاثيون، التي تقي الجسم من الإجهاد التأكسدي، لكنها تُهزم في النهاية بتأثير التراكيز العالية جدًا من الأكسجين الحر، إذ يتجاوز معدل تلف الخلايا قدرة النظم التي تمنعه أو تصلحه.[58][59][60] ينتج عن ذلك تلف الخلايا وموتها.[61]
التشخيص
يصعب تشخيص تسمم الجهاز العصبي المركزي بالأكسجين عند الغواصين قبل بداية النوبة، إذ إن أعراض الاضطرابات البصرية ومشكلات الأذن والدوخة والتخليط الذهني والغثيان قد تحدث نتيجة عدد من العوامل المشتركة في البيئة تحت الماء مثل التخدّر والاحتقان والبرودة. على أي حال، قد تفيد هذه الأعراض بتشخيص المراحل الأولى من التسمم بالأكسجين لدى المرضى المعالجين بالأكسجين عالي الضغط. في كلتا الحالتين، تشير النوبة التي تحدث في بيئة يُتنفس فيها الأكسجين عند ضغوط جزئية تزيد عن 1.4 بار (140 كيلو باسكال) إلى تشخيص التسمم بالأكسجين، إن لم يوجد تاريخ سابق للإصابة بالصرع أو رصد نقص سكر الدم في الفحوصات.[62]
يصعب تشخيص خلل التنسج القصبي الرئوي عند الأطفال حديثي الولادة الذين يعانون صعوبات تنفسية في الأسابيع القليلة الأولى. على أي حال، عدم تحسن تنفس الرضيع خلال هذا الوقت يدعو إلى اللجوء لاختبارات الدم والأشعة السينية لتأكيد تشخيص خلل التنسج القصبي الرئوي. إضافةً إلى ذلك، قد يساعد تصوير القلب بالأمواج فوق الصوتية على استبعاد الأسباب المحتملة الأخرى مثل عيوب القلب الخلقية أو ارتفاع ضغط الدم الشرياني الرئوي.[63]
عادة ما يُقترح تشخيص اعتلال الشبكية الخداجي عند الرضع حسب التقييم السريري، ومن أبرز المؤشرات الموجهة نحو التشخيص يُذكر الخداج، وانخفاض الوزن عند الولادة، وقصة تعرض للأكسجين، في حين لم تُرصد أي عوامل وراثية مرتبطة بهذه الحالة.[64]
الوقاية

تعتمد الوقاية من التسمم بالأكسجين كليًا على المكان؛ تؤمن الاحتياطات المناسبة الوقاية من أكثر الآثار ضررًا تحت الماء وفي الفضاء على حد سواء. يحتاج الخدج عادةً إلى أكسجين إضافي لعلاج مضاعفات الولادة المبكرة، ويجب هنا تطبيق إجراءات الوقاية من خلل التنسج القصبي الرئوي واعتلال الشبكية الخداجي دون الإخلال بإمداد الأكسجين الكافي للحفاظ على حياة الرضيع.
تحت الماء
تمثل سمية الأكسجين خطرًا كبيرًا عند الغوص، لأن نوبة التسمم تؤدي إلى الموت غرقًا بصورة شبه مؤكدة.[33] قد تحدث النوبة فجأة دون أعراض تحذيرية، وتشمل تأثيراتها تشنجات مفاجئة وحالة فقدان للوعي، قد يخسر خلالها الغواص المصاب منظم الغوص الخاص به ومن ثم يحدث الغرق.[65][66] يفيد قناع الغوص الذي يغطي كامل الوجه في منع فقدان المنظم إن حدثت النوبة. نظرًا إلى ازدياد خطر تسمم الجهاز العصبي المركزي بالأكسجين في أثناء الغوص العميق أو طويل المدة أو عند استخدام غازات التنفس الغنية بالأكسجين، يُعلَّم الغواصون كيفية حساب عمق التشغيل الأقصى لغازات التنفس الغنية بالأكسجين، دون نسيان أهمية كتابة هذا العمق على الأسطوانات التي تحويها بوضوح.[22][67]
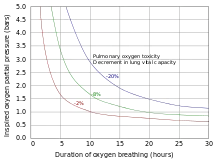
في بعض الدورات التدريبية الخاصة بأنواع الغوص هذه، يتعلم الغواصون تخطيط ساعة أكسجين الغوص ومراقبتها،[67] إذ تمثل الساعة منبهًا نظريًا، وتدق بسرعة أكبر عند زيادة ضغط الأكسجين وتُضبط لتتفعل عند الحد الأقصى للتعرض الفردي الموصى به في دليل الغوص التابع للإدارة الوطنية للمحيطات والغلاف الجوي.[22][67] بالنسبة إلى ضغوط الأكسجين الجزئية التالية، فإن حدود التعرض القصوى هي: 45 دقيقة عند 1.6 بار (160 كيلو باسكال)، و120 دقيقة عند 1.5 بار (150 كيلو باسكال)، و150 دقيقة عند 1.4 بار (140 كيلو باسكال)، و180 دقيقة عند 1.3 بار (130 كيلو باسكال) و210 دقيقة عند 1.2 بار (120 كيلو باسكال)، لكن مع استحالة التنبؤ الدقيق الموثوق بظهور أعراض التسمم من عدمها.[68][69] تتميز العديد من أجهزة كمبيوتر الغوص الحساسة للنيتروكس بقدرتها على حساب تحميل الأكسجين وتتبعه عبر عدة غطسات، بهدف تجنب تنشيط الإنذار، وذلك عبر تقليل الضغط الجزئي للأكسجين في غاز التنفس أو تقليل الوقت المستغرق في تنفس الغاز ذي ضغط الأكسجين الجزئي المرتفع. مع زيادة كل من الضغط الجزئي للأكسجين ونسبة الأكسجين في غاز التنفس وعمق الغوص، يحصل الغواص على وقت أطول على ساعة الأكسجين إما عبر الغوص في عمق أكثر ضحالة، أو عبر استنشاق غاز غني بالأكسجين، أو تقصير مدة التعرض للغازات الغنية بالأكسجين.[70][71]
قد يؤدي الغوص إلى عمق أخفض من 56 مترًا (184 قدمًا) على الهواء إلى ازدياد خطر تعرض الغواص للتسمم بالأكسجين، حيث يتجاوز الضغط الجزئي للأكسجين 1.4 بار (140 كيلو باسكال)، لذلك يجب استخدام خليط غازي يحتوي الأكسجين بنسبة أقل من 21% (خليط ناقص التأكسج). إن زيادة نسبة النيتروجين خيار غير قابل للتنفيذ، لأن الخليط الناتج يكون مخدرًا بشدة. على أي حال، لا يملك الهليوم تأثيرًا مخدرًا، ويمكن الحصول على خليط قابل للاستخدام إما عبر استبدال الهيليوم بالنتروجين كليًا (يسمى المزيج الناتج الهليوكس)، أو عبر استبداله جزئيًا، لنحصل بذلك على ما يسمى التريمكس.[72]
يمكن تجنب التسمم الرئوي بالأكسجين تجنبًا كاملًا في أثناء الغوص، فمدة الغوص المحدودة وطبيعته المتقطعة تجعل التسمم الرئوي من المضاعفات النادرة نسبيًا (والقابلة للعكس إن حدثت) عند الغواصين.[73] يستطيع الغواصون اعتمادًا على الإرشادات الموضوعة تقدير الوقت الذي يصبحون فيه عرضةً لخطر التسمم الرئوي.[74][75][76]
البيئات عالية الضغط
تمثل الإصابة بالحمى أو الإصابة سابقًا بالنوبات مضادات استطباب نسبية للعلاج بالأكسجين عالي الضغط.[77] تتضمن الجداول الزمنية المستخدمة لعلاج مرض تخفيف الضغط فترات يتنفس فيها الشخص الهواء الطبيعي بدلًا من الأكسجين بنسبة 100% (استراحة من الأكسجين) لتقليل فرصة حدوث النوب أو تلف الرئة. تستخدم البحرية الأمريكية جداول علاجية بناءً على فترات متناوبة من تنفس الهواء وتنفس الأكسجين بنسبة 100%. فمثلًا يتضمن الجدول السادس من جداول البحرية الأمريكية 75 دقيقة (ثلاث فترات من 20 دقيقة أكسجين / 5 دقائق هواء) عند ضغط محيطي يبلغ 2.8 جو معياري (280 كيلو باسكال)، أي ما يعادل عمق 18 مترًا (60 قدمًا). يتبع ذلك انخفاض بطيء في الضغط ليصل إلى 1.9 جو معياري (190 كيلو باسكال) خلال 30 دقيقة من تنفس الأكسجين، إذ يظل المريض عند هذا الضغط مدة 150 دقيقة أخرى، تتكون من فترتين كل منهما تتألف من 15 دقيقة هواء / 60 دقيقة أكسجين، قبل أن ينخفض الضغط إلى ضغط الغلاف الجوي بعد 30 دقيقة من تنفس الأكسجين.
اقتُرح كل من الفيتامين إي والسيلينيوم بمثابة وسيلتين محتملتين للوقاية من سمية الأكسجين الرئوية، لكنهما رُفضا لاحقًا.[79][80][81] على أي حال، توجد بعض الأدلة التجريبية في الفئران على فائدتهما في منع عملية فوق أكسدة الدهون في الجسم الحي وإتلاف الجذور الحرة، ومن ثم منع التغيرات المرضية في شبكية العين بعد التعرض المتكرر للأكسجين عالي الضغط.[82]
البيئات نظامية الضغط
يمكن عكس أضرار خلل التنسج القصبي الرئوي في مراحله المبكرة عبر استخدام فترات راحة تتضمن ضغوطًا أخفض من الأكسجين، لكنه قد يؤدي في النهاية إلى إصابة رئوية دائمة إذا تطور إلى مرحلة الضرر الشديد، علمًا أن المريض لا يدخل هذه المرحلة إلا بعد يوم أو يومين من التعرض للأكسجين دون فواصل.[14]
يمكن الوقاية بنسبة كبيرة من اعتلال الشبكية الخداجي من طريق الفحوصات الطبية. تنص الإرشادات الحالية على فحص جميع الأطفال الذين تقل أعمارهم عن 32 أسبوعًا أو الذين يقل وزنهم عند الولادة عن 1.5 كغ (3.3 رطل) للكشف عن اعتلال الشبكية الخداجي كل أسبوعين على الأقل.[83] أظهرت الدراسة التعاونية الوطنية في عام 1954 وجود علاقة سببية بين إعطاء الأكسجين الإضافي واعتلال الشبكية الخداجي، علمًا أن الانخفاض اللاحق للأكسجين الإضافي تسبب في ارتفاع معدل وفيات الرضع، لذلك تتطلب البروتوكولات الحديثة حاليًا مراقبة مستويات الأكسجين في الدم عند الخدج الذين يتلقون الأكسجين لتحقيق التوازن بين مخاطر نقص الأكسجة واعتلال الشبكية الخداجي.[84]
البيئات منخفضة الضغط
يمكن تجنب التسمم بالأكسجين في مثل هذه البيئات، لأن السمية ناتجة عن ارتفاع الضغط الجزئي للأكسجين، وليس بسبب ارتفاع نسبة الأكسجين فقط. يتضح هذا عبر استخدام الأكسجين النقي حديثًا في بدلات الفضاء، التي يجب أن تعمل عند ضغط منخفض (تاريخيًا، استُخدم الأكسجين بنسب عالية جدًا في ظل ضغوط أخفض من الضغط الجوي الطبيعي في المركبات الفضائية الأولى، مثل مركبتي الفضاء جمناي وأبولو).[85] في تطبيقات أخرى مثل النشاط خارج المركبة، يكون الأكسجين عالي النسبة غير سام، حتى عند تنفس الخليط الذي تقترب نسبة أكسجينه من 100%، بسبب عدم السماح بتجاوز الضغط الجزئي للأكسجين قيمة 0.3 بار (4.4 رطل / بوصة مربعة) بصورة مزمنة.[85]
التدبير
يتضمن العلاج بالأكسجين عالي الضغط عادةً تنفس المريض الأكسجين بنسبة 100% عبر قناع في أثناء وجوده داخل غرفة عالية الضغط مضغوطة بالهواء حتى نحو 2.8 بار (280 كيلو باسكال). تُعالج النوبات الحاصلة في أثناء العلاج عبر إزالة القناع عن المريض، وبالتالي خفض الضغط الجزئي للأكسجين المُستنشق إلى أقل من 0.6 بار (60 كيلو باسكال).
تتطلب نوبة التسمم الحاصلة تحت الماء رفع الغواص إلى السطح في أقرب وقت ممكن. مع أن التوصيات العلاجية نصت على تجنب رفع الغواص في أثناء النوبة لسنوات عديدة، بسبب خطر حدوث الانصمام الغازي الشرياني، تنوه بعض الأدلة بأن المزمار لا يعيق مجرى الهواء إعاقة تامة،[87] ما دفع لجنة الغوص التابعة لجمعية الطب تحت سطح البحر والضغط العالي إلى التوصية حاليًا بضرورة رفع الغواص خلال مرحلة النوبة الرمعية (التشنجية) إذا لم يكن المنظم في فمه -إذ إن خطر الغرق يكون أكبر عندها من خطر الإصابة بالانصمام الغازي الشرياني- على أن يتأخر الصعود حتى نهاية المرحلة الرمعية بخلاف ذلك.[65] يضمن رجال الإنقاذ الحفاظ على سلامتهم الشخصية في أثناء المرحلة التشنجية، ثم يتأكدون من توفر إمدادات الهواء للضحية، والحفاظ عليها، ثم ينفذون رفعًا مضبوطًا يحقق الطفو. تُعلِم معظم وكالات تدريب الغواصين كيفية رفع جسم شخص غير واعي. يجري دائمًا الاتصال بخدمات الطوارئ عند الوصول إلى السطح، نظرًا إلى احتمال حدوث مضاعفات إضافية تتطلب عناية طبية.[88] وضعت البحرية الأمريكية إجراءات لاستكمال مواقف تخفيف الضغط في أثناء الصعود حيث لا تتوفر حجرات إعادة الضغط على الفور.
تُعالج أعراض خلل التنسج القصبي الرئوي أو متلازمة الضائقة التنفسية الحادة من طريق خفض نسبة الأكسجين المعطى، إلى جانب تقليل فترات التعرض وزيادة فترات الراحة التي يُوفر الهواء الطبيعي خلالها. قد يلجأ الأطباء إلى جهاز التنفس الاصطناعي لضمان بقاء أنسجة الرئة منتفخة عند الحاجة إلى استخدام الأكسجين الإضافي لعلاج مرض آخر (خاصة عند الرضع). سيُخفض الضغط ودرجة التعرض بصورة تدريجية، مع إمكانية استخدام الأدوية مثل الموسعات القصبية والفاعلات بالسطح الرئوي.[90]
قد يتراجع اعتلال الشبكية الخداجي تلقائيًا، لكن تفاقم المرض إلى ما بعد عتبة معينة (التي تُعرّف بمرور خمس ساعات مستمرة أو ثماني ساعات إجمالية من المرحلة الثالثة من اعتلال الشبكية الخداجي)، يستدعي اللجوء إلى الجراحة البردية أو الجراحة بالليزر اللتان ثبتت فائدتهما في تقليل خطر الإصابة بالعمى كنتيجة نهائية للمرض. عند تفاقم المرض أكثر من ذلك، قد تساعد تقنيات مثل عملية بجع الصلبة وجراحة استئصال الزجاجية على إعادة ربط الشبكية المنفصلة.[91]
الإنذار
مع أن التشنجات التي يسببها تسمم الجهاز العصبي المركزي بالأكسجين قد تؤدي إلى إصابة عرضية للضحية، ظل حدوث تلف في الجهاز العصبي بعد النوبة أمرًا غير مؤكد لسنوات عديدة، وبحثت العديد من الدراسات عن أدلة على هذا الضرر. خلصت مراجعة لهذه الدراسات أجراها بترمان في عام 2004 إلى عدم استمرار أي ضرر عصبي على المدى الطويل بعد إيقاف التعرض لغاز التنفس الذي يحتوي نسبًا عالية من الأكسجين.[19][92]
سيستعيد غالبية الأطفال الذين نجوا من الإصابة بخلل التنسج القصبي الرئوي وظائف الرئة بصورة شبه طبيعية، إذ تستمر الرئتان بالنمو خلال أول 5-7 سنوات من العمر، ويكون الضرر الناجم عن خلل التنسج القصبي الرئوي قابلًا للعكس إلى حد ما (حتى عند البالغين)، ومع ذلك، يُرجح أن يكونوا أكثر عرضةً للإصابة بالتهابات الجهاز التنفسي لبقية حياتهم، وغالبًا ما تكون شدة العدوى اللاحقة أكبر من تلك التي يعانيها أقرانهم.[93][94]
غالبًا ما يتراجع اعتلال الشبكية الخداجي عند الرضع دون تدخل علاجي وقد يغدو البصر طبيعيًا في السنوات اللاحقة. عند تقدم المرض إلى المراحل التي تتطلب حلًا جراحيًا، تكون النتائج جيدة عموًما عند علاج المرحلة 3 من اعتلال الشبكية الخداجي، لكنها أسوأ بكثير في المراحل اللاحقة. تنجح الجراحة عادةً في تصحيح الاضطرابات التشريحية في العين، إلا أن تلف الجهاز العصبي الحاصل مع تطور المرض يؤدي إلى نتائج أضعف نسبيًا في تصحيح الرؤية. يقلل وجود أمراض أخرى معقدة من احتمالية الحصول على نتيجة إيجابية.[95]
علم الأوبئة

انخفض معدل حدوث تسمم الجهاز العصبي المركزي بين الغواصين منذ الحرب العالمية الثانية، إذ جرى تطوير البروتوكولات للحد من زمن التعرض والضغط الجزئي للأكسجين المستنشق. أوصى دونالد في عام 1947 بتحديد العمق الذي يسمح فيه استنشاق الأكسجين النقي عند 7.6 متر (25 قدمًا)، أي ما يعادل ضغطًا جزئيًا للأكسجين يبلغ 1.8 بار (180 كيلو باسكال).[97] جرى تقليل هذا الحد بمرور الوقت، إذ يوصى اليوم عمومًا بحد يعادل 1.4 بار (140 كيلو باسكال) في أثناء الغوص الترفيهي و1.6 بار (160 كيلو باسكال) في مواقف تخفيف الضغط الضحلة.[98] أصبح التسمم بالأكسجين حاليًا أمرًا نادر الحدوث إلا في حالات عطل المعدات أو الخطأ البشري. طورت البحرية الأمريكية عبر تاريخها جداول كتيباتها اليدوية للغوص لتقليل حوادث التسمم بالأكسجين. بين عامي 1995 و1999، رصدت التقارير 405 حالات غطس سطحي وفق جداول هيليوم-أكسجين؛ لوحظت أعراض التسمم بالأكسجين في 6 حالات (1.5%). نتيجة لذلك، عدلت البحرية الأمريكية في عام 2000 الجداول الزمنية وأجرت اختبارات ميدانية لما يعادل 150 حالة غوص، دون أن ينتج عن أي منها أعراض تسمم بالأكسجين. نُشرت جداول منقحة في عام 2001.[99]
أدى التباين في التحمل والعوامل المتغيرة الأخرى مثل عبء العمل إلى تخلي البحرية الأمريكية عن فحص تحمل الأكسجين. لوحظت 6 نوبات تسمم بالأكسجين فقط (0.1%) من بين 6250 اختبار تحمل الأكسجين تم إجراؤها بين عامي 1976 و1997.[100][101]
إن تسمم الجهاز العصبي المركزي بالأكسجين عند المرضى المعالجين بالأكسجين عالي الضغط أمر نادر الحدوث، ويتأثر بعدد من العوامل: الحساسية الفردية والبروتوكول العلاجي، وربما الاستطباب العلاجي والمعدات المستخدمة. أشارت دراسة أجراها ويلسلاو في عام 1996 إلى حدوث 16 حالة تسمم من أصل 107,264 مريضًا (0.015%)، بينما رصد هامبسون وأتيك في عام 2003 معدل تسمم استقر عند 0.03%.[102][103] أبلغ كل من يلدز وآي وقريددي، في ملخص لما يعادل 36,500 حالة علاج بين عامي 1996 و2003، عن ثلاث حوادث تسمم بالأكسجين فقط، ليبلغ معدل حدوث التسمم 0.008%.[102] كشفت مراجعة لاحقة لأكثر من 80,000 حالة علاج عن معدل أقل، بلغ 0.0024%. قد يرجع الانخفاض في معدل الإصابة جزئيًا إلى استخدام قناع (بدلًا من استخدام الحجيرة) لإيصال الأكسجين.[104]
يعد خلل التنسج القصبي الرئوي من أكثر المضاعفات شيوعًا عند الخدج، وقد زاد معدل حدوثه بالتزامن مع زيادة معدل البقيا لدى الأطفال شديدي الخداجة. على أي حال، انخفضت حدة المرض نتيجة إدارة تطبيق الأكسجين الإضافي، حتى أصبح المرض اليوم مرتبطًا بعوامل رئيسية أخرى أهم من فرط الأكسجة.[38]
في عام 1997، أظهر ملخص لدراسات تناولت الأطفال حديثي الولادة في وحدات العناية المركزة في البلدان الصناعية أن ما يصل إلى 60% من الأطفال منخفضي الوزن عند الولادة أصيبوا باعتلال الشبكية الخداجي، مع ارتفاع هذه النسبة إلى 72% عند الأطفال منخفضي الوزن بشدة عند الولادة؛ وزنهم أقل من 1 كغ (2.2 رطل) عند الولادة. على أي حال، فإن حدوث التبعات الشديدة أقل تواترًا: وُجد أن معدل الإصابة بالعمى لا يزيد عن 8% لدى الأطفال ذوي الوزن المنخفض جدًا عند الولادة -الذين يقل وزنهم عن 1.5 كغ (3.3 رطل) عند الولادة-.[96]
نبذة تاريخية
وصف بول بيرت تسمم الجهاز العصبي المركزي لأول مرة في عام 1878،[105][106] إذ بيّن سمية الأكسجين عند الحشرات، والعنكبيات، وكثيرات الأرجل، والرخويات، وديدان الأرض، والفطريات، والبذور النابتة، والطيور، والحيوانات الأخرى. يشار إلى تسمم الجهاز العصبي المركزي أحيانًا باسم «تأثير بول بيرت».[14]
وصف جيه. لورين سميث التسمم الرئوي بالأكسجين لأول مرة في عام 1899 عندما لاحظ سمية الجهاز العصبي المركزي واكتشف بالتجارب التي أجريت على الفئران والطيور أن ضغط الأكسجين البالغ 0.43 بار (43 كيلو باسكال) لا يحمل أي تأثير، بينما ارتفاعه إلى 0.75 بار (75 كيلو باسكال) يؤدي إلى تهيج رئوي.[29] يمكن الإشارة إلى التسمم الرئوي باسم «تأثير لورين سميث».[14] سُجل أول تعرض بشري في عام 1910 باسم بورنشتاين عندما تنفس رجلان الأكسجين عند 2.8 بار (280 كيلو باسكال) مدة 30 دقيقة بينما استمر بورنشتاين مدة 48 دقيقة دون ظهور أعراض. أصيب بورنشتاين في عام 1912 بتشنجات في يديه ورجليه عندما تنفس الأكسجين عند 2.8 بار (280 كيلو باسكال) مدة 51 دقيقة.[3] ثم مضى سميث ليوضح أن التعرض المتقطع لغاز التنفس مع نسبة أقل من الأكسجين سمح للرئتين بالتعافي وتأخير ظهور السمية الرئوية.[29]
كان ألبرت آر. بينكه وآخرون في عام 1935 أول من لاحظ تقلص المجال البصري (الرؤية النفقية) عند الغوص مع ضغوط تراوحت بين 1.0 بار (100 كيلو باسكال) و4.1 بار (410 كيلو باسكال).[107][108] أجرى دونالد وياربرو وآخرون خلال الحرب العالمية الثانية أكثر من 2000 تجربة حول سمية الأكسجين لدعم الاستخدام الأولي لأجهزة إعادة دفق الأكسجين ذات الدائرة المغلقة.[39][109] نشر غواصو البحرية في السنوات الأولى من الغوص باستخدام هذه الأجهزة أسطورة وحش يُدعى «بيت الأكسجيني»، كان يتربص في قاع وحدة الغوص التجريبية «الوعاء المبلل» التابعة للأميرالية (حجرة عالية الضغط مملوءة بالماء) للقبض على الغواصين غير الحذرين. وصفوا التعرض لهجوم التسمم بالأكسجين بأنه «التعرض لبيت».[110][111]
في العقد الذي أعقب الحرب العالمية الثانية، اكتشف لامبرتسن وآخرون المزيد حول تأثيرات تنفس الأكسجين تحت الضغط وطرق الوقاية.[112][113] إن أعمالهم حول التعرض المتقطع بهدف زيادة تحمل الأكسجين، وبناء نموذج للتنبؤ بسمية الأكسجين الرئوي استنادًا إلى الوظيفة الرئوية تمثل جميعها وثائق أساسية في عملية تطوير إجراءات التشغيل القياسية عند تنفس الأكسجين بضغوط متزايدة.[114] أظهر عمل لامبرتسن تأثير ثاني أكسيد الكربون في إنقاص الفترة التي تسبق ظهور أعراض الجهاز العصبي المركزي وقد أثر في الجهود الحالية بدءًا من إرشادات التعرض الحالية وصولًا إلى تصميم جهاز التنفس المستقبلي.[21][22][115]
لم يلاحظ اعتلال الشبكية الخداجي قبل الحرب العالمية الثانية، لكن توافر الأكسجين الإضافي في العقد التالي جعله أحد الأسباب الرئيسية لعمى الرضع في البلدان المتقدمة. صُنف استخدام الأكسجين بحلول عام 1960 بمثابة عامل خطر ومن ثم فُرضت القيود على استخدامه، قيود خفضت معدل الإصابات باعتلال الشبكية الخداجي لكنها رفعت معدل وفيات الرضع والمضاعفات المرتبطة بنقص الأكسجة. منذ ذلك الحين، وضعت نظم المراقبة والتشخيص الأكثر تطورًا بروتوكولات لاستخدام الأكسجين تهدف إلى تحقيق التوازن بين حالات نقص الأكسجين ومشكلات اعتلال الشبكية الخداجي.[96]
وصف نورثوي خلل التنسج القصبي الرئوي لأول مرة في عام 1967، حيث حدد الشروط التي تقود إلى التشخيص.[116] توسع بانكالاري في هذه الحالة لاحقًا ومن بعده شينان في عام 1988، الذي اقترح أن الحاجة إلى أكسجين إضافي في الأسبوع 36 قد تتنبأ بالنتائج طويلة المدى.[117] على أي حال، خلص بالتا وآخرون في عام 1998 إلى أن الأدلة الشعاعية مثلت أدق وسيلة للتنبؤ بالآثار طويلة المدى.[118]
أظهر بترمان وآخرون في عامي 1986 و1995 أن الظلام والكافيين يؤخران بدء التغيرات في النشاط الكهربائي للدماغ في الفئران.[23][24] سلطت أبحاث تسمم الجهاز العصبي المركزي في السنوات التالية الضوء على طرق الوقاية وتعزيز التحمل بصورة آمنة.[119] تبين أن الحساسية تجاه تسمم الجهاز العصبي المركزي بالأكسجين تتأثر بعوامل مثل النظم اليوماوي والأدوية والعمر والجنس.[120][121][122][123] كتب هاملتون وآخرون في عام 1988 إجراءات للإدارة الوطنية للمحيطات والغلاف الجوي لوضع حدود التعرض للأكسجين في سياق العمليات ضمن الموائل تحت الماء.[74][75][76] حتى اليوم، لا تفسر نماذج التنبؤ بسمية الأكسجين الرئوي جميع نتائج التعرض لضغوط جزئية عالية من الأكسجين.[124]
المجتمع والثقافة
عادةً ما يتنفس الغواصون الترفيهيون النيتروكس الذي يحتوي نسبة تصل إلى 40% من الأكسجين، بينما يستخدم الغواصون التقنيون الأكسجين النقي أو النيتروكس الذي يحتوي ما يصل إلى 80% من الأكسجين. يحتاج الغواصون الذين يتنفسون نسبًا من الأكسجين أكبر من تلك الموجودة في الهواء (21%) إلى التدريب حول مخاطر التسمم بالأكسجين وكيفية الوقاية منها.[67] يُشترط على الغواص إظهار دليل على أهليته التدريبية قبل شراء النيتروكس.[125]
منذ أواخر التسعينيات، زاد الاستخدام الترفيهي للأكسجين من طريق حانات الأكسجين، حيث يتنفس الزبائن الأكسجين عبر قنية أنفية. تفيد بعض الادعاءات بأن استخدام الأكسجين يقلل من التوتر ويزيد الطاقة ويقلل من آثار الإفراط في تناول الكحول والصداع، رغم عدم وجود أي دليل علمي يدعم هذه الادعاءات.[126] توجد أيضًا أجهزة معروضة للبيع تقدم «التدليك بالأكسجين» و «إزالة السموم بالأكسجين» بحجة أنها تزيل السموم من الجسم وتقلل الدهون فيه.[127] صرحت جمعية الرئة الأمريكية بأنه «لا يوجد دليل على تشكيل استخدام الأكسجين عند مستويات التدفق المنخفضة المعتمدة في الحانات خطورة على صحة الإنسان العادي»، لكن مركز تقييم الأدوية وأبحاثها الأمريكي ينوه بحاجة مرضى القلب أو الرئة إلى تنظيم كمية الأكسجين الإضافي بعناية وينصح بتجنب ارتياد حانات الأكسجين.[126]
انبهر المجتمع الفيكتوري بالتوسع السريع في مجال العلوم. في «تجربة الدكتور أوكس»، قصة قصيرة كتبها جول فيرن عام 1872، يستخدم الطبيب التحليل الكهربائي للماء لفصل الأكسجين عن الهيدروجين، ثم يضخ الأكسجين النقي في جميع أنحاء مدينة كويكويندون، ما تسبب في عدوانية السكان الهادئين وحيواناتهم، ونمو النباتات بسرعة. ينهي انفجار الهيدروجين والأكسجين في مصنع الدكتور أوكس تجربته. لخص فيرن قصته عبر توضيحه أن تأثيرات الأكسجين الموصوفة في الحكاية كانت من اختراعه.[128] تحدث أيضًا نوبة قصيرة من التسمم بالأكسجين في كتابه «من الأرض إلى القمر».[129]
مراجع
- Donald, Part I 1947.
- Clark & Thom 2003، صفحات 358–360.
- Acott، Chris (1999). "Oxygen toxicity: A brief history of oxygen in diving". South Pacific Underwater Medicine Society Journal. ج. 29 ع. 3: 150–5. ISSN:0813-1988. OCLC:16986801. مؤرشف من الأصل في 2010-12-25. اطلع عليه بتاريخ 2008-04-29.
- Beehler، CC (1964). "Oxygen and the eye". Survey of Ophthalmology. ج. 9: 549–60. PMID:14232720.
- Goldstein، JR؛ Mengel، CE (1969). "Hemolysis in mice exposed to varying levels of hyperoxia". Aerospace Medicine. ج. 40 ع. 1: 12–13. PMID:5782651.
- Larkin، EC؛ Adams، JD؛ Williams، WT؛ Duncan، DM (1972). "Hematologic responses to hypobaric hyperoxia". American Journal of Physiology. ج. 223 ع. 2: 431–7. DOI:10.1152/ajplegacy.1972.223.2.431. PMID:4403030.
- Schaffner، Fenton؛ Felig، Philip (1965). "Changes in Hepatic Structure in Rats Produced by Breathing Pure Oxygen". Journal of Cell Biology. ج. 27 ع. 3: 505–17. DOI:10.1083/jcb.27.3.505. PMC:2106769. PMID:5885427.
- Caulfield، JB؛ Shelton، RW؛ Burke، JF (1972). "Cytotoxic effects of oxygen on striated muscle". Archives of Pathology. ج. 94 ع. 2: 127–32. PMID:5046798.
- Bean، JW؛ Johnson، PC (1954). "Adrenocortical response to single and repeated exposure to oxygen at high pressure". American Journal of Physiology. ج. 179 ع. 3: 410–4. DOI:10.1152/ajplegacy.1954.179.3.410. PMID:13228600.
- Edstrom، JE؛ Rockert، H (1962). "The effect of oxygen at high pressure on the histology of the central nervous system and sympathetic and endocrine cells". Acta Physiologica Scandinavica. ج. 55 ع. 2–3: 255–63. DOI:10.1111/j.1748-1716.1962.tb02438.x. PMID:13889254.
- Gersh، I؛ Wagner، CE (1945). "Metabolic factors in oxygen poisoning". American Journal of Physiology. ج. 144 ع. 2: 270–7. DOI:10.1152/ajplegacy.1945.144.2.270.
- Hess، RT؛ Menzel، DB (1971). "Effect of dietary antioxidant level and oxygen exposure on the fine structure of the proximal convoluted tubules". Aerospace Medicine. ج. 42 ع. 6: 646–9. PMID:5155150.
- Clark، John M (1974). "The toxicity of oxygen". American Review of Respiratory Disease. ج. 110 ع. 6 Pt 2: 40–50. DOI:10.1164/arrd.1974.110.6P2.40 (غير نشط 15 يناير 2021). PMID:4613232. مؤرشف من الأصل في 2021-06-01.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: وصلة دوي غير نشطة منذ 2021 (link) (subscription required) - Patel، Dharmeshkumar N؛ Goel، Ashish؛ Agarwal، SB؛ Garg، Praveenkumar؛ Lakhani، Krishna K (2003). "Oxygen toxicity" (PDF). Journal, Indian Academy of Clinical Medicine. ج. 4 ع. 3: 234–237. مؤرشف من الأصل (PDF) في 2020-05-12. اطلع عليه بتاريخ 2008-09-28.
- Clark & Lambertsen 1970، صفحة 159.
- Clark & Thom 2003، صفحة 376.
- Bitterman، N (2004). "CNS oxygen toxicity". Undersea and Hyperbaric Medicine. ج. 31 ع. 1: 63–72. PMID:15233161. مؤرشف من الأصل في 2008-08-20. اطلع عليه بتاريخ 2008-04-29.
- Lang 2001، صفحة 82.
- Richardson، Drew؛ Menduno، Michael؛ Shreeves، Karl، المحررون (1996). "Proceedings of rebreather forum 2.0". Diving Science and Technology Workshop: 286. مؤرشف من الأصل في 2010-12-25. اطلع عليه بتاريخ 2008-09-20.
- Richardson، Drew؛ Shreeves، Karl (1996). "The PADI enriched air diver course and DSAT oxygen exposure limits". South Pacific Underwater Medicine Society Journal. ج. 26 ع. 3. ISSN:0813-1988. OCLC:16986801. مؤرشف من الأصل في 2011-05-13. اطلع عليه بتاريخ 2008-05-02.
- Bitterman، N؛ Melamed، Y؛ Perlman، I (1986). "CNS oxygen toxicity in the rat: role of ambient illumination". Undersea Biomedical Research. ج. 13 ع. 1: 19–25. PMID:3705247. مؤرشف من الأصل في 2019-03-01. اطلع عليه بتاريخ 2008-09-20.
- Bitterman، N؛ Schaal، S (1995). "Caffeine attenuates CNS oxygen toxicity in rats". Brain Research. ج. 696 ع. 1–2: 250–3. DOI:10.1016/0006-8993(95)00820-G. PMID:8574677. S2CID:9020944.
- Clark & Thom 2003، صفحة 383.
- Clark، John M؛ Lambertsen، Christian J (1971). "Pulmonary oxygen toxicity: a review". Pharmacological Reviews. ج. 23 ع. 2: 37–133. PMID:4948324.
- Clark، John M؛ Lambertsen، Christian J (1971). "Rate of development of pulmonary O2 toxicity in man during O2 breathing at 2.0 Ata". Journal of Applied Physiology. ج. 30 ع. 5: 739–52. DOI:10.1152/jappl.1971.30.5.739. PMID:4929472.
- Clark & Thom 2003، صفحات 386–387.
- Smith، J Lorrain (1899). "The pathological effects due to increase of oxygen tension in the air breathed". Journal of Physiology. London: The Physiological Society and Blackwell Publishing. ج. 24 ع. 1: 19–35. DOI:10.1113/jphysiol.1899.sp000746. PMC:1516623. PMID:16992479. Note: 1 atmosphere (atm) is 1.013 bars.
- Fielder، Alistair R (1993). Fielder، Alistair R؛ Best، Anthony؛ Bax، Martin C O (المحررون). The Management of Visual Impairment in Childhood. London: Mac Keith Press : Distributed by Cambridge University Press. ص. 33. ISBN:0-521-45150-7. مؤرشف من الأصل في 2021-03-08.
- Smerz، RW (2004). "Incidence of oxygen toxicity during the treatment of dysbarism". Undersea and Hyperbaric Medicine. ج. 31 ع. 2: 199–202. PMID:15485081. مؤرشف من الأصل في 2011-09-05. اطلع عليه بتاريخ 2008-04-30.
- Hampson، Neal B؛ Simonson، Steven G؛ Kramer، CC؛ Piantadosi، Claude A (1996). "Central nervous system oxygen toxicity during hyperbaric treatment of patients with carbon monoxide poisoning". Undersea and Hyperbaric Medicine. ج. 23 ع. 4: 215–9. PMID:8989851. مؤرشف من الأصل في 2011-09-05. اطلع عليه بتاريخ 2008-04-29.
- Lang 2001، صفحة 7.
- Bitterman، H (2009). "Bench-to-bedside review: Oxygen as a drug". Critical Care. ج. 13 ع. 1: 205. DOI:10.1186/cc7151. PMC:2688103. PMID:19291278.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - Jackson، RM (1985). "Pulmonary oxygen toxicity". Chest. ج. 88 ع. 6: 900–905. DOI:10.1378/chest.88.6.900. PMID:3905287. مؤرشف من الأصل في 2021-06-01.
- Demchenko، Ivan T؛ Welty-Wolf، Karen E؛ Allen، Barry W؛ Piantadosi، Claude A (2007). "Similar but not the same: normobaric and hyperbaric pulmonary oxygen toxicity, the role of nitric oxide". American Journal of Physiology. Lung Cellular and Molecular Physiology. ج. 293 ع. 1: L229–38. DOI:10.1152/ajplung.00450.2006. PMID:17416738. مؤرشف من الأصل في 2009-03-22.
- Wittner، M؛ Rosenbaum، RM (1966). Pathophysiology of pulmonary oxygen toxicity. Proceedings of the Third International Conference on Hyperbaric Medicine. NAS/NRC, 1404, Washington DC. ص. 179–88. – and others as discussed by Clark & Lambertsen 1970، صفحات 256–60
- Bancalari، Eduardo؛ Claure، Nelson؛ Sosenko، Ilene RS (2003). "Bronchopulmonary dysplasia: changes in pathogenesis, epidemiology and definition". Seminars in Neonatology. London: Elsevier Science. ج. 8 ع. 1: 63–71. DOI:10.1016/S1084-2756(02)00192-6. PMID:12667831.
- Yarbrough، OD؛ Welham، W؛ Brinton، ES؛ Behnke، Alfred R (1947). "Symptoms of Oxygen Poisoning and Limits of Tolerance at Rest and at Work". Navy Experimental Diving Unit Technical Report 47-01. United States Navy Experimental Diving Unit Technical Report. مؤرشف من الأصل في 2019-03-01. اطلع عليه بتاريخ 2008-04-29.
- Anderson، B؛ Farmer، Joseph C (1978). "Hyperoxic myopia". Transactions of the American Ophthalmological Society. ج. 76: 116–24. PMC:1311617. PMID:754368.
- Ricci، B؛ Lepore، D؛ Iossa، M؛ Santo، A؛ D'Urso، M؛ Maggiano، N (1990). "Effect of light on oxygen-induced retinopathy in the rat model. Light and OIR in the rat". Documenta Ophthalmologica. ج. 74 ع. 4: 287–301. DOI:10.1007/BF00145813. PMID:1701697. S2CID:688116.
- Drack، AV (1998). "Preventing blindness in premature infants". New England Journal of Medicine. ج. 338 ع. 22: 1620–1. DOI:10.1056/NEJM199805283382210. PMID:9603802.
- Butler، Frank K؛ White، E؛ Twa، M (1999). "Hyperoxic myopia in a closed-circuit mixed-gas scuba diver". Undersea and Hyperbaric Medicine. ج. 26 ع. 1: 41–5. PMID:10353183. مؤرشف من الأصل في 2011-08-11. اطلع عليه بتاريخ 2009-04-29.
- Nichols، CW؛ Lambertsen، Christian (1969). "Effects of high oxygen pressures on the eye". New England Journal of Medicine. ج. 281 ع. 1: 25–30. DOI:10.1056/NEJM196907032810106. PMID:4891642.
- Shykoff، Barbara E (2005). "Repeated Six-Hour Dives 1.35 ATM Oxygen Partial Pressure". Nedu-Tr-05-20. Panama City, FL, USA: US Navy Experimental Diving Unit Technical Report. مؤرشف من الأصل في 2008-11-22. اطلع عليه بتاريخ 2008-09-19.
- Shykoff، Barbara E (2008). "Pulmonary effects of submerged oxygen breathing in resting divers: repeated exposures to 140 kPa". Undersea and Hyperbaric Medicine. ج. 35 ع. 2: 131–43. PMID:18500077.
- Anderson Jr، B؛ Shelton، DL (1987). "Axial length in hyperoxic myopia". In: Bove, Alfred A; Bachrach, Arthur J; Greenbaum, Leon (Eds.) Ninth International Symposium of the UHMS. Undersea and Hyperbaric Medical Society: 607–11.
- Schaal، S؛ Beiran، I؛ Rubinstein، I؛ Miller، B؛ Dovrat، A (2005). "Oxygen effect on ocular lens". Harefuah (بالعبرية). ج. 144 ع. 11: 777–780, 822. PMID:16358652.
- Clark & Thom 2003، صفحة 360.
- Rhee، SG (2006). "Cell signaling. H2O2, a necessary evil for cell signaling". Science. ج. 312 ع. 5782: 1882–1883. DOI:10.1126/science.1130481. PMID:16809515. S2CID:83598498.
- Thom، Steven R (1992). "Inert gas enhancement of superoxide radical production". Archives of Biochemistry and Biophysics. ج. 295 ع. 2: 391–6. DOI:10.1016/0003-9861(92)90532-2. PMID:1316738.
- Ghio، Andrew J؛ Nozik-Grayck، Eva؛ Turi، Jennifer؛ Jaspers، Ilona؛ Mercatante، Danielle R؛ Kole، Ryszard؛ Piantadosi، Claude A (2003). "Superoxide-dependent iron uptake: a new role for anion exchange protein 2". American Journal of Respiratory Cell and Molecular Biology. ج. 29 ع. 6: 653–60. DOI:10.1165/rcmb.2003-0070OC. PMID:12791678. مؤرشف من الأصل في 2011-09-30.
- Fridovich، I (1998). "Oxygen toxicity: a radical explanation" (PDF). Journal of Experimental Biology. ج. 201 ع. 8: 1203–9. DOI:10.1242/jeb.201.8.1203. PMID:9510531. مؤرشف من الأصل (PDF) في 2021-02-25.
- Piantadosi، Claude A (2008). "Carbon Monoxide, Reactive Oxygen Signaling, and Oxidative Stress". Free Radical Biology & Medicine. ج. 45 ع. 5: 562–9. DOI:10.1016/j.freeradbiomed.2008.05.013. PMC:2570053. PMID:18549826.
- Imlay، JA (2003). "Pathways of oxidative damage". Annual Review of Microbiology. ج. 57: 395–418. DOI:10.1146/annurev.micro.57.030502.090938. PMID:14527285. مؤرشف من الأصل في 2022-04-05.
- Bowen، R. "Free Radicals and Reactive Oxygen". Colorado State University. مؤرشف من الأصل في 12 مايو 2008. اطلع عليه بتاريخ 26 سبتمبر 2008.
- Oury، TD؛ Ho، YS؛ Piantadosi، Claude A؛ Crapo، JD (1992). "Extracellular superoxide dismutase, nitric oxide, and central nervous system O2 toxicity". Proceedings of the National Academy of Sciences of the United States of America. ج. 89 ع. 20: 9715–9. Bibcode:1992PNAS...89.9715O. DOI:10.1073/pnas.89.20.9715. PMC:50203. PMID:1329105.
- Thom، Steven R؛ Marquis، RE (1987). "Free radical reactions and the inhibitory and lethal actions of high-pressure gases". Undersea Biomedical Research. ج. 14 ع. 6: 485–501. PMID:2825395. مؤرشف من الأصل في 2020-07-25. اطلع عليه بتاريخ 2008-09-26.
- Djurhuus، R؛ Svardal، AM؛ Thorsen، E (1999). "Glutathione in the cellular defense of human lung cells exposed to hyperoxia and high pressure". Undersea and Hyperbaric Medicine. ج. 26 ع. 2: 75–85. PMID:10372426. مؤرشف من الأصل في 2011-08-11. اطلع عليه بتاريخ 2008-09-26.
- Freiberger، John J؛ Coulombe، Kathy؛ Suliman، Hagir؛ Carraway، Martha-sue؛ Piantadosi، Claude A (2004). "Superoxide dismutase responds to hyperoxia in rat hippocampus". Undersea and Hyperbaric Medicine. ج. 31 ع. 2: 227–32. PMID:15485085. مؤرشف من الأصل في 2020-07-25. اطلع عليه بتاريخ 2008-09-26.
- Kim، YS؛ Kim، SU (1991). "Oligodendroglial cell death induced by oxygen radicals and its protection by catalase". Journal of Neuroscience Research. ج. 29 ع. 1: 100–6. DOI:10.1002/jnr.490290111. PMID:1886163. S2CID:19165217.
- NBDHMT (4 فبراير 2009). "Recommended Guidelines for Clinical Internship in Hyperbaric Technology (V: C.D)". Harvey, LA: National Board of Diving and Hyperbaric Medical Technology. مؤرشف من الأصل في 2007-09-20. اطلع عليه بتاريخ 2009-03-26.
- "How is bronchopulmonary dysplasia diagnosed?". U.S. Department of Health & Human Services. مؤرشف من الأصل في 2011-06-23. اطلع عليه بتاريخ 2008-09-28.
- Regillo, Brown & Flynn 1998، صفحة 178.
- Mitchell، Simon J؛ Bennett، Michael H؛ Bird، Nick؛ Doolette، David J؛ Hobbs، Gene W؛ Kay، Edward؛ Moon، Richard E؛ Neuman، Tom S؛ Vann، Richard D؛ Walker، Richard؛ Wyatt، HA (2012). "Recommendations for rescue of a submerged unresponsive compressed-gas diver". Undersea & Hyperbaric Medicine. ج. 39 ع. 6: 1099–108. PMID:23342767. مؤرشف من الأصل في 2019-12-28. اطلع عليه بتاريخ 2013-03-13.
- Clark & Thom 2003، صفحة 375.
- Lang 2001، صفحة 195.
- Butler، Frank K؛ Thalmann؛ Edward D (1986). "Central nervous system oxygen toxicity in closed circuit scuba divers II". Undersea Biomedical Research. ج. 13 ع. 2: 193–223. PMID:3727183. مؤرشف من الأصل في 2011-07-27. اطلع عليه بتاريخ 2008-04-29.
- Butler، Frank K (2004). "Closed-circuit oxygen diving in the U.S. Navy". Undersea and Hyperbaric Medicine. ج. 31 ع. 1: 3–20. PMID:15233156. مؤرشف من الأصل في 2010-05-13. اطلع عليه بتاريخ 2008-04-29.
- Clark & Lambertsen 1970، صفحات 157–162.
- Baker، Erik C (2000). "Oxygen toxicity calculations" (PDF). مؤرشف من الأصل (PDF) في 2021-03-09. اطلع عليه بتاريخ 2009-06-29.
- Hamilton & Thalmann 2003، صفحة 475,479.
- Clark & Lambertsen 1970، صفحة 270.
- Hamilton، RW؛ Kenyon، David J؛ Peterson، RE؛ Butler، GJ؛ Beers، DM (1988). "Repex habitat diving procedures: Repetitive vertical excursions, oxygen limits, and surfacing techniques". Technical Report 88-1A. Rockville, MD: NOAA Office of Undersea Research. مؤرشف من الأصل في 2008-11-22. اطلع عليه بتاريخ 2008-04-29.
- Hamilton، Robert W؛ Kenyon، David J؛ Peterson، RE (1988). "Repex habitat diving procedures: Repetitive vertical excursions, oxygen limits, and surfacing techniques". Technical Report 88-1B. Rockville, MD: NOAA Office of Undersea Research. مؤرشف من الأصل في 2008-11-22. اطلع عليه بتاريخ 2008-04-29.
- Hamilton، Robert W (1997). "Tolerating oxygen exposure". South Pacific Underwater Medicine Society Journal. ج. 27 ع. 1. ISSN:0813-1988. OCLC:16986801. مؤرشف من الأصل في 2008-08-20. اطلع عليه بتاريخ 2008-04-29.
- Latham، Emi (7 نوفمبر 2008). "Hyperbaric Oxygen Therapy: Contraindications". Medscape. مؤرشف من الأصل في 2021-05-23. اطلع عليه بتاريخ 2008-09-25.
- Schatte، CL (1977). "Dietary selenium and vitamin E as a possible prophylactic to pulmonary oxygen poisoning". Proceedings of the Sixth International Congress on Hyperbaric Medicine, University of Aberdeen, Aberdeen, Scotland. Aberdeen: Aberdeen University Press: 84–91. ISBN:0-08-024918-3. OCLC:16428246.
- Boadi، WY؛ Thaire، L؛ Kerem، D؛ Yannai، S (1991). "Effects of dietary supplementation with vitamin E, riboflavin and selenium on central nervous system oxygen toxicity". Pharmacology & Toxicology. ج. 68 ع. 2: 77–82. DOI:10.1111/j.1600-0773.1991.tb02039.x. PMID:1852722.
- Piantadosi, Claude A (2006). In: The Mysterious Malady: Toward an understanding of decompression injuries (DVD). Global Underwater Explorers. مؤرشف من الأصل في 2020-08-17. اطلع عليه بتاريخ 2012-04-02.
- Stone، WL؛ Henderson، RA؛ Howard، GH؛ Hollis، AL؛ Payne، PH؛ Scott، RL (1989). "The role of antioxidant nutrients in preventing hyperbaric oxygen damage to the retina". Free Radical Biology & Medicine. ج. 6 ع. 5: 505–12. DOI:10.1016/0891-5849(89)90043-9. PMID:2744583.
- "UK Retinopathy of Prematurity Guideline" (PDF). Royal College of Paediatrics and Child Health, Royal College of Ophthalmologists & British Association of Perinatal Medicine. 2007. ص. i. مؤرشف من الأصل (PDF) في 18 فبراير 2012. اطلع عليه بتاريخ 2 أبريل 2009.
- Silverman، William (1980). Retrolental Fibroplasia: A Modern Parable. Grune & Stratton. ص. 39, 41, 143. ISBN:978-0-8089-1264-4. مؤرشف من الأصل في 2021-02-17.
- Webb، James T؛ Olson، RM؛ Krutz، RW؛ Dixon، G؛ Barnicott، PT (1989). "Human tolerance to 100% oxygen at 9.5 psia during five daily simulated 8-hour EVA exposures". Aviation, Space, and Environmental Medicine. ج. 60 ع. 5: 415–21. DOI:10.4271/881071. PMID:2730484.
- Mitchell، Simon J (20 يناير 2008). "Standardizing CCR rescue skills". RebreatherWorld. مؤرشف من الأصل في 2012-03-03. اطلع عليه بتاريخ 2009-05-26. This forum post's author chairs the diving committee of the Undersea and Hyperbaric Medical Society.
- Thalmann، Edward D (2 ديسمبر 2003). "OXTOX: If You Dive Nitrox You Should Know About OXTOX". Divers Alert Network. مؤرشف من الأصل في 2020-11-11. اطلع عليه بتاريخ 2015-10-11. – Section "What do you do if oxygen toxicity or a convulsion happens?"
- "NIH MedlinePlus: Bronchopulmonary dysplasia". U.S. National Library of Medicine. مؤرشف من الأصل في 2016-07-05. اطلع عليه بتاريخ 2008-10-02.
- Regillo, Brown & Flynn 1998، صفحة 184.
- Lambertsen، Christian J (1965). Fenn، WO؛ Rahn، H (المحررون). "Effects of oxygen at high partial pressure". Handbook of Physiology: Respiration. American Physiological Society. Sec 3 Vol 2: 1027–46.
- "National Institutes of Health: What is bronchopulmonary dysplasia?". U.S. Department of Health & Human Services. مؤرشف من الأصل في 2012-04-27. اطلع عليه بتاريخ 2008-10-02.
- Spear، Michael L – reviewer (يونيو 2008). "Bronchopulmonary dysplasia (BPD)". Nemours Foundation. مؤرشف من الأصل في 2016-01-27. اطلع عليه بتاريخ 2008-10-03.
- Regillo, Brown & Flynn 1998، صفحة 190.
- Gilbert، Clare (1997). "Retinopathy of prematurity: epidemiology". Journal of Community Eye Health. London: International Centre for Eye Health. ج. 10 ع. 22: 22–4. مؤرشف من الأصل في 2013-01-31.
- Donald, Part II 1947.
- Lang 2001، صفحة 183.
- Gerth، Wayne A (2006). "Decompression sickness and oxygen toxicity in U.S. Navy surface-supplied He-O2 diving". Proceedings of Advanced Scientific Diving Workshop. Smithsonian Institution. مؤرشف من الأصل في 2009-02-21. اطلع عليه بتاريخ 2008-10-02.
- Walters، KC؛ Gould، MT؛ Bachrach، EA؛ Butler، Frank K (2000). "Screening for oxygen sensitivity in U.S. Navy combat swimmers". Undersea and Hyperbaric Medicine. ج. 27 ع. 1: 21–6. PMID:10813436. مؤرشف من الأصل في 2011-08-11. اطلع عليه بتاريخ 2008-10-02.
- Butler، Frank K؛ Knafelc، ME (1986). "Screening for oxygen intolerance in U.S. Navy divers". Undersea Biomedical Research. ج. 13 ع. 1: 91–8. PMID:3705251. مؤرشف من الأصل في 2008-08-20. اطلع عليه بتاريخ 2008-10-02.
- Yildiz، S؛ Ay، H؛ Qyrdedi، T (2004). "Central nervous system oxygen toxicity during routine hyperbaric oxygen therapy". Undersea and Hyperbaric Medicine. Undersea and Hyperbaric Medical Society, Inc. ج. 31 ع. 2: 189–90. PMID:15485078. مؤرشف من الأصل في 2019-03-01. اطلع عليه بتاريخ 2008-10-03.
- Hampson، Neal؛ Atik، D (2003). "Central nervous system oxygen toxicity during routine hyperbaric oxygen therapy". Undersea and Hyperbaric Medicine. Undersea and Hyperbaric Medical Society, Inc. ج. 30 ع. 2: 147–53. PMID:12964858. مؤرشف من الأصل في 2019-03-01. اطلع عليه بتاريخ 2008-10-20.
- Yildiz، S؛ Aktas، S؛ Cimsit، M؛ Ay، H؛ Togrol، E (2004). "Seizure incidence in 80,000 patient treatments with hyperbaric oxygen". Aviation, Space, and Environmental Medicine. ج. 75 ع. 11: 992–994. PMID:15559001. مؤرشف من الأصل في 2021-02-27. اطلع عليه بتاريخ 2009-07-01.
- Bert، Paul (1943) [First published in French in 1878]. Barometric pressure: Researches in Experimental Physiology. Columbus, OH: College Book Company. مؤرشف من الأصل في 2021-05-11. Translated by: Hitchcock, Mary Alice; Hitchcock, Fred A
- British Sub-aqua Club (1985). Sport diving : the British Sub-Aqua Club diving manual. London: Stanley Paul. ص. 110. ISBN:0-09-163831-3. OCLC:12807848.
- Behnke، Alfred R؛ Johnson، FS؛ Poppen، JR؛ Motley، EP (1935). "The effect of oxygen on man at pressures from 1 to 4 atmospheres". American Journal of Physiology. ج. 110 ع. 3: 565–572. DOI:10.1152/ajplegacy.1934.110.3.565. Note: 1 atmosphere (atm) is 1.013 bars.
- Behnke، Alfred R؛ Forbes، HS؛ Motley، EP (1935). "Circulatory and visual effects of oxygen at 3 atmospheres pressure". American Journal of Physiology. ج. 114 ع. 2: 436–442. DOI:10.1152/ajplegacy.1935.114.2.436. Note: 1 atmosphere (atm) is 1.013 bars.
- Donald 1992.
- Taylor، Larry "Harris" (1993). "Oxygen Enriched Air: A New Breathing Mix?". International Association of Nitrox and Technical Divers. مؤرشف من الأصل في 2020-06-10. اطلع عليه بتاريخ 2008-05-29.
- Davis، Robert H (1955). Deep Diving and Submarine Operations (ط. 6th). Tolworth, Surbiton, Surrey: Siebe Gorman & Company Ltd. ص. 291.
- Lambertsen، Christian J؛ Clark، John M؛ Gelfand، R (2000). "The Oxygen research program, University of Pennsylvania: Physiologic interactions of oxygen and carbon dioxide effects and relations to hyperoxic toxicity, therapy, and decompression. Summation: 1940 to 1999". EBSDC-IFEM Report No. 3-1-2000. Philadelphia, PA: Environmental Biomedical Stress Data Center, Institute for Environmental Medicine, University of Pennsylvania Medical Center.
- Vann، Richard D (2004). "Lambertsen and O2: Beginnings of operational physiology". Undersea and Hyperbaric Medicine. ج. 31 ع. 1: 21–31. PMID:15233157. مؤرشف من الأصل في 2010-05-13. اطلع عليه بتاريخ 2008-04-29.
- Clark & Lambertsen 1970.
- Lang 2001، صفحات 81–6.
- Northway، WH؛ Rosan، RC؛ Porter، DY (1967). "Pulmonary disease following respirator therapy of hyaline-membrane disease. Bronchopulmonary dysplasia". New England Journal of Medicine. ج. 276 ع. 7: 357–68. DOI:10.1056/NEJM196702162760701. PMID:5334613.
- Shennan، AT؛ Dunn، MS؛ Ohlsson، A؛ Lennox، K؛ Hoskins، EM (1988). "Abnormal pulmonary outcomes in premature infants: prediction from oxygen requirement in the neonatal period". Pediatrics. ج. 82 ع. 4: 527–32. PMID:3174313.
- Palta، Mari؛ Sadek، Mona؛ Barnet، Jodi H؛ وآخرون (يناير 1998). "Evaluation of criteria for chronic lung disease in surviving very low birth weight infants. Newborn Lung Project". Journal of Pediatrics. ج. 132 ع. 1: 57–63. DOI:10.1016/S0022-3476(98)70485-8. PMID:9470001.
- Natoli، MJ؛ Vann، Richard D (1996). "Factors Affecting CNS Oxygen Toxicity in Humans". Report to the U.S. Office of Naval Research. Durham, NC: Duke University. مؤرشف من الأصل في 2011-08-11. اطلع عليه بتاريخ 2008-04-29.
- Hof، DG؛ Dexter، JD؛ Mengel، CE (1971). "Effect of circadian rhythm on CNS oxygen toxicity". Aerospace Medicine. ج. 42 ع. 12: 1293–6. PMID:5130131.
- Torley، LW؛ Weiss، HS (1975). "Effects of age and magnesium ions on oxygen toxicity in the neonate chicken". Undersea Biomedical Research. ج. 2 ع. 3: 223–7. PMID:15622741. مؤرشف من الأصل في 2013-05-25. اطلع عليه بتاريخ 2008-09-20.
- Troy، SS؛ Ford، DH (1972). "Hormonal protection of rats breathing oxygen at high pressure". Acta Neurologica Scandinavica. ج. 48 ع. 2: 231–42. DOI:10.1111/j.1600-0404.1972.tb07544.x. PMID:5061633. S2CID:28618515.
- Hart، George B؛ Strauss، Michael B (2007). "Gender differences in human skeletal muscle and subcutaneous tissue gases under ambient and hyperbaric oxygen conditions". Undersea and Hyperbaric Medicine. ج. 34 ع. 3: 147–61. PMID:17672171. مؤرشف من الأصل في 2013-05-25. اطلع عليه بتاريخ 2008-09-20.
- Shykoff، Barbara E (2007). "Performance of various models in predicting vital capacity changes caused by breathing high oxygen partial pressures". Nedu-Tr-07-13. Panama City, FL: U.S. Naval Experimental Diving Unit Technical Report. مؤرشف من الأصل في 2008-11-22. اطلع عليه بتاريخ 2008-06-06.
- British Sub-Aqua Club (2006). "The Ocean Diver Nitrox Workshop" (PDF). British Sub-Aqua Club. ص. 6. مؤرشف من الأصل (PDF) في 2011-07-16. اطلع عليه بتاريخ 2010-09-15.
- Bren، Linda (نوفمبر–ديسمبر 2002). "Oxygen Bars: Is a Breath of Fresh Air Worth It?". FDA Consumer. ج. 36 رقم 6. ص. 9–11. PMID:12523293. مؤرشف من الأصل في 14 مارس 2021. اطلع عليه بتاريخ 25 مارس 2020.
- "O2 Planet – Exercise and Fitness Equipment". O2Planet LLC. 2006. مؤرشف من الأصل في 15 أبريل 2006. اطلع عليه بتاريخ 21 أكتوبر 2008.
- Verne، Jules (2004) [1872]. A Fantasy of Dr Ox. Hesperus Press. ISBN:978-1-84391-067-1. مؤرشف من الأصل في 2022-04-07. اطلع عليه بتاريخ 2009-05-08. Translated from French
- Verne، Jules (1877) [1870]. "VIII" [At seventy-eight thousand one hundred and fourteen leagues]. Autour de la Lune [Round the Moon]. London: Ward Lock. ISBN:2-253-00587-8. مؤرشف من الأصل في 2021-02-06. اطلع عليه بتاريخ 2009-09-02. Translated from French
- بوابة الكيمياء
- بوابة تمريض
- بوابة طب
- بوابة غوص


