تأشيب متماثل
التأشيب المتماثل هو نوع من التأشيب الجيني، يتم فيه تبادل تسلسلات النوكليوتيدات بين جزيئي دنا متشابهين أو متطابقين. وكثيراً ما تستعمل الخلايا التأشيب الجيني من أجل إصلاح الدنا بشكل دقيق عندما تحدث كسور في كلا شريطي الدنا، وهذا يُعرف بالكسور مزدوجة الشرائط. التأشيب المتماثل ينتج توليفات جديدة من تسلسلات الدنا خلال عملية الانتصاف، وهي العملية التي تنتج فيها حقيقيات النواة خلايا مشيجية، مثل الحيوانات المنوية وخلايا البويضات في الحيوانات. وهذه التوليفات الجديدة من الدنا تمثل التنوع الجيني الذي سيكون في النسل، وهذا بدوره يمكن التجمعات من التكيف خلال عملية التطور.[1] يُستعمل التأشيب المتماثل أيضاً في نقل الجينات الأفقي، وفيه يتم تبادل المواد الوراثية بين أنواع مختلفة من البكتيريا أو الفيروسات.
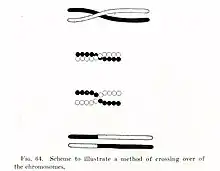
يختلف التأشيب المتماثل كثيرًا بين الكائنات الحية وأنواع الخلايا المختلفة، لكن بالنسبة للحمض النووي المزدوج، فإن معظم أشكال التأشيب تنطوي على الخطوات الأساسية نفسها. يحدث أولًا تكسّر مزدوج السلسلة، وتُقطع أجزاء من الحمض النووي عند النهايات 5' في مكان التكسر في عملية تسمى الاستئصال. الخطوة التالية هي غزو السلسة، وفيها «تغزو» النهاية 3' الأخرى لجزيء الحمض النووي المتكسر جزيء الحمض النووي المماثل أو المطابق الذي لم يتكسر. وبعد غزو السلسلة، يتبع التسلسل اللاحق للأحداث واحدًا من مسارين رئيسيين؛ مسار دي إس بي آر (إصلاح التكسر ثنائي السلسلة) أو مسار إس دي إس إيه (تلدين السلسلة المعتمد على التركيب). يميل التأشيب المتماثل الذي يحدث في أثناء إصلاح الحمض النووي إلى إنتاج منتجات غير تقاطعية، ما يؤدي إلى استعادة جزيء الحمض النووي التالف لوضعه قبل حدوث التكسر المزدوج.
يوجد التأشيب المتماثل في نطاقات الحياة الثلاثة بالإضافة إلى الفيروسات ذات الحمض النووي دنا والحمض النووي رنا، ما يشير إلى أنه آلية بيولوجية شاملة تقريبًا. فُسر اكتشاف جينات التأشيب المتماثل في طلائعيات النوى (الطلائع) - وهي مجموعة متنوعة من الكائنات الحية الدقيقة حقيقية النواة - على أنه دليل على ظهور الانقسام الاختزالي (الانتصاف) في وقت مبكر من تطور حقيقيات النوى.[2] نظرًا إلى أن الاختلال الوظيفي في التأشيب المتماثل يرتبط بقوة بزيادة القابلية للإصابة بأنواع من السرطان، فإن البروتينات التي تُمكّن حدوث التأشيب المتماثل هي مواضيع بحثية نشطة. يُستخدم التأشيب المتماثل أيضًا في استهداف الجينات، وهي تقنية لإدخال تغييرات جينية في الكائنات الحية المستهدفة. حصل ماريو كابيتشي ومارتن إيفانز وأوليفر سميثيز على جائزة نوبل في الطب أو علم وظائف الأعضاء 2007 بفضل تطوير هذه التقنية.[3][4][5] اكتشف كابيتشي وسميثيز بشكل مستقل تطبيقات للتقنية في الخلايا الجذعية الجنينية للفئران، لكن الآليات المحفوظة الكامنة وراء نموذج دي إس بي آر ومنها الدمج المتماثل للحمض النووي المحوَل (المعالجة الجينية) قُدمت أول مرة في التجارب على البلازميد التي أجراها أور ويفر وزوستاك وروثشتاين.[6] حثّ البحث في دي إس بي آر المحرّض في البلازميد، باستخدام الأشعة غاما في سبعينيات وثمانينيات القرن الماضي تجارب لاحقة باستخدام النوكليازات الداخلية لقطع الصبغيات في سياق الهندسة الوراثية لخلايا الثدييات، حيث يكون التأشيب المتماثل أكثر تواترًا من فطر الخميرة.[7]
التاريخ والاكتشاف
في العقد الأول من القرن العشرين، وجد ويليام باتسون وريجينالد بانيت استثناءً لواحد من مبادئ الوراثة التي وصفها غريغور مندل في ستينيات القرن التاسع عشر. على النقيض من فكرة مندل بأن السمات تتنوع بشكل مستقل عندما تنتقل من الوالد إلى الطفل - فلون شعر القط وطول ذيله مثلًا موروثتان تنتقلان بشكل مستقل عن بعضهما - أظهر باتسون وبانيت أن بعض الجينات المسؤولة عن السمات الجسدية يمكن أن تكون موروثة معًا، أي مرتبطة وراثيًا. في عام 1911، بعد ملاحظة أن السمات المرتبطة يمكن أن تورّث في بعض الأحيان بشكل منفصل، اقترح توماس هانت مورغان إمكانية حدوث «عمليات عبور» بين الجينات المرتبطة، يعبر من خلالها أحد الجينات المرتبطة جسديًا إلى صبغي مختلف. بعد عقدين من الزمن، أثبتت باربرا ماكلينتوك وهارييت كريتون أن العبور الصبغي يحدث في أثناء الانقسام الاختزالي، وهي عملية انقسام الخلايا التي تصنع من خلالها الحيوانات المنوية والبويضات. في نفس العام الذي اكتشفت فيه ماكلينتوك، أظهر كورت ستيرن أن العبور- الذي سمي لاحقا «التأشيب» - يمكن أن يحدث أيضًا في الخلايا الجسدية مثل خلايا الدم البيضاء وخلايا الجلد التي تنقسم من خلال الانقسام الخيطي.[8][9]
في عام 1947، أظهر عالم الأحياء الدقيقة جوشوا ليدربرغ أن الجراثيم - التي كان من المفترض أنها تتكاثر فقط بشكل لاجنسي من خلال الانشطار الثنائي – يمكنها أن تأوي التأشيب الجيني، وهو ما يشبه إلى حد كبير التكاثر الجنسي. جعل هذا العمل الإشريكية القولونية كائنًا حيًا نموذجيًا في علم الوراثة، وساعد ليدربرغ على الفوز بجائزة نوبل في الطب أو علم وظائف الأعضاء عام 1958.[10] بناء على الدراسات التي أجريت على الفطريات، اقترح روبن هوليداي في عام 1964 نموذجًا للتأشيب في الانقسام الاختزالي قدم من خلاله تفاصيل أساسية حول كيفية حدوث العملية، بما في ذلك تبادل المواد بين الصبغيات من خلال موصِلات هوليداي.[11] في عام 1983، قدم جاك زوستاك وزملاؤه نموذجًا يعرف الآن باسم مسار دي إس بي آر، والذي يمثل الملاحظات التي لم يفسرها نموذج هوليداي. خلال العقد التالي، ساعدت التجارب على ذبابة الفاكهة والخميرة المتبرعمة وخلايا الثدييات على ظهور نماذج أخرى للتأشيب المتماثل، سُميت مسارات سي دي إس إيه، والتي لا تعتمد دائمًا على موصِلات هوليداي.[12]
نُفذ الكثير من العمل اللاحق لتحديد البروتينات المشاركة في العملية وتحديد آلياتها من قبل عدد من الأفراد منهم جيمس هابر وباتريك سونغ وستيفن كوالتشيكوفسكي وآخرون.
لدى حقيقيات النوى
التأشيب المتماثل ضروري لانقسام الخلايا في حقيقيات النوى مثل النباتات والحيوانات والفطريات والطلائع. ففي الخلايا التي تتكاثر من خلال الانقسام الخيطي، يُصلح التأشيب المتماثل التكسّرات المزدوجة في الحمض النووي الناجمة عن الإشعاع المؤيِن أو المواد الكيميائية الضارة بالحمض النووي. إذا تُركت هذه التكسرات المزدوجة دون إصلاح، تحدث إعادة ترتيب واسعة النطاق للصبغيات في الخلايا الجسدية، يمكن أن تؤدي إلى السرطان.[13]
بالإضافة إلى إصلاح الحمض النووي، يساعد التأشيب المتماثل أيضًا على إنتاج التنوع الجيني من خلال الانقسام الاختزالي للخلايا الذي يؤدي إلى إنتاج خلايا مشيجية متخصصة – وهي خلايا الحيوانات المنوية والبويضات عند الحيوانات، وحبوب الطلع والبويضات عند النباتات، والأبواغ عند الفطريات. يساعد التأشيب المتماثل على التنوع الجيني من خلال تسهيل العبور الصبغي (التعابر الكروموسومي)، إذ تحدث مبادلة بين مناطق الحمض النووي المتماثلة غير المتطابقة بين الصبغيات المتقابلة. ويخلق الأمر مجموعات جديدة من الجينات قد تكون أكثر منفعة، ويمكن أن تعطي النسل ميزة تطورية.[14][15]
مراجع
- Alberts، B؛ وآخرون (2002). "Chapter 5: DNA Replication, Repair, and Recombination". Molecular Biology of the Cell (ط. 4th). New York: Garland Science. ص. 845. OCLC:145080076 48122761 57023651 69932405.
{{استشهاد بكتاب}}: Explicit use of et al. in:|الأول=(مساعدة) وتأكد من صحة قيمة|oclc=(مساعدة) - Capecchi MR (يونيو 1989). "Altering the genome by homologous recombination". Science. ج. 244 ع. 4910: 1288–92. Bibcode:1989Sci...244.1288C. DOI:10.1126/science.2660260. PMID:2660260.
- Smithies O، Gregg RG، Boggs SS، Koralewski MA، Kucherlapati RS (19 سبتمبر 1985). "Insertion of DNA sequences into the human chromosomal beta-globin locus by homologous recombination". Nature. ج. 317 ع. 6034: 230–4. Bibcode:1985Natur.317..230S. DOI:10.1038/317230a0. PMID:2995814. S2CID:30212766.
- Orr-Weaver TL، Szostak JW، Rothstein RJ (أكتوبر 1981). "Yeast transformation: a model system for the study of recombination". Proceedings of the National Academy of Sciences of the United States of America. ج. 78 ع. 10: 6354–8. Bibcode:1981PNAS...78.6354O. DOI:10.1073/pnas.78.10.6354. PMC:349037. PMID:6273866.
- Szostak JW، Orr-Weaver TL، Rothstein RJ، Stahl FW (مايو 1983). "The double-strand-break repair model for recombination". Cell. ج. 33 ع. 1: 25–35. DOI:10.1016/0092-8674(83)90331-8. PMID:6380756. S2CID:39590123.
- Resnick MA (يونيو 1976). "The repair of double-strand breaks in DNA; a model involving recombination". Journal of Theoretical Biology. ج. 59 ع. 1: 97–106. Bibcode:1976JThBi..59...97R. DOI:10.1016/s0022-5193(76)80025-2. PMID:940351.
- Jasin M، Rothstein R (نوفمبر 2013). "Repair of strand breaks by homologous recombination". Cold Spring Harbor Perspectives in Biology. ج. 5 ع. 11: a012740. DOI:10.1101/cshperspect.a012740. PMC:3809576. PMID:24097900.
- Coe E، Kass LB (مايو 2005). "Proof of physical exchange of genes on the chromosomes". Proceedings of the National Academy of Sciences of the United States of America. ج. 102 ع. 19: 6641–6. Bibcode:2005PNAS..102.6641C. DOI:10.1073/pnas.0407340102. PMC:1100733. PMID:15867161.
- Creighton HB، McClintock B (أغسطس 1931). "A Correlation of Cytological and Genetical Crossing-Over in Zea Mays". Proceedings of the National Academy of Sciences of the United States of America. ج. 17 ع. 8: 492–7. Bibcode:1931PNAS...17..492C. DOI:10.1073/pnas.17.8.492. PMC:1076098. PMID:16587654.
- "The development of bacterial genetics". US National Library of Medicine. مؤرشف من الأصل في 2018-05-25. اطلع عليه بتاريخ 2010-07-03.
- "The Nobel Prize in Physiology or Medicine 1958". Nobelprize.org. مؤرشف من الأصل في 2018-07-21. اطلع عليه بتاريخ 2010-07-03.
- Haber JE، Ira G، Malkova A، Sugawara N (يناير 2004). "Repairing a double-strand chromosome break by homologous recombination: revisiting Robin Holliday's model". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. ج. 359 ع. 1441: 79–86. DOI:10.1098/rstb.2003.1367. PMC:1693306. PMID:15065659.
- Khanna KK، Jackson SP (مارس 2001). "DNA double-strand breaks: signaling, repair and the cancer connection". Nature Genetics. ج. 27 ع. 3: 247–54. DOI:10.1038/85798. PMID:11242102. S2CID:3012823.
- Nelson DL، Cox MM (2005). Principles of Biochemistry (ط. 4th). Freeman. ص. 980–981. ISBN:978-0-7167-4339-2.
- Marcon E، Moens PB (أغسطس 2005). "The evolution of meiosis: recruitment and modification of somatic DNA-repair proteins". BioEssays. ج. 27 ع. 8: 795–808. DOI:10.1002/bies.20264. PMID:16015600. S2CID:27658497.
- بوابة علم الأحياء الخلوي والجزيئي