بوسنتان
بوسنتان وهو دواء مضادات مستقبلات الإندوثيلين يستخدم في علاج ارتفاع ضغط الدم في الشريان الرئوي (PAH). ويُباع بوسنتان تحت الاسم التجاري (تراكلير:Tracleer).[2][3]
| بوسنتان | |
|---|---|
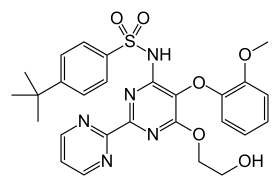 | |
| الاسم النظامي | |
| 4-tert-butyl-N-[6-(2-hydroxyethoxy)-5-(2-methoxyphenoxy)-2-(pyrimidin-2-yl)pyrimidin-4-yl]benzene-1-sulfonamide | |
| يعالج | |
| اعتبارات علاجية | |
| اسم تجاري | Tracleer, Stayveer |
| ASHPDrugs.com | أفرودة |
| مدلاين بلس | a605001 |
| الوضع القانوني | وكالة الأدوية الأوروبية:وصلة، ديلي مد:وصلة |
| فئة السلامة أثناء الحمل | X (أستراليا) X (الولايات المتحدة) X |
| طرق إعطاء الدواء | إعطاء فموي |
| بيانات دوائية | |
| توافر حيوي | 50% |
| ربط بروتيني | >98% |
| استقلاب (أيض) الدواء | كبد |
| عمر النصف الحيوي | 5 hours |
| معرّفات | |
| CAS | 147536-97-8 |
| ك ع ت | C02C02KX01 KX01 |
| بوب كيم | CID 104865 |
| IUPHAR | 3494 |
| ECHA InfoCard ID | 100.171.206 |
| درغ بنك | DB00559 |
| كيم سبايدر | 94651 |
| المكون الفريد | XUL93R30K2 |
| كيوتو | D07538 |
| ChEBI | CHEBI:51450 |
| ChEMBL | CHEMBL957 |
| بيانات كيميائية | |
| الصيغة الكيميائية | C27H29N5O6S |
ويتوفر بوسنتان كأقراص مغلفة (62.5 مجم أو 125 مجم) أو كأقراص قابلة للتشتت عن طريق الفم (32 مجم).[2]
الاستخدامات الطبية
يستخدم بوسنتان لعلاج الأشخاص الذين يعانون من ارتفاع ضغط الدم الشرياني الرئوي المعتدل وللتقليل من عدد القرح الرقمية - الجروح المفتوحة خاصة على أطراف الأصابع وأقل شيوعًا في المفاصل - في الأشخاص الذين يعانون من تصلب الجلد الجهازي.[2][4][5]
يسبب بوسنتان ضررًا للأجنة ويجب على النساء الحوامل عدم تناوله، ويجب ألا تحمل المرأة أثناء تناولها (الحمل من فئة X). قد يجعل موانع الحمل الهرمونية غير فعالة لذلك يجب استخدام أشكال أخرى لتحديد النسل.[2][4]
في الولايات المتحدة، يتوفر فقط من الأطباء الذين يتبعون استراتيجية تقييم المخاطر وتخفيفها (REMS) التي تفرضها إدارة الأغذية والعقاقير (REMS) فيما يتعلق بالمخاطر على الأجنة ومخاطر التسبب في تلف الكبد. يجب على الطبيب توثيق اختبار الحمل السلبي للسيدات قبل وصف الدواء، وتقديم المشورة بشأن وسائل منع الحمل، وإجراء اختبارات الحمل بشكل منتظم.[6] نظرًا لوجود خطر كبير من أن يسبب بوسنتان تلفًا للكبد، تتطلب خطة REMS أيضًا اختبارًا مسبقًا للكشف عن الترانساميناسات المرتفعة والاختبار المنتظم أثناء تناول الدواء.[6] يُمنع استخدام البوسنتان أيضًا مع المرضى الذين يتناولون الغليبنكلاميد بسبب زيادة خطر زيادة إنزيمات الكبد وتلف الكبد عند أخذ هذين العاملين معًا.[2]
الآثار السلبية
بالإضافة إلى مخاطر التسبب في عيوب خلقية وتسبب تلف الكبد بالنسبة للأجنة، فإن بوسنتان لديه مخاطر عالية للتسبب في الوذمة ومرض انسداد الوريد الرئوي، وانخفاض عدد الحيوانات المنوية، وانخفاض في الهيموجلوبين والهيماتوكريت.[2][4]
تشمل الآثار الضارة الشائعة جدًا (التي تحدث مع أكثر من 10٪ من الأشخاص) الصداع، ارتفاع الترانساميناسات، والوذمة. تشمل الآثار الجانبية الشائعة (بين 1٪ و 10٪ من الأشخاص) فقر الدم، وانخفاض الهيموجلوبين، وتفاعلات فرط الحساسية، والتهاب الجلد، والحكة، والطفح الجلدي، وإحمرار الجلد، والإغماء، وخفقان القلب، وانخفاض ضغط الدم، واحتقان الأنف، والارتجاع المعدي المريئي المرض والإسهال.[2][4]
آلية العمل
يعتبر بوسنتان مضادًا تنافسيًا (إندوثيلين-1) في مستقبلات (إندوثيلين-أ) (ET-A) و (إندوثيلين-ب) (ET-B). في ظل الظروف العادية، يتسبب ارتباط الإندوثيلين -1 لمستقبلات ET-A في انقباض الأوعية الدموية الرئوية.[7] على العكس من ذلك، ارتبط ارتباط إندوثيلين-1 بمستقبلات ET-B بكل من توسع الأوعية وتضيق الأوعية للعضلات الملساء الوعائية، اعتمادًا على النوع الفرعي ET-B (ET-B1 أو ET-B2) والأنسجة.[8] يمنع بوسنتان مستقبلات ET-A و ET-B ، ولكن يُعتقد أنه يمارس تأثيرًا أكبر على مستقبلات ET-A ، مما يتسبب في انخفاض كلي في مقاومة الأوعية الدموية الرئوية.[2]
الدوائية
يبلغ التوافر الحيوي المطلق للبوسنتان حوالي 50٪ في المواد الصحية.[9] أما ذروة تركيز البوسنتان في البلازما مع الأقراص القابلة للتشتت عن طريق الفم أقل وسطياً بنسبة 14٪ مقارنة مع أقصى تركيز للأقراص الفموية.[2]
البوسنتان عبارة عن ركيزة من (سيتوكروم 3A4:CYP3A4) و (سيوكروم 2C9:CYP2C9). وقد يلعب (سيوكروم 2C19:CYP2C19) أيضًا دورًا في عملية التمثيل الغذائي.[2] وهو أيضًا ركيزة من البولي ببتيدات العضوية الناقلة لأنيون الناقل الامتصاص الكبدي (OATPs) (OATP1B1) و (OATP1B3) و (OATP2B1).[10][11]
يتم التخلص من البوسنتان في الغالب عن طريق الكبد، مع مساهمة ضئيلة من الكلى والبراز في التخلص منه.[12]
لا يجوز استخدام البوسنتان مع السيكلوسبورين لأنه ثَبَتَ أن السيكلوسبورين أ يزيد بشكل ملحوظ تركيز البوسنتان.[2]
تاريخ
تمت دراسة تأثير بوسنتان على قصور القلب في تجربة تسمى (REACH-1) والتي تمّ إنهاؤها في أوائل عام 1997، بسبب السمية في الجرعة التي كانت قيد الدراسة؛ ومنذ عام 2001 لم يتم نشر نتائج تلك التجربة.[13]
تمت الموافقة عليه لمعالجة ارتفاع ضغط الشريان الرئوي في الولايات المتحدة في نوفمبر 2001،[2][14] وفي الاتحاد الأوروبي في مايو 2002.[4][3]
المجتمع والثقافة
اقتصاديات
بحلول عام 2013، بلغت المبيعات العالمية لبوسنتان 1.57 مليار دولار. كما بدأت صلاحية براءات الاختراع على بوسنتان في عام 2015.[15]
الأسماء التجارية لعقار بوسنتان
- بيرتينسيو.
- بالميبروف.
- بوسينتادين.
- تراكلير.
- بوسينتور.
- إيكول.[16]
المراجع
- Bosentan (بالإنجليزية), QID:Q278487
- "Tracleer- bosentan tablet, film coated Tracleer- bosentan tablet, soluble". DailyMed. 15 يونيو 2020. مؤرشف من الأصل في 2021-05-12. اطلع عليه بتاريخ 2020-10-15.
- "Tracleer (bosentan) 62.5 mg and 125mg film-coated tablets". UK Electronic Medicines Compendium. مايو 2017. مؤرشف من الأصل في 2020-07-27. اطلع عليه بتاريخ 2017-08-06.
- Abraham S، Steen V (2015). "Optimal management of digital ulcers in systemic sclerosis". Therapeutics and Clinical Risk Management. ج. 11: 939–47. DOI:10.2147/TCRM.S82561. PMC:4474386. PMID:26109864.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - "Approved Risk Evaluation and Mitigation Strategies (REMS)". U.S. إدارة الغذاء والدواء (FDA). مؤرشف من الأصل في 2020-07-27. اطلع عليه بتاريخ 2017-08-06.
- Givertz MM، Colucci WS، LeJemtel TH، Gottlieb SS، Hare JM، Slawsky MT، وآخرون (يونيو 2000). "Acute endothelin A receptor blockade causes selective pulmonary vasodilation in patients with chronic heart failure". Circulation. ج. 101 ع. 25: 2922–7. DOI:10.1161/01.CIR.101.25.2922. PMID:10869264.
- Hynynen MM، Khalil RA (يناير 2006). "The vascular endothelin system in hypertension--recent patents and discoveries". Recent Patents on Cardiovascular Drug Discovery. ج. 1 ع. 1: 95–108. DOI:10.2174/157489006775244263. PMC:1351106. PMID:17200683.
- Weber C، Schmitt R، Birnboeck H، Hopfgartner G، van Marle SP، Peeters PA، وآخرون (أغسطس 1996). "Pharmacokinetics and pharmacodynamics of the endothelin-receptor antagonist bosentan in healthy human subjects". Clinical Pharmacology and Therapeutics. ج. 60 ع. 2: 124–37. DOI:10.1016/S0009-9236(96)90127-7. PMID:8823230. S2CID:3039181.
- Jones HM، Barton HA، Lai Y، Bi YA، Kimoto E، Kempshall S، وآخرون (مايو 2012). "Mechanistic pharmacokinetic modeling for the prediction of transporter-mediated disposition in humans from sandwich culture human hepatocyte data". Drug Metabolism and Disposition. ج. 40 ع. 5: 1007–17. DOI:10.1124/dmd.111.042994. PMID:22344703. S2CID:15463540.
- Treiber A، Schneiter R، Häusler S، Stieger B (أغسطس 2007). "Bosentan is a substrate of human OATP1B1 and OATP1B3: inhibition of hepatic uptake as the common mechanism of its interactions with cyclosporin A, rifampicin, and sildenafil". Drug Metabolism and Disposition. ج. 35 ع. 8: 1400–7. DOI:10.1124/dmd.106.013615. PMID:17496208. S2CID:2625368.
- Weber C، Gasser R، Hopfgartner G (يوليو 1999). "Absorption, excretion, and metabolism of the endothelin receptor antagonist bosentan in healthy male subjects". Drug Metabolism and Disposition. ج. 27 ع. 7: 810–5. PMID:10383925.
- van Veldhuisen DJ، Poole-Wilson PA (أغسطس 2001). "The underreporting of results and possible mechanisms of 'negative' drug trials in patients with chronic heart failure". International Journal of Cardiology. ج. 80 ع. 1: 19–27. DOI:10.1016/S0167-5273(01)00447-8. PMID:11532543.
- "Drug Approval Package: Tracleer (Bosentan) NDA #21-290". U.S. إدارة الغذاء والدواء (FDA). 20 نوفمبر 2001. مؤرشف من الأصل في 2021-05-06. اطلع عليه بتاريخ 2020-10-16.
- Helfand، Carly (2015). "The top 10 patent losses of 2015: Tracleer". FiercePharma. مؤرشف من الأصل في 2020-12-04.
- ما هو دواء بوسنتان، الطبي، تاريخ الولوج 27 نوفمبر/تشرين الثاني 2021م. نسخة محفوظة 2020-11-25 على موقع واي باك مشين.
- بوابة الكيمياء الحيوية
- بوابة طب
- بوابة الكيمياء
- بوابة صيدلة