النحاس في الصحة
يعتبر النحاس عنصرًا شحيحًا لا غنى عنه لصحة جميع الكائنات الحية (البشر والنباتات والحيوانات والكائنات الدقيقة). في البشر، يعتبر النحاس ضروريًا لوظائف الأعضاء وعمليات الأيض. يحتوي جسم الإنسان على آليات معقدة لللحفاظ على الاستتباب والتي تحاول ضمان إمداد ثابت من النحاس حسب المتاح، بينما يتم التخلص من النحاس الزائد كلما حدث ذلك. ومع ذلك، مثل جميع العناصر الأساسية والمغذيات، يمكن أن يؤدي الابتلاع الغذائي للكثير أو القليل من النحاس إلى نتائج معاكسة من زيادة أو نقص النحاس في الجسم، كل منها له مجموعة خاصة من الآثار الصحية الضارة.
تم تعيين المعايير الغذائية للاستهلاك اليومي للنحاس من قبل مختلف الوكالات الصحية في جميع أنحاء العالم. المعايير التي اعتمدتها بعض الدول توصي بمستويات مختلفة من النحاس للبالغين، والحوامل، والرضع، والأطفال، مما يتناسب مع الحاجة المتنوعة للنحاس خلال مراحل الحياة المختلفة.
يمكن أن يكون نقص النحاس وسُميته إما من أصل جيني أو غير جيني. إن دراسة الأمراض الوراثية المتعلقة بالنحاس، والتي هي محط أنظار الباحثين، قد ألقت الضوء على كيفية استخدام الجسم البشري للنحاس، ولماذا هو مهم كمغذي دقيق أساسي. كما أسفرت الدراسات عن علاجات ناجحة لحالات زيادة النحاس الوراثية، مما أتاح للمرضى الذين تتعرض حياتهم للخطر نتيجة ذلك ليعيشوا حياة طويلة ومنتجة.
يعمل الباحثون المتخصصون في مجالات علم الأحياء الدقيقة وعلم السموم والتغذية وتقييم المخاطر الصحية معًا لتحديد المستويات الدقيقة الضرورية للنحاس، مع تجنب تناول الكثير أو القليل من النحاس. ومن المتوقع استخدام نتائج هذه الدراسات في صقل برامج التوصيات الغذائية الحكومية المصممة للمساعدة في حماية الصحة العامة.
الأساسيات
النحاس هو عنصر أساسي شحيح (أي، مغذي دقيق) مطلوب لصحة النباتات والحيوانات والإنسان.[1] كما أنه مطلوب من أجل الوظائف الطبيعية للكائنات الحية الدقيقة الهوائية (التي تحتاج الأوكسجين).
تم دمج النحاس في مجموعة متنوعة من البروتينات والبروتينات المعدنية التي تؤدي وظائف التمثيل الغذائي الأساسية؛ المغذيات الدقيقة ضرورية للنمو السليم، والتطور، وسلامة العظام، والنسيج الضام، والدماغ، والقلب، والعديد من أعضاء الجسم الأخرى. ويشارك النحاس في تكوين خلايا الدم الحمراء، وامتصاص واستخدام الحديد، وأيض الكولسترول والجلوكوز، وتصنيع وإفراز البروتينات والإنزيمات التي تحافظ على الحياة. هذه الانزيمات بدورها تنتج الطاقة الخلوية وتنظم الانتقال العصبي، وتخثر الدم، ونقل الأوكسجين.
يحفز النحاس جهاز المناعة لمكافحة العدوى، وإصلاح الأنسجة المصابة، وتعزيز الالتئام. كما يساعد النحاس في معادلة «الجذور الحرة»، التي يمكن أن تسبب أضرارًا شديدة في الخلايا.
اكتشفت الاستخدامات الأساسية للنحاس لأول مرة في عام 1928، عندما تبين أن الفئران التي تغذت على حمية غذائية خالية من النحاس غير قادرة على إنتاج خلايا دم حمراء كافية.[2] تم تصحيح فقر الدم عن طريق إضافة المواد المحتوية على النحاس من مصادر نباتية أو حيوانية.
وكعنصر أساسي شحيح، فقد تم التوصية بالمعايير الغذائية للاستهلاك اليومي للنحاس من قبل عدد من الوكالات الصحية الحكومية في جميع أنحاء العالم.
الأجنة، والرضع، والأطفال
النحاس ضروري للنمو والتطور الطبيعي للأجنة البشرية والرضع والأطفال.[3] يُراكم الجنين النحاس بسرعة في كبده خلال الثلث الأخير من الحمل. عند الولادة، يكون للرضيع السليم أربعة أضعاف تركيز النحاس لدى البالغين كاملي النمو. النحاس منخفض نسبياً في الحليب البشري، ومخازن الكبد من النحاس في حديثي الولادة تنخفض بسرعة بعد الولادة، لإمداد الجسم سريع النمو بالنحاس خلال فترة الرضاعة الطبيعية. هذه الإمدادات ضرورية للقيام بوظائف الأيض مثل التنفس الخلوي، وتصنيع صبغة الميلانين والنسيج الضام، وأيض الحديد، ودفاع الجذور الحرة، والتعبير الجيني، ووظائف القلب وجهاز المناعة لدى الأطفال.
الرضع لديهم آليات بيوكيميائية خاصة لإدارة النحاس بشكل كافٍ في أجسامهم بينما تتطور الآليات الدائمة مدى الحياة وتنضج.[4]
يزيد نقص النحاس حاد في الأمهات الحوامل من خطر المشاكل الصحية في الأجنة والرضع. تشمل التأثيرات الصحية انخفاض أوزان المواليد وضعف العضلات ومشاكل الجهاز العصبي. ومع ذلك، يمكن تجنب نقص النحاس في النساء الحوامل باتباع نظام غذائي متوازن.
وبما أن توافر النحاس في الجسم يعرقله وجود فائض من الحديد والزنك، حيث يُوصف للنساء الحوامل مكملات الحديد لعلاج فقر الدم أو مكملات الزنك لعلاج نزلات البرد، لذلك يجب استشارة الأطباء للتأكد من أن المكملات الغذائية قبل الولادة تحتوي على كمية غذائية ضرورية من النحاس.
عندما يتلقى الأطفال حديثي الولادة الرضاعة الطبعية، توفر أكبادهم وحليب الثدي لأمهاتهم كميات كافية من النحاس خلال الأشهر 4-6 الأولى من الحياة.[5] عندما يفطم الأطفال، يجب أن يوفر النظام الغذائي المتوازن مصادر كافية من النحاس.
ينقص محتوى حليب البقر وحليب الأطفال الصناعي الأكبر سنًا من النحاس. ويتم تدعيم معظم حليب الصناعي الآن بالنحاس لمنع النقص.
معظم الأطفال الذين لديهم تغذية جيدة يحصلون على كميات كافية من النحاس. الأطفال المعرضون للخطر من الناحية الصحية، بما في ذلك الخدج، والذين يعانون من سوء التغذية، والذين لديهم وزن ولادة منخفض، ويعانون من العدوى، والذين يعانون من النمو التداركي واكتساب الوزن التعويضي السريع، هم أكثر عرضة لخطر نقص النحاس. ولحسن الحظ، فإن تشخيص نقص النحاس لدى الأطفال واضح وموثوق به بمجرد الاشتباه في الحالة. المكملات الغذائية تحت إشراف الطبيب عادة ما تسهل الشفاء التام.
الاستتباب
يتم امتصاص النحاس ونقله وتوزيعه وتخزينه وإخراجه من الجسم وفقًا لعمليات الاستتباب المعقدة التي تضمن إمدادًا ثابتًا وكافيًا بالمغذيات الدقيقة وفي نفس الوقت تجنب زيادة مستواها.[1] إذا تم تناول كمية غير كافية من النحاس لفترة قصيرة من الزمن، فستنضب مخازن النحاس في الكبد. إذا استمر هذا النضوب، فقد تتطور مشكلة صحية من نقص النحاس. إذا تم تناول كميات كبيرة من النحاس، فقد ينتج عن ذلك حالة فرط النحاس. كلا هاتين الحالتين، النقص والزيادة، يمكن أن تؤديان إلى إصابة الأنسجة والمرض. ومع ذلك، وبسبب تنظيم الاستتباب، فإن جسم الإنسان قادر على موازنة مجموعة كبيرة من مدخول النحاس لتناسب احتياجات الأفراد الأصحاء.[6]
أصبحت العديد من جوانب استتباب النحاس معروفة على المستوى الجزيئي.[7][8] ترجع أهمية النحاس إلى قدرته على التصرف كمانح أو مستقبل للإلكترونات حيث تتقلب أكسدة النحاس بين Cu1+(نحاسوز) و Cu2+(نحاسيك).[3] كعنصر مكون لحوالي عشرات الأنزيمات النحاسية، يشترك النحاس في تفاعلات الأكسدة-الاختزال في عمليات التمثيل الغذائي الأساسية مثل التنفس الميتوكوندري، وتصنيع الميلانين، وربط الكولاجين.[9] النحاس جزء لا يتجزأ من الإنزيم المضاد للتأكسد، سوبر أكسيد ديسميوتاز(Cu,Zn-SOD)، وله دور في استتباب الحديد كعامل مساعد في السيرولوبلازمين.[3] قائمة ببعض الإنزيمات الرئيسية المحتوية على النحاس ووظائفها ملخصة أدناه:
| Enzymes | Function |
|---|---|
| أكسيداز الأمين | مجموعة من الإنزيمات المؤكسدة للأمينات الأولية (على سبيل المثال: التيرامين، والهيستدين، وعديد الأمين) |
| سيرولوبلازمين (أكسيداز الحديدي) | أوكسيديز النحاس المتعددة في البلازما، وهو ضروري لنقل الحديد |
| سيتوكروم سي أكسيداز | إنزيم الأوكسيداز النهائي في سلسلة التنفس الخلوي في الميتوكوندريا، يشارك في نقل الإلكترونات |
| دوبامين بيتا هيدروكسيلاز | يشارك في أيض الكاتيكولامين، ويحفز تحويل الدوبامين إلى نورايبنفرين |
| هيفاستين | أكسيداز الحديدي متعدد النحاس، بشارك في نقل الحديد عبر الغشاء المخاطي المعوي للجهاز البوابي الكبدي |
| أُكسيدازُ اللِّيزيل | تصالب الكولاجين والإيلاستين |
| (Peptidylglycine alpha-amidating mono-oxygenase (PAM | إنزيم متعدد الوظائف يشارك في نضوج وتعديل الببتيدات العصبية الرئيسية (على سبيل المثال: الناقلات العصبية والببتيدات العصبية الصماء) |
| سوبر أكسيد ديسميوتاز (الزنك، النحاس) | إنزيم داخل خلوي وخارج خلوي يشارك في الدفاع ضد مركبات الأكسجين النشطة (على سبيل المثال: تدمير جذور فوق الأكسيد) |
| تايروسيناز | يحفز إنتاج الميلانين والصبغات الأخرى |
إن نقل واستقلاب النحاس في الكائنات الحية هو حاليًا موضوع بحث مهم. يتضمن نقل النحاس خلويًا تحريك النحاس من خارج الخلية إلى داخلها عبر غشاء الخلية بواسطة ناقلات متخصصة.[8] في مجرى الدم، يتم نقل النحاس في جميع أنحاء الجسم عن طريق الألبومين، والسيرولوبلازمين، وبروتينات أخرى. ينتقل غالبية النحاس في الدم (أو النحاس في المصل) عن طريق السيرولوبلازمين. يمكن أن تتراوح نسبة السيرولوبلازمين المرتبط بالنحاس من 70-95٪ ويختلف بين الأفراد حسب، على سبيل المثال، الدورة الهرمونية والوقت وحالة النحاس. يتم توجيه النحاس داخل الخلايا إلى مواقع تصنيع الأنزيمات المحتوية على النحاس في تركيبها وإلى العضيات بواسطة بروتينات متخصصة تدعى التشابيرونات المعدنية.[10][11][12] مجموعة أخرى من هذه الناقلات تحمل النحاس إلى داخل الأجزاء التحت خلوية.[12][13] توجد آليات معينة لاطلاق النحاس من الخلية. تقوم الناقلات البروتينية المتخصصة بإعادة النحاس الزائد غير المستقر للكبد للتخزين الاحتياطي و / أو للإفراز مع العصارة الصفراوية.[10][11] تضمن هذه الآليات عدم وجود أيونات نحاس سامة حرة غير مرتبطة في غالبية الأفراد (أي أولئك الذين لا يعانون من عيوب استقلاب النحاس الخلقية).
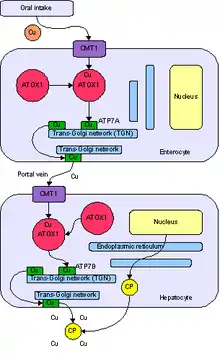
يتم ادخال النحاس إلى الخلايا عبر جدار الخلية بواسطة البروتين الناقل للغشاء البلازمي المعروف باسم ناقل النحاس 1 أو (Ctr1 (Copper Transporter 1. يرتبط Ctr1 بسرعة ببروتينات تشابيرون النحاسية داخل الخلايا. يوصل Atox1 (بروتين تشابيرون معدني نحاسي) النحاس إلى المسار الإفرازي ويرسو إما عند ATPase ناقل للنحاس (ATP7B) في الكبد أو ATP7A في خلايا أخرى. يوجه ATP7B النحاس إلى السيرولوبلازمين البلازمي أو إلى العصارة الصفراوية بالتنسيق مع تشابيرون مكتشف حديثًا، وهو Murr1، وهو البروتين المفقود في التسمم بالنحاس عند الكلاب. يوجه ATP7A النحاس داخل جهاز غولجي إلى بروتينات عدة منها دوبامين بيتا أحادي الأوكسجيناز و peptidylglycine alpha-amidating monooxygenase وأُكسيدازُ اللِّيزيل وتايروسيناز، اعتمادًا على نوع الخلية. جين CCS هو تشابيرون نحاسي لسوبر أكسيد الديسميوتاز الذي يحمي الخلايا ضد مركبات الأكسجين النشطة؛ ويقوم الجين بإصال النحاس إلى السيتوبلازم وتجويف الميتوكوندريا. يسلم Cox17 النحاس إلى الميتوكوندريا وإلى سيتوكروم سي أكسيداز عبر تشابيرونات كوكس-11 و Sco1 و Sco2. قد توجد تشابيرونات نحاس أخرى ويمكن أن تشمل الميتالوثيونين وamyloid precursor protein .[7][8] أوضحت الدراسات الجينية والتغذوية الطبيعة الأساسية لهذه البروتينات المرتبطة بالنحاس.[14]
الامتصاص
في الثدييات يتم امتصاص النحاس في المعدة والأمعاء الدقيقة، على الرغم من ذلك، يبدو أن هناك اختلاف بين الأنواع فيما يتعلق بالمكان الذي يحدث فيه أكبر قدر من الامتصاص.[15] حيث يتم امتصاص النحاس في المعدة والاثني عشر في الفئران [16] وفي الأمعاء الدقيقة السفلية في الهامستر.[17] لا يُعرف موقع حدوث الحد الأقصى من امتصاص النحاس في البشر، ولكن يفترض أن يكون في المعدة والأمعاء العليا بسبب الظهور السريع لنظير النحاس Cu64 في البلازما بعد تناول النحاس عن طريق الفم.[18]
يترواح معدل امتصاص النحاس من 15-97 ٪، وذلك اعتمادًا على محتوى النحاس، ونوع النحاس، وتكوين النظام الغذائي.[19][20][21][22][23]
تؤثر عوامل مختلفة على امتصاص النحاس. على سبيل المثال، يتم تعزيز امتصاص النحاس عن طريق تناول البروتين الحيواني، والسيترات، والفوسفات. يتم امتصاص أملاح النحاس، بما في ذلك غلوكونات النحاس، أوأسيتات النحاس، أو كبريتات النحاس، بسهولة أكبر من أكاسيد النحاس.[24][25] إنّ وجود مستويات مرتفعة من الزنك الغذائي، وكذلك الكادميوم، وتناول كميات كبيرة من السميات والسكريات البسيطة (الفركتوز، السكروز) تمنع امتصاص الغذاء من النحاس.[26][27][28][29][30][31] علاوةً على ذلك، تمنع المستويات المنخفضة من النحاس امتصاص الحديد.[32] [33]
بعض أشكال النحاس ليست قابلة للذوبان في أحماض المعدة ولا يمكن امتصاصها من المعدة أو الأمعاء الدقيقة. أيضًا، قد تحتوي بعض الأطعمة على ألياف ترتبط بالنحاس وغير قابلة للهضم . يمكن لمدخول عالي من الزنك أن يقلل بشكل كبير من امتصاص النحاس. كما يمكن أن يؤثر مدخول الكبير من فيتامين ج أو الحديد على امتصاص النحاس، مما يذكرنا بحقيقة أنه يجب استهلاك المغذيات الدقيقة كمزيج متوازن. هذا هو أحد الأسباب التي تجعل تناول كميات كبيرة من المغذيات الدقيقة لا ينصح به.[34] قد يكون الأفراد الذين يعانون من مشاكل مزمنة في الجهاز الهضمي غير قادرين على امتصاص كميات كافية من النحاس، على الرغم من أن الأطعمة التي يتناولونها غنية بالنحاس.
تم تحديد العديد من ناقلات النحاس التي يمكنها نقل النحاس عبر أغشية الخلايا.[35][36] قد توجد ناقلات نحاس أخرى خاصة بالأمعاء. يمكن تحفيز امتصاص النحاس في الأمعاء بواسطة Ctr1. ظهر Ctr1 في جميع أنواع الخلايا التي تم فحصها حتى الآن، بما في ذلك الخلايا المعوية، ويحفز نقل Cu+1 عبر غشاء الخلية.[37]
يمكن ربط الفائض من النحاس (وكذلك أيونات المعادن الثقيلة الأخرى مثل الزنك أو الكادميوم) بالميتالوثيونين واحجازه داخل الحويصلات الخلوية للخلايا المعوية (أي الخلايا السائدة في بطانة الأمعاء).
التوزع
ينتقل النحاس المُفرز من خلايا الأمعاء إلى الشعيرات الدموية المصلية (أي في الغشاء الرقيق المغلف للأمعاء) حيث يرتبط بالألبومين والجلوتاثيون والأحماض الأمينية في الدم البابي.[38][39] هناك أيضًا دليل على وجود بروتين صغير يسمى transcuprein له دور محدد في نقل النحاس في البلازما.[40] قد تشارك العديد من أو جميع هذه الجزيئات المرتبطة بالنحاس في نقل النحاس في الدم. يؤخذ النحاس الموجود في الدوران البابي بشكل أساسي عن طريق الكبد. عندما يصبح في الكبد، يتم دمج النحاس في البروتينات التي تحتاج النحاس، والتي تُفرز لاحقًا في الدم. معظم النحاس (70 – 95%) الذي يفرغه الكبد يكون مدمجاً مع السيرولوبلازمين، وهو الناقل الرئيسي للنحاس في الدم. يتم نقل النحاس إلى الأنسجة خارج الكبد عن طريق السيرولوبلازمين،[41] أو الألبومين أوالأحماض الأمينية، أو يُفرغ في الصفراء.[3] يسيطر الكبد على النحاس الموجود خارجه عن طريق تنظيم إفرازه.[11]
الإفراغ
تعتبر الصفراء المسار الرئيسي لإفراغ النحاس، وهي ذات أهمية حيوية في التحكم في مستوى النحاس في الكبد.[42][43][44] ينتج معظم النحاس الموجود في البراز من الإفراز الصفراوي. أما الباقي فمصدره النحاس غير الممتص والخلايا المتقشرة من البطانة المخاطية.
| نطاق الجرعة | المدخول اليومي التقريبي | النتائج الصحية |
|---|---|---|
| الموت | ||
| عجز وظيفي كلي واضطراب التمثيل الغذائي للمغذيات الأخرى.
ارتفاع شديد في عملية "إزالة السموم" وتنظيم الاستتباب في الكبد | ||
| سام | >5.0 ملغم / كغم من وزن الجسم | تنشيط الميتالوثيونين في الجهاز الهضمي (مع اختلاف الآثار الناتجة حسب كون التعرض مزمن أم
حاد) |
| 100 ميكروغرام / كغم من وزن الجسم | الحفاظ على الحد الأقصى من الامتصاص؛ تقوم آليات الاستتباب بتنظيم امتصاص النحاس | |
| مناسب | 34 ميكروغرام / كغم من وزن الجسم | امتصاص كبدي، احتجاز وإفراغ تحت تأثير الاستتباب. امتصاص الجلوتاثيون المعتمد على النحاس؛ الارتباط بالميتالوثونين؛ وإفراغ النحاس عن طريق الجسيم الحال |
| 11 ميكروغرام / كغم من وزن الجسم | الإفراغ الصفراوي والامتصاص الهضمي في حالة طبيعية | |
| 9 ميكروغرام / كغم من وزن الجسم | خفض التخزين في الكبد؛ حفظ النحاس الداخلي؛ زيادة الامتصاص عبر الجهاز الهضمي | |
| منخفض | 8.5 ميكروغرام / كغم من وزن الجسم | توزان سلبي للنحاس |
| 5.2 ميكروغرام / كغم من وزن الجسم | اضطرابات وظيفية مثل انخفاض نشاط أُكسيدازُ اللِّيزيل وسوبر أكسيد ديسميوتاز؛ ضعف التمثيل الغذائي للركيزة | |
| 2 ميكروغرام / كغم من وزن الجسم | تعطل الاوعية الطرفية؛ عجز وظيفي كلي واضطراب التمثيل الغذائي للمغذيات الأخرى؛ موت |
التوصيات الغذائية
لدى العديد من المنظمات الوطنية والدولية المعنية بالتغذية والصحة معايير لمستوى مدخول النحاس بحيث يُعتبر كافي للمحافظة على صحة جيدة. يتم تغيير هذه المعايير وتحديثها دوريًا مع توفر بيانات علمية جديدة. والمعايير في بعض الأحيان تختلف بين البلدان والمنظمات.
البالغين
توصي منظمة الصحة العالمية بالحد الأدنى من المدخول المقبول به بحوالي 1.3 ملغ / يوم.[46] تعتبر هذه القيم كافية وآمنة لمعظم الأفراد. في أمريكا الشمالية، قام معهد الطب في الولايات المتحدة بإقرار المُخصص اليومي المُحبذ للنحاس للرجال والنساء الأصحاء عند 0.9 ملغ / يوم.[47][48] يقوم معهد الطب في الولايات المتحدة أيضاً بتحديد المستوى الأقصى المقبول للفيتامينات والمعادن عندما تكون هناك أدلة كافية من أجل الحفاظ على السلامة. في حالة النحاس، تم تحديد المستوى الأقصى المقبولعند 10 ملغ / يوم.[48] راجعت الهيئة الأوروبية لسلامة الأغذية موضوع السلامة نفسه وحددت المستوى الأقصى عند 5 ملغ / يوم.[49]
المراهقين، والأطفال، والرضع
لم تضع منظمة الصحة العالمية الحد الأدنى من المدخول اليومي للنحاس لهذه الفئات العمرية. في أمريكا الشمالية، يُلاحظ أن المُخصص اليومي المُحبذ كما يلي: 0.34 ملغ/ يوم للأطفال من 1 إلى 3 سنوات؛ 0.44 ملغ / يوم للأعمار 4 إلى 8 سنوات؛ 0.7 مغ / يوم للأعمار 9-13 سنة؛ و 0.89 ملغ / يوم للأعمار 14-18 سنة. والمستوى الأقصى المقبول: 1 مغ / يوم للأطفال من 1 إلى 3 سنوات؛ 3 مغ / يوم للأعمار 4 - 8 سنوات؛ 5 ملغ / يوم للأعمار 9-13 سنة؛ و 8 ملغ / يوم للأعمار 14-18 سنة.[47][48]
إن الرضع المولودين مكملي شهور الحمل والخُدج أكثر حساسية لنقص النحاس من البالغين. بما أن الجنين يُراكم النحاس خلال الأشهر الثلاثة الأخيرة من الحمل، فإن الرضع الذين يولدون قبل الأوان لم يكن لديهم الوقت الكافي لتخزين ما يكفي من النحاس في أكبادهم، وبالتالي يحتاجون إلى المزيد من النحاس عند الولادة من الرضع كاملي النمو.[50]
وبالنسبة للرضع كاملي النمو، فإن المدخول الآمن والكافي من النحاس حوالي 0.2 مغ / يوم في أمريكا الشمالية. أما بالنسبة للأطفال الخُدج، فإنه أعلى بشكل ملحوظ: 1 مغ / يوم. أوصت منظمة الصحة العالمية بالحد الأدنى من المدخول المناسب، وتنصح بأن يعطى الخدج حليب مدهم بنحاس إضافي لمنع تطور نقص النحاس.[34]
النساء الحوامل والمرضعات
في أمريكا الشمالية، وضع معهد الطب في الولايات المتحدة المُخصص اليومي المُحبذ لفترة الحمل ما مقداره 1.0 ملغ / يوم وللإرضاع 1.3 ملغ / يوم.[48] تُعرف الهيئة الأوروبية لسلامة الأغذية مجموعات البيانات مثل القيم الغذائية المرجعية، بأنها المتناول المرجعي للأفراد بدلاً من المُخصص اليومي المُحبذ. حيث المتناول المرجعي للأفراد في فترة اللحمل هو 1.6 ملغ / يوم، وللإرضاع 1.6 ملغم / يوم - وهذا أعلى من قيم المُخصص اليومي المُحبذ الأمريكية.[51]
مصادر الطعام

النحاس هو معدن أساسي شحيح لا يمكن تشكيله في جسم الإنسان. يجب ابتلاعه من مصادره الغذائية.
تساهم الأطعمة تقريبًا بكل النحاس المستهلك من البشر.[52][53][54] تتضمن أفضل المصادر الغذائية المأكولات البحرية (خاصة المحار)، ولحوم الأعضاء (مثل الكبد)، والحبوب الكاملة، والبقوليات (مثل الفاصولياء والعدس)، والشوكولاتة. المكسرات، بما في ذلك الفول السوداني والجوز، غنية بشكل خاص بالنحاس، وكذلك الحبوب مثل القمح والجاودار، والعديد من الفواكه بما في ذلك الليمون والزبيب. المصادر الغذائية الأخرى التي تحتوي على النحاس تشمل الحبوب، والبطاطا، والبازلاء واللحوم الحمراء والفطر وبعض الخضار الورقية الخضراء الداكنة (مثل اللفت)، والفواكه (جوز الهند، والبابايا، والتفاح). يحتوي الشاي، والأرز، والدجاج، على نسب منخفضة من النحاس، ولكن يمكن أن توفر كمية معقولة من النحاس عندما يتم استهلاكها بكميات كبيرة.[55]
إن تناول نظام غذائي متوازن يحوي مجموعة من الأطعمة من مجموعات غذائية مختلفة هو أفضل طريقة لتجنب نقص النحاس. في كل من البلدان المتقدمة والنامية، البالغون والأطفال الصغار والمراهقون الذين يستهلكون تظام غذائي مكون من الحبوب أو الدخن أو الدرنات أو الأرز مع البقوليات (الفول) أو كميات صغيرة من الأسماك أو اللحوم وبعض الفواكه والخضروات وبعض الزيوت النباتية من المحتمل أن يحصلوا على كميات كافية من النحاس إذا كان استهلاكهم الغذائي مناسبًامن حيث السعرات الحرارية. في البلدان المتقدمة حيث استهلاك اللحوم الحمراء مرتفع، من المرجح أيضًا أن يكون مدخول النحاس كافيًا.[56]
يوجد النحاس في معظم المياه السطحية والمياه الجوفية في العالم كعنصر طبيعي في القشرة الأرضية، على الرغم من أن التركيز الفعلي للنحاس في المياه الطبيعية يختلف جغرافيًا. يمكن أن تحتوي مياه الشرب على 20-25٪ من النحاس الغذائي.[57]
يمكن أن تكون أنابيب النحاس التي تنقل مياه الشرب مصدرًا للنحاس الغذائي في العديد من مناطق العالم. أنبوب النحاس يمكن أن يرشح منه كمية صغيرة من النحاس، خاصة في السنتين الأولى والثانية من الخدمة. بعد ذلك، يتشكل سطح واقي عادة في داخل أنابيب النحاس مما تؤخر الارتشاح.
المكملات
يمكن أن تمنع مكملات النحاس نقصه، ولكن يجب أن تؤخذ المكملات الغذائية فقط تحت إشراف الطبيب. يوجد أشكال مختلفة من مكملات النحاس بمعدلات امتصاص مختلفة. على سبيل المثال، امتصاص النحاس من مكملات أكسيد الحديد هو أقل من امتصاصه من غلوكونات النحاس أو الكبريتات أو الكربونات.
لا ينصح عمومًا بتناول المكملات الغذائية للبالغين الأصحاء الذين يستهلكون نظامًا غذائيًا متوازنًا يتضمن مجموعة مختلفة من الأطعمة. ومع ذلك، قد تكون المكملات تحت رعاية الطبيب ضرورية للخدج أو الذين لديهم أوزان منخفضة للولادة، أو الرضع الذين يتلقون حليب صناعي غير مدعم أو حليب البقر خلال السنة الأولى، والأطفال الصغار الذين يعانون من سوء التغذية. يمكن للأطباء النظر في إضافة النحاس للدوافع التالية 1) الأمراض التي تقلل الهضم (على سبيل المثال، الأطفال الذين يعانون من الإسهال المتكرر أو العدوى؛ والكحولية)، 2) استهلاك كميات غير كافية من الطعام (على سبيل المثال، في حالات كبار السن، والمرضى، وأولئك الذين يعانون من اضطرابات الأكل أو الذين يتبعون حميات غذائية)، 3) المرضى الذين يتناولون أدوية تمنع استخدام الجسم للنحاس، 4) مرضى فقر الدم الذين يعالجون بمكملات الحديد، 5) أي شخص يتناول مكملات الزنك، و 6) أولئك الذين يعانون من مرض هشاشة العظام.
وتحتوي العديد من مكملات الفيتامينات الشائعة على النحاس كجزيئات غير عضوية صغيرة مثل أكسيد الحديد. هذه المكملات يمكن أن تؤدي إلى زيادة النحاس الحر في الدماغ حيث يمكن أن يعبر النحاس الحاجز الدموي الدماغي مباشرة. عادة، يتم معالجة النحاس العضوي في الغذاء أولاً في الكبد الذي يحافظ على مستويات النحاس الحر تحت السيطرة.[58]
نقص النحاس وحالات زيادته (غير الوراثية)
إذا تم تناول كميات غير كافية من النحاس، فستنفد مخازن النحاس في الكبد وسيؤدي نقص النحاس إلى المرض أو إصابة الأنسجة (وفي الحالات الشديدة، الوفاة). يمكن معالجة السمية الناتجة عن نقص النحاس بنظام غذائي متوازن أو بالمكملات تحت إشراف الطبيب. على العكس، مثل جميع المواد، يمكن أن يصبح تناول النحاس بكميات كبيرة وأعلى بكثير مما حددته منظمة الصحة العالمية سامًا.[59] ترتبط سمية النحاس الحادة عمومًا بابتلاعه غير المقصود. وهذه الأعراض تهدأ عند التوقف عن ابتلاع مصادره الغذائية التي تحتوي نسبة عالية منه.
في عام 1996، ذكر البرنامج الدولي للسلامة الكيميائية، وهي وكالة مرتبطة بمنظمة الصحة العالمية، أن «المخاطر الصحية الناجمة عن نقص استهلاك النحاس أكثر خطورة من تناول كمية كبيرة من النحاس». تم تأكيد هذا الاستنتاج في استطلاعات عدة وباستخدام طرق مختلفة للتعرض للنحاس.[53][60]
الشرح أدناه هو لحالات نقص النحاس غير الوراثي وزيادته.
نقص النحاس
هناك تقارير متضاربة حول مدى حدوث النقص في الولايات المتحدة. وتشير مراجعة واحدة إلى أن 25٪ تقريبًا من المراهقين والبالغين والأشخاص فوق 65 عامًا لا يحصلون على المخصص اليومي المحبذ للنحاس.[7] ويقول مصدر آخر أقل شيوعًا: قرر المسح الفيدرالي لاستهلاك الغذاء أنه بالنسبة للنساء والرجال فوق سن التاسعة عشر، بلغ متوسط الاستهلاك للنحاس من الأطعمة والمشروبات 1.11 و 1.54 ملغم / يوم، على التوالي. بالنسبة للنساء، استهلك 10٪ منهن أقل من متوسط الاحتياجات المقدرة، وللرجال أقل من 3٪.[61]
ظهر نقص النحاس المكتسب مؤخرًا في اعتلال النخاع الشوكي التنكسي عند البالغين[62] وفي اضطرابات الدم الشديدة بما في ذلك متلازمة خلل التنسج النقوي.[8][63][64] لحسن الحظ، يمكن التأكد من نقص النحاس من خلال وجود تراكيز منخفضة من النحاس في مصل الدم ومن السيرولوبلازمين في الدم.
ومن الحالات الأخرى المرتبطة بنقص النحاس: هشاشة العظام، والفصال العظمي، والتهاب المفاصل الروماتويدي، وأمراض القلب والأوعية الدموية، وسرطان القولون، والحالات المزمنة التي تشمل العظم والنسيج الضام والقلب والأوعية الدموية. والجهاز العصبي وجهاز المناعة.[7][65][66][67][68] يغير نقص النحاس دور المكونات الخلوية الأخرى المشاركة في نشاط مضادات الأكسدة، مثل الحديد والسيلينيوم والغلوتاثيون، وبالتالي يلعب دورًا مهمًا في الأمراض التي يرتفع فيها الإجهاد التأكسدي. يعتقد أن نقص النحاس الخفيف أكثر انتشارًا مما كان يعتقد سابقًا، ويمكن أن يضعف صحة الإنسان بطرق خفية.[3][9][57][66][69][70]
تشمل مجموعات الأفراد المعرضة لنقص النحاس الأشخاص الذين يعانون من عيوب مرض مينكيس الوراثية، والرضع منخفضي وزن الولادة، والرضع الذين يرضعون حليب البقر بدلا من حليب الثدي أو الحليب الصناعي المُدعم، والأمهات الحوامل والمرضعات، والمرضى الذين يتلقون التغذية بالحقن، والأفراد الذين يعانون من «متلازمة سوء الامتصاص»(ضعف امتصاص الغذاء)، ومرضى السكري، والأفراد الذين يعانون من الأمراض المزمنة التي تؤدي إلى انخفاض استهلاك الغذاء، مثل الكحوليين، والأشخاص الذين يعانون من اضطرابات الأكل. قد يكون كبار السن والرياضيون أكثر عرضة لنقص النحاس بسبب احتياجاتهم الخاصة التي تزيد من المتطلبات اليومية.[31] قد يقل مدخول النحاس عند النباتيين بسبب استهلاك الأطعمة النباتية التي ينخفض فيها النحاس.[28][71][72] يزيد خطر حدوث وزن الولادة المنخفض وضعف العضلات ، والمشاكل العصبية في الأجنة والرضع الذين تعاني أمهاتهم من نقص النحاس. قد يؤدي نقص النحاس في هذه المجموعات إلى حدوث فقر دم، أو تشوهات في العظام، أو ضعف النمو، أو زيادة الوزن، أو عدوى متكررة (نزلات البرد، أو الأنفلونزا، أو الالتهاب الرئوي)، أو ضعف التنسيق الحركي، أو انخفاض الطاقة.
فرط النحاس
فرط النحاس هو موضوع لكثير من البحوث الحالية. لقد برزت من تلك الدراسات العديد من الفروقات التي تفيد بأن عوامل حدوث فرط النحاس تختلف بين الأفراد الطبيعيين وأولئك الذين لديهم قابلية متزايدة للآثار الضائرة والذين يعانون من أمراض وراثية نادرة.[9][57] وقد أدى ذلك إلى تصريحات من منظمات صحية يمكن أن تكون مربكة للغير مطلعين. على سبيل المثال، وفقًا لتقرير معهد الطب الأمريكي،[48] فإن نسبة كبيرة من السكان يتناولون النحاس بكمية أقل من الموصى بها. من ناحية أخرى، خلص المجلس القومي للبحوث في الولايات المتحدة[73] في تقريره «النحاس في مياه الشرب» إلى أن هناك مخاوف من سُمية النحاس في المجموعات السكانية الحساسة، وأوصى بإجراء بحث إضافي لتحديد وتمييز المجموعات الحساسة للنحاس.
زيادة تناول النحاس يسبب اضطراب في المعدة، وغثيان، وإسهال ويمكن أن يؤدي إلى إصابة الأنسجة والمرض.
قد تكون قدرة النحاس على الأكسدة مسؤولة عن بعض سُميتها في حالات الافراط في تناوله. عند وجود تركيز عالي من النحاس، من المعروف أنه ينتج تلفًا تأكسديًا للأنظمة البيولوجية، بما في ذلك فوق أكسدة الليبيدات أو الجزيئات الضخمة الأخرى.[74]
في حين أن سبب وآلية تطور مرض الزهايمر غير مفهومة جيدًا، تشير الأبحاث إلى أنه، ومن بين العديد من الملاحظات الرئيسية الأخرى، يتراكم الحديد،[75][76] والألمنيوم،[77] والنحاس[78][79] في أدمغة مرضى الزهايمر. ومع ذلك، لم يعرف بعد ما إذا كان هذا التراكم هو سبب أو نتيجة للمرض.
ظلت الأبحاث مستمرة على مدى العقدين الماضيين لتحديد ما إذا كان النحاس مسبباً أو عاملاً وقائياً لمرض الزهايمر. على سبيل المثال، كعامل مسبب محتمل أو أحد أشكال اضطراب استتباب المعادن، تشير الدراسات إلى أن النحاس قد يلعب دورًا في زيادة نمو تجمعات البروتين في أدمغة مرضى الزهايمر،[80] ربما عن طريق إتلاف الجزيء الذي يزيل التراكم السام للأميلويد بيتا في الدماغ.[81] هناك علاقة بين النظام الغذائي الغني بالنحاس والحديد والدهون المشبعة من ناحية ومرض الزهايمر من ناحية أخرى.[82] من ناحية أخرى، تظهر الدراسات أيضًا الأدوار المفيدة المحتملة للنحاس في كونه علاجًا بدلاً من التسبب بمرض الزهايمر.[83] على سبيل المثال، ظهر أن النحاس يعمل على 1) تعزيز المعالجة الغير نشوانية للبروتين السلف للبيتا أميلويد (APP)، وبالتالي خفض إنتاج بيتا أميلويد (Aβ) في أنظمة زرع الخلايا [84][85] 2) زيادة عمر وتقليل إنتاج الأميلويد القابل للذوبان في الفئران المعدلة وراثيًا، و 3) انخفاض مستوى البيتا أميلويد في السائل الدماغي الشوكي في مرضى الزهايمر.[86]
وعلاوةً على ذلك، تم استبعاد استخدام النحاس كعلاج طويل الأمد (تناول 8 ملغ من النحاس (Cu-(II)-orotate-dihydrate) عن طريق الفم) كعامل خطر لمرض الزهايمر في تجربة سريرية مشهورة على البشر[87] وقد ثبت وجود دور مفيد للنحاس في مرض الزهايمر من خلال مستويات السائل الدماغي الشوكي من Aβ42، وهو الببتيد السام والعلامة الحيوية للمرض.[88] هناك حاجة إلى مزيد من البحوث لفهم اضطرابات استتباب المعادن في مرضى الزهايمر وكيفية معالجة هذه الاضطرابات. وبما أن هذه التجربة استخدمت Cu- (II) -orotate-dihydrate، فإنه لا تشير إلى تأثير أكسيد النحاس الموجود في المكملات.[89]
سُمية النحاس الناتجة عن زيادة التعرض له
في البشر، الكبد هو العضو الأساسي لسمية النحاس. وتشمل الأعضاء المستهدفة الأخرى العظام والجهاز العصبي المركزي والجهاز المناعي.[9] يحفز استهلاك النحاس الزائد التسمم بشكل غير مباشر من خلال التفاعل مع العناصر الغذائية الأخرى. على سبيل المثال، يسبب تناول النحاس الزائد فقر الدم عن طريق التدخل في نقل الحديد و / أو التمثيل الغذائي له.[3][9]
أدى تحديد اضطرابات استقلاب النحاس الوراثية المؤدية إلى سمية النحاس الشديدة (أي مرض ويلسون) إلى إجراء بحوث في علم الوراثة الجزيئي وعلم الأحياء حول استتباب النحاس (لمزيد من المعلومات، يرجى الرجوع إلى القسم التالي حول الأمراض النحاس الوراثية). وقد كان موضع اهتمام متمركزًا حول العواقب المحتملة لسمية النحاس في السكان الطبيعيين والذين يمكن أن يكونوا عرضة للإصابة. وتشمل المجموعات السكانية المعرضة للخطر مرضى غسيل الكلى والأفراد المصابين بأمراض الكبد المزمنة. في الآونة الأخيرة، ظهر اهتمام حول الحساسية المحتملة لأمراض الكبد عند الأفراد الحاملين لزيجوت متغايرة الألائل لمرض ويلسون الوراثي (أي أولئك الذين لديهم جين طبيعي وجين متحور لمختصر الأتباز المسبب لمرض ويلسون) ولكن الذين لا يعانون من المرض (حيث يتطلب عيوب في كلا الجينين).[90] ومع ذلك، لا تتوفر حتى الآن أي بيانات تدعم أو تفند هذه الفرضية.
التعرض الحاد
لوحظ تطور في الأعراض بما في ذلك ألم البطن، والصداع، والغثيان، والدوخة، والقيء، والإسهال، وتسرع القلب، وصعوبة في التنفس، وفقر الدم الانحلالي، والبيلة الدموية، ونزيف هائل في الجهاز الهضمي، والفشل الكلوي والكبدي، والموت، في تقارير عن أفراد ابتلعو عن قصد أو عن غير قصد تركيزات عالية من أملاح النحاس (حيث لا تكون الجرعات معروفة عادة ولكن سُجلت من 20–70 جرام من النحاس). .
تتميز نوبات الاضطراب الهضمي الحاد بعد ابتلاع مفرد أو متكرر لمياه الشرب التي تحتوي على مستويات مرتفعة من النحاس (عادة ما تكون أعلى من 3–6 ملغ / لتر) بالغثيان والقيء وتهيّج المعدة. تزول هذه الأعراض عندما يتم تقليل النحاس في مصدر مياه الشرب.
أجريت ثلاث دراسات تجريبية تُظهِر عتبة الاضطراب الهضمي الحاد بما يقرب من 4–5 ملغم / لتر لدى البالغين الأصحاء، على الرغم من أنه ليس من الواضح من هذه النتائج ما إذا كانت الأعراض ناجمة عن تأثيرات مهيجة شديدة من النحاس و / أو من الطعم المعدني المرير المالح.[91][92][93][94] في دراسة تجريبية للبالغين الأصحاء، بلغ متوسط عتبة التذوق لكبريتات وكلوريد النحاس في ماء الصنبور، أو الماء منزوع الأيونات، أو المياه المعدنية حوالي 2.5–3.5 ملغم / لتر.[95] وهذا أقل بقليل من العتبة التجريبية للاضطراب الهضمي الحاد.
التعرض المزمن
لم يتم دراسة سمية النحاس على المدى الطويل بشكل جيد عند البشر، ولكنها نادرة في السكان الطبيعيين الذين لا يعانون من خلل وراثي في استتباب النحاس.[96]
هناك أدلة قليلة تشير إلى أن التعرض المزمن للنحاس يؤدي إلى تأثيرات جهازية غير إصابة الكبد.[73] تم الإبلاغ عن التسمم المزمن بالنحاس المؤدي إلى قصور الكبد لدى شاب بالغ دون وجود حساسية وراثية معروفة حيث استهلك 30–60 ملغ / اليوم من النحاس كمكمل معدني لمدة 3 سنوات.[97] الأفراد في الأسر الأمريكية الموردة بماء الصنبور المحتوي على أكثر من 3 ملغم / لتر من النحاس لم تظهر عليها أي آثار صحية ضارة.[98]
لم يُلاحظ أي آثار لمكملات النحاس على إنزيمات الكبد المصلية -المؤشرات الحيوية للإجهاد التأكسدي- وغيرها من النقاط الكيميائية الحيوية في المتطوعين الشباب الأصحاء الذين يعطون جرعات يومية من 6 إلى 10 ملغم / اليوم من النحاس لمدة تصل إلى 12 أسبوعًا.[99][100][101][102] الرضع الذين تتراوح أعمارهم بين 3-12 شهرًا واستهلكوا مياه تحتوي على 2 ملغم نحاس /لتر لمدة 9 أشهر لم تختلف في أعراض الجهاز الهضمي، ومعدل النمو، والمراضة، وإنزيم الكبد المصلي ومستويات البيليروبين، وغيرها من نقاط الكيميائية الحيوية.[103]) كان السيرولوبلازمين المصلي مرتفعًا بشكل مؤقت في مجموعة الرضع المعرضة لمدة 9 أشهر ويشبه المجموعة المقابلة المعرضة لمدة 12 شهرًا، مما يشير إلى التكيف الاستتبابي و / أو نضوج الاستجابة.[8]
لم يرتبط التعرّض عن طريق الجلد بالسمية الجهازية، لكن تفيد التقارير السردية بوجود استجابة تحسسية ضد النيكل والتفاعل المتصالب مع النحاس أو تهيج الجلد من النحاس.[9] يبرز عند العمال الذين تعرضوا لمستويات عالية من النحاس (مما أدى إلى تناول كمية مقدرة بـ 200 ملغم Cu / د) علامات تشير إلى سمية النحاس (على سبيل المثال، ارتفاع مستويات النحاس في الدم، تضخم الكبد). ومع ذلك، قد تسهم حالات أخرى من التعرّض لمبيدات الآفات أو التعرض في عمليات التعدين والصهر في هذه التأثيرات.[9]
معايير حالة النحاس المرتفعة
على الرغم من وجود عددٍ من المؤشرات المفيدة في تشخيص نقص النحاس، فلا توجد مؤشرات حيوية موثوقة لزيادة النحاس في المدخول الغذائي. المؤشر الأكثر موثوقية لزيادة النحاس هو تركيز النحاس في الكبد. ومع ذلك، فإن قياس هذه النقطة عند الإنسان البشر استقضائية ولا يتم إجراؤها عمومًا إلا في حالات الاشتباه بتسمم بالنحاس. لا ترتبط مستويات المرتفعة من النحاس أو السيرولولاسين المصلي بشكل موثوق بسُمية النحاس، حيث يمكن أن يحدث ارتفاع في التركيز عن طريق الالتهاب والعدوى والمرض والأورام الخبيثة والحمل وغيرها من عوامل الإجهاد البيولوجية. تختلف مستويات الإنزيمات المحتوية على النحاس، مثل سيتوكروم سي أوكسيداز، وفوق أكسيد الدسموتاز، ودايميناز أكسيداز، ليس فقط في الاستجابة لحالة النحاس ولكن أيضًا في الاستجابة لمجموعة متنوعة من العوامل الفيزيولوجية والبيوكيميائية الأخرى، وبالتالي فهي علامات متناقضة لزيادة النحاس.[104]
وقد ظهر في السنوات الأخيرة مرشح كمؤشر حيوي جديد لفائض النحاس ونقصه. هذا المؤشر المحتمل هو عبارة عن بروتين تشابيرن، والذي يسلم النحاس للبروتين المضاد للأكسدة فوق أكسيد الدسموتاز 1 (SOD1) (فوق أكسيد الدسموتاز بالزنك والنحاس). يطلق عليه «تشابيرون النحاس لـ (CCS)» (SOD1)، وتدعم بيانات حيوانية ممتازة استخدامه كمؤشر لنقص النحاس وزيادته في الخلايا التي يمكن الوصول إليها (مثل كريات الدم الحمراء). يجري اختبار CCS حاليًا كمؤشر حيوي لدى البشر.[105]
أمراض أيض النحاس الوراثية
ترتبط العديد من الأمراض الوراثية النادرة (داء ويلسون، ومرض مينكس، والتسمم بالنحاس مجهول السبب، تشمع كبد الأطفال الهنود) بالاستخدام غير المناسب للنحاس في الجسم.[106] تنطوي كل هذه الأمراض على طفرات في الجينات التي تحتوي على الشفرات الوراثية لإنتاج بروتينات محددة تشارك في امتصاص وتوزيع النحاس. عندما تكون هذه البروتينات معطوبة، فإن النحاس إما يتراكم في الكبد أو يفشل الجسم في امتصاص النحاس.
هذه الأمراض موروثة ولا يمكن اكتسابها. تعديل مستوى النحاس في النظام الغذائي أو مياه الشرب لن يعالج هذه الأمراض (على الرغم من العلاجات المتاحة لعلاج أعراض مرض فائض النحاس الوراثي).
تُمكّن دراسة أمراض أيض النحاس الوراثية والبروتينات المرتبطة بها العلماء من فهم كيفية استخدام الجسم البشري للنحاس، ولماذا هي مهمة كمغذيات دقيقة أاساسية.
تنشأ الأمراض من عيوب في مضختي نحاس متشابهتين، وهما مضخة منيكس ومضخة ويلسون لمختصر الأتباز النحاسي (Cu-ATPases).[8] يتم التعبير عن مضخة مينكس في أنسجة مثل الخلايا الليفية اليافعة لبناء الجلد، والكلى، والمشيمة، والدماغ، والجهاز الهضمي والأوعية الدموية، في حين يتم التعبير مضخة ويلسون أساسًا في الكبد، ولكن أيضًا في الغدد الثديية وربما في الأنسجة المتخصصة الأخرى.[9] تقود هذه المعرفة العلماء نحو العلاجات الممكنة لأمراض النحاس الوراثية.[59]
مرض مينكس
وُصِف مرض مينكس، وهو حالة وراثية لنقص النحاس، لأول مرة من قبل جون مينكس في عام 1962. وهو اضطراب نادر مرتبط بكرموسوم X ويؤثر على ما يقرب من 1,000,000 مولود حي، معظمهم من الأولاد.[7] لا يستطيع الكبد في مرضى مينكس امتصاص النحاس الأساسي اللازم للمرضى للبقاء على قيد الحياة. يتوفى المريض عادة في مرحلة الطفولة المبكرة: حيث يموت معظم الأفراد المصابين قبل عمر 10 سنوات، على الرغم من بقاء العديد من المرضى حتى سن المراهقة وأوائل العشرينات.[107]
البروتين الذي ينتجه جين مينكس هو المسؤول عن نقل النحاس عبر القناة الهضمية والحاجز الدموي الدماغي.[8][107] الطفرة في الجينات التي تشفر أتباز النحاس تبقي النحاس محاصراً في بطانة الأمعاء الدقيقة. وبالتالي، لا يمكن ضخ النحاس من الخلايا المعوية إلى الدم لنقله إلى الكبد وبالتالي إلى بقية الجسم.[107][108] وبالتالي يشبه المرض النقص الغذائي الشديد في النحاس على الرغم من الابتلاع الكافي للنحاس.
وتشمل أعراض المرض الشعر الخشن الجاف ناقص الصبغة، وغيره من مشاكل حديثي الولادة، بما في ذلك عدم القدرة على التحكم في درجة حرارة الجسم، والتخلف العقلي، والعيوب الهيكلية، ونمو الأنسجة الضامة غير الطبيعية.[109]
يظهر على مرضى مينكس اضطرابات عصبية حادة، على ما يبدو بسبب عدم وجود العديد من الأنزيمات المعتمدة على النحاس اللازمة لنمو الدماغ،[57][110] بما في ذلك انخفاض نشاط سيتوكروم سي أكسيداز.[107] يرجع الشعر الهش، ناقص الصبغة ذو المظهر المجعد، إلى قصور في انزيم نحاسي غير معروف. وينتج عن انخفاض نشاط أُكسيداز الليزيل حدوث خلل في الكولاجين والإيلاستين وخلل في النسيج الضام بما في ذلك أم الدم الأبهرية، والجلد الرخو، والعظام الهشة.
مع التشخيص المبكر والعلاج الذي يتكون من حقن يومية من مادة الهيستدين النحاسيية التي تُعطى داخل الصفاق وداخل القراب في الجهاز العصبي المركزي، حيث تمكن هذه الحقن من تجنب بعض المشاكل العصبية الشديدة والبقاء على قيد الحياة لفترة طويلة. ومع ذلك، يحتفظ مرضى مينكس باضطرابات غير طبيعية في العظام والنسيج الضام ويظهر عليهم تخلف عقلي خفيف إلى حاد.[108] حتى مع التشخيص المبكر والعلاج، فإن مرض مينكس يكون مميتًا في الغالب.
يؤدي البحث المستمر في مرض مينكس إلى فهم أكبر لاستتباب النحاس،[79] والآليات البيوكيميائية المعنية بالمرض، والطرق الممكنة لعلاجه.[111] تم تصميم الفحوصات لبحث نقل النحاس عبر الحاجز الدموي الدماغي، والتي تستند إلى دراسات أجريت على فئران معدلة وراثيًا، لمساعدة الباحثين على فهم السبب الأساسي لنقص النحاس في مرض مينكس. يتم تغيير التركيب الجيني «للفئران المعدلة جينيًا» بطرق تساعد الباحثين على اكتساب وجهات نظر جديدة حول نقص النحاس. لقد كان البحث حتى الآن قيمًا: يمكن «إيقاف» الجينات تدريجياً لاستكشاف درجات متفاوتة من نقص النحاس.
كما لاحظ الباحثون في أنابيب اختبار أن الحمض النووي التالف في خلايا مريض مينكس يمكن إصلاحه. في الوقت المناسب، يمكن العثور على الإجراءات اللازمة لإصلاح الجينات التالفة في جسم الإنسان.
داء ويلسون
مرض ويلسون هو اضطراب وراثي صبغي جسمي نادر متنحٍ (محمول على كروموسوم 13) يؤثر على نقل النحاس مما يسبب زيادة في النحاس في الكبد.[79][112][113] وهذا يؤدي إلى تسمم الكبد، من بين أعراض أخرى.[114] ويعتبر المرض قابلًا للعلاج الآن.
ينشأ داء ويلسون عن طريق طفرات في البروتين الذي ينقل النحاس من الكبد إلى الصفراء للإفراز.[79] ينطوي المرض على ضعف دمج النحاس في السيرولوبلازمين وضعف إخراج النحاس في العصارة الصفراوية وعادة ما يحدث هذا بسبب طفرات تضعف وظيفة مضخة ويلسون للنحاس. هذه الطفرات الجينية تؤدي إلى التسمم بالنحاس بسبب تراكم النحاس الزائد، في الغالب في الكبد والدماغ ، وبدرجة أقل، في الكلى والعينين وغيرها من الأعضاء.[115]
يصيب هذا المرض حوالي 1 / 30.000 رضيعًا من كلا الجنسين،[9] وقد يصبح سريريًا واضحًا في أي وقت من الرضاعة إلى المراحل الأولى للبلوغ. يتراوح عمر بداية مرض ويلسون من 3 إلى 50 عامًا. تشمل الأعراض الأولية وجود اضطرابات في الكبد أو الجهاز العصبي أو الأمراض النفسية، ونادراً ما توجد أعراض في الكلى أو الجهاز الهيكلي أو الغدد الصماء. يتطور المرض مع تعميق اليرقان وتطور اعتلال دماغي، واضطرابات شديدة في التخثر، ترتبط في بعض الأحيان بالتخثر داخل الأوعية، والقصور الكلوي النهائي. يظهر نوع غريب من الرعاش في الأطراف العليا وبطء في الحركة وتغيرات في المزاج. تظهر حلقات كايزر-فلايشر، وتكون بلون بني صدئ في الحواف الخارجية للقزحية بسبب ترسب النحاس في 90٪ من المرضى، مع بدء النحاس في التراكم والتأثير على الجهاز العصبي.[116]
تقريبًا، يتوفى المريض دائمًا إذا لم يتم علاج المرض.[57] لحسن الحظ، فإن تحديد الطفرات في جين «مضخة أتباز ويلسون» الذي ينشأ منه معظم حالات مرض ويلسون، جعلت اختبار الحمض النووي للتشخيص ممكنًا.
إذا تم تشخيص المرض وعلاجه في وقت مبكر بما فيه الكفاية، قد يعيش المرضى الذين يعانون من مرض ويلسون حياة طويلة ومنتجة.[111] يتم معالجة داء ويلسون عن طريق استخدام د-بنيسيلامين (الذي يلتقط ويربط النحاس ويمكّن المرضى من إفراز النحاس الفائض المتراكم في الكبد) فيما يعترف بالعلاج بالاستخلاب، ويمكن العلاج بكبريتات الزنك أو خلات الزنك، وتقييد كمية النحاس في المدخول الغذائي، مثل الابتعاد عن تناول الشوكولاتة والمحار والفطر.[57] يعتبر العلاج بالزنك العلاج المفضل الآن. حيث ينتج الزنك كتلة مخاطية من خلال تنشيط الميتالوثيونين، والذي يقوم بدوره بربط النحاس بخلايا الغشاء المخاطي حتى ينزلق وينتهي في البراز.[117] ويتنافس مع الحديد على الامتصاص في الأمعاء عن طريق بروتين يسمى الناقل المعدني ثنائي التكافؤ (DMT1). في الآونة الأخيرة، أظهرت العلاجات التجريبية التي تستخدم tetrathiomolybdate نتائج واعدة. يبدو أن Tetrathiomolybdate هو شكل ممتاز من العلاج الأولي في المرضى الذين يعانون من أعراض عصبية. على النقيض من العلاج بنسيلامين، نادرًا ما يسمح العلاج الأولي مع tetrathiomolybdate بتدهور عصبي آخر، والذي لا يمكن علاجه في كثير من الأحيان.[118]
تم وصف أكثر من 100 عيوب وراثية مختلفة تؤدي إلى مرض ويلسون وهي متاحة على الإنترنت في . بعض الطفرات لديها طابع جغرافي.[119]
يحمل العديد من مرضى ويلسون طفرات مختلفة على كل كروموسوم 13 (أي أنه مركب متغاير الزيجوت).[57] حتى في الأفراد الذين يحملون طفرات متماثلة الزيجوت، قد يختلف ظهور وشدة المرض.[116][120] الأفراد ذوو الطفرات الحادة متماثلة الزيجوت (على سبيل المثال، تلك التي تقطع البروتين) يبدأ فيها المرض في وقت مبكر. قد تكون شدة المرض أيضًا دالة للعوامل البيئية، بما في ذلك كمية النحاس في النظام الغذائي أو التباين في وظيفة البروتينات الأخرى التي تؤثر على استتباب النحاس.
لقد تم اقتراح أن الطفرات الجينية لمرض ويلسون متغايرة الزيجوت، قد تكون أكثر قابلية لمواجهة كميات مرتفعة من النحاس من عامة الناس.[73] وقد قدر معدل حدوث متغاير الزيجوت بـ 1/90 شخص من إجمالي عدد السكان.[9] ومع ذلك، لا يوجد دليل لدعم هذه التكهنات.[8] علاوة على ذلك، لا تشير مراجعة البيانات حول الأمراض الصبغية الجسمية المتنحية أحادية الأليلات عند البشر إلى احتمال تضرر الحاملين لزيجوت متغاير بشكل سلبي نتيجة حالتهم الوراثية المتغيرة.
متلازمات وراثية أخرى مرتبطة بالنحاس
أمراض أخرى تظهر فيها اضطرابات في استقلاب النحاس وتشمل تشمع الأطفال الهنود (ICC) والتسمم بالنحاس المستوطن في تيرول (ETIC)، والتسمم بالنحاس مجهول السبب (ICT)، والمعروف أيضًا باسم تشمع الأطفال غير الهنود. التسمم بالنحاس مجهول السبب هو مرض وراثي معترف به في أوائل القرن العشرين في منطقة تيرول بالنمسا وفي منطقة بونه في الهند.[57]
ICC ، ICT ، و ETIC هي متلازمات تحدث في سن الطفولة وتتشابه في مسبباتها وأعراضها.[121] ويبدو أن كل هذه المتلازمات لها مكون وراثي وتنشأ من ارتفاع في مدخول النحاس.
في حالات ICC، فإن كمية النحاس المرتفعة ناتجة عن تسخين و / أو تخزين الحليب في أوانٍ من النحاس أو النحاس الأصفر. من ناحية أخرى، ترجع حالات ICT إلى ارتفاع تركيز النحاس في إمدادات المياه.[9][122] على الرغم من أن التعرض لتركيزات مرتفعة من النحاس توجد عادة في كلا المرضين، ويكن يبدو أن بعض الحالات تتطور لدى الأطفال الذين يرضعون من الثدي فقط أو الذين يتلقون مستويات منخفضة من النحاس في إمدادات المياه.[122] تتمثل الفرضية السائدة حاليًا في أن ICT ناتجة عن آفة وراثية تؤدي إلى ضعف استقلاب النحاس مضافًا إليه كمية عالية من مدخول النحاس. وقد تم دعم هذه الفرضية من خلال تكرار وجود قرابة عصب بين الوالدين في معظم هذه الحالات، وهي غائبة في المناطق ذات محتوى مرتفع من النحاس في مياه الشرب والتي لا تحدث فيها هذه المتلازمات.[122]
يبدو أن التسمم بالنحاس مجهول السبب آخذ في التلاشي نتيجة لزيادة التنوع الوراثي بين السكان المتضررين بالتزامن مع البرامج التعليمية لضمان استخدام أواني الطهي مطلية بالقصدير بدلاً من الأواني والمقليات النحاسية التي تختلط مباشرة بالأطعمة المطبوخة. لم ترتبط حالات تليف الكبد في مرحلة الطفولة المبكرة التي تم تحديدها في ألمانيا على مدى 10 سنوات بمصادر خارجية من النحاس أو بتركيز مرتفع للمعادن في الكبد.[123] اليوم، تنشأ حالات تلقائية من تسمم النحاس مجهول السبب.
السرطان
إن السرطان مرضٌ معقدٌ وغير مفهومٍ جيدًا. يحقق بعض الباحثين في الدور المحتمل للنحاس في تولد الأوعية المصاحب لأنواع مختلفة من السرطانات.[124] لا يزال مخلبي النحاس، tetrathiomolybdate، الذي يستنفد مخازن النحاس في الجسم، قيد البحث كعامل مضاد لتولد الأوعية في التجارب الاستطلاعية[125] والسريرية.[126] قد يمنع هذا الدواء تولد الأوعية الدموية في سرطان الخلايا الكبدية، ورم الظهارة المتوسطة، وسرطان القولون والمستقيم، سرطان الخلايا الحرشفية في الرأس والرقبة، وسرطان الثدي، وسرطان الكلية.[127] يحفز المركب النحاسي المشتق من ساليسيل الدهيد بيرازول هيدرازون (SPH) استماتة الخلايا البطانية للسرة البشرية (HUVEC)، وأظهر تأثير مضاد لتولد الأوعية في المختبر.[128]
وجد أن النحاس وهو عنصر شحيح يعزز نمو الورم.[129][130] تشير عدة أدلة من نماذج حيوانية إلى أن الأورام تجمع مستويات عالية من النحاس. في هذه الأثناء، تم العثور على مزيد من النحاس في بعض أنواع السرطانات.[131][132] في الآونة الأخيرة، تم اقتراح استراتيجيات علاجية تستهدف النحاس في الورم. عند استعمال نوع معين من متمخلب النحاس، يتم تشكيل مركب نحاسي معقد بمستويات مرتفعة نسبيًا في الأورام. غالبًا ما تكون المركبات النحاسية سامة للخلايا، وبالتالي تُقتل خلايا الورم، في حين تبقى الخلايا الطبيعية في الجسم كله على قيد الحياة عند مستوى منخفض من النحاس.[133]
تمتلك بعض متمخلبات النحاس فعالية بيولوجية أفضل بعد تشكيل متمخلبات النحاس المعقدة. تم العثور على أن Cu2+ كان في حاجة ماسة لـ PDTC المحفز لاستماتة خلابا ابيضاض الدم البشرية (HL-60 cells).[134] أظهر SBH النحاسي زيادة فعالية تثبيط النمو في العديد من خطوط الخلايا السرطانية، بالمقارنة مع SBHs الخالي من المعادن.[135][136][137]
يمكن أن يتفاعل SBHs مع العديد من أنواع الكاتيونات المعدنية الانتقالية وبالتالي تشكل عددًا من المركبات.[137][138][139] كانت مركبات SBH النحاسية أكثر سمية للخلايا من مركبات المعادن الانتقالية الأخرى (Cu > Ni > Zn = Mn > Fe = Cr > Co) في خلايا MOLT-4، وهي عبارة عن خط لسرطان ابيضاض الدم تّائي الخلايا البشري. يبدو أن SBHs، خاصةً مركباتها النحاسي ، هي مثبطات قوية لعملية تصنيع الدنا ونمو الخلايا في العديد من خطوط الخلايا السرطانية البشرية، وخطوط خلايا السرطان القارض.[135][136]
وجد أن مشتقات (SPH) تثبط نمو خلايا سرطان الرئة A549.[140] لدى SPH روابط متطابقة لـ Cu2 + مثل SBH. تم العثور على مركب Cu-SPH لتحفيز الموت المبرمج للخلايا في خلايا سرطان الرئة A549، وH322، و H1299.[141]
منع الحمل باستخدام اللولب النحاسي
اللولب الرحمي النحاسي (IUD) هو إحدى وسائل منع الحمل طويلة الأمد القابلة للانعكاس والتي تعتبر واحدة من أكثر أشكال منع الحمل فعالية.[142] ويعتبر أيضًا أكثر وسائل منع الحمل غير الهرمونية فاعلية. إن آلية عمل اللولب النحاسي الرئيسية هي منع الإخصاب. يتم إفراز مواد فعالة من الـ IUD، والتي تعمل مع المنتجات المشتقة من التفاعل الالتهابي الموجود في سوائل المجرى التناسلي، وهذه المفرزات سامة للحيوانات المنوية والبويضات، مما يمنع تكون الجاميتات السليمة وتشكيل أجنة قابلة للحياة.[143]
صحة الحيوان والنبات
بالإضافة إلى كونه مادة غذائية أساسية للبشر، يعتبر النحاس حيويًا لصحة الحيوانات والنباتات ويلعب دورًا هامًا في الزراعة.[144]
صحة النبات
إن تركيز النحاس في التربة غير موحد حول العالم. في العديد من المناطق، تحتوي التربة على مستويات غير كافية من النحاس. التربة التي تقل فيها كمية النحاس بشكل طبيعي غالبًا ما تتطلب مكملات النحاس قبل زراعة المحاصيل، مثل الحبوب.
يمكن أن يؤدي نقص النحاس في التربة إلى فشل المحاصيل. يمثل نقص النحاس مشكلة رئيسية في الإنتاج العالمي الغذاء، مما يؤدي إلى خسائر في الإنتاجية وانخفاض جودة الإنتاج. يمكن للأسمدة النيتروجينية أن تزيد من نقص النحاس في التربة الزراعية.
إن أهم محصولين غذائيين في العالم، وهما الأرز والقمح، أكثر عرضة لنقص النحاس. كذلك هناك العديد من الأطعمة الهامة الأخرى، بما في ذلك الحمضيات، والشوفان، والسبانخ والجزر. من ناحية أخرى، بعض الأطعمة بما في ذلك جوز الهند، وفول الصويا والهليون ليست حساسة لنقص النحاس في التربة.
والاستراتيجية الأكثر فعالية لمواجهة نقص النحاس هي تغذية التربة بمكملات النحاس، وعادة ما يكون ذلك على شكل كبريتات النحاس. كما يستخدم حمأة الصرف الصحي في بعض المناطق لتجديد الأراضي الزراعية بالمواد العضوية والمعادن الشحيحة، بما في ذلك النحاس.
صحة الحيوان
في المواشي، تظهر الأبقار والأغنام مؤشرات عندما تعاني نقص النحاس. الرنح الحيواني، وهو مرض يصيب الخراف مرتبط بنقص النحاس، ويسبب تكاليف باهظة على المزارعين في جميع أنحاء العالم، لا سيما في أوروبا وأمريكا الشمالية والعديد من البلدان الاستوائية. بالنسبة للخنازير، فقد ثبت أن النحاس محفز نمو مهم.
انظر أيضًا
مراجع
- Scheiber، Ivo؛ Dringen، Ralf؛ Mercer، Julian F. B. (2013). "Copper: Effects of Deficiency and Overload". في Sigel، Astrid؛ Sigel، Helmut؛ Sigel، Roland K.O. (المحررون). Interrelations between Essential Metal Ions and Human Diseases. Metal Ions in Life Sciences. Springer. ج. 13. ص. 359–87. DOI:10.1007/978-94-007-7500-8_11. ISBN:978-94-007-7500-8.
- Hart، E. B.؛ Steenbock، H.؛ Waddell، J. (1928). "Iron nutrition. VII: Copper is a supplement to iron for hemoglobin building in the rat". The Journal of Biological Chemistry. ج. 77: 797–833. مؤرشف من الأصل في 2019-06-04.
- Ralph, A., and McArdle, H. J. 2001. Copper metabolism and requirements in the pregnant mother, her fetus, and children. New York: International Copper Association
- George Obikoya, http://vitamins-nutrition.org/vitamins/copper.html نسخة محفوظة 2020-08-01 على موقع واي باك مشين.
- http://copperinfo.com/health/pregnancy.html نسخة محفوظة 27 فبراير 2011 على موقع واي باك مشين..
- Vest، Katherine E.؛ Hashemi، Hayaa F.؛ Cobine، Paul A. (2013). "The Copper Metallome in Eukaryotic Cells". في Banci، Lucia (المحرر). Metallomics and the Cell. Metal Ions in Life Sciences. Springer. ج. 12. DOI:10.1007/978-94-007-5561-10_12. ISBN:978-94-007-5560-4.
- Stern، Bonnie Ransom؛ Solioz، Marc؛ Krewski، Daniel؛ Aggett، Peter؛ Aw، Tar-Ching؛ Baker، Scott؛ Crump، Kenny؛ Dourson، Michael؛ Haber، Lynne؛ Hertzberg، Rick؛ Keen، Carl؛ Meek، Bette؛ Rudenko، Larisa؛ Schoeny، Rita؛ Slob، Wout؛ Starr، Tom (2007). "Copper and Human Health: Biochemistry, Genetics, and Strategies for Modeling Dose-response Relationships". Journal of Toxicology and Environmental Health, Part B. ج. 10 ع. 3: 157–222. DOI:10.1080/10937400600755911. PMID:17454552.
- Stern، Bonnie Ransom (2010). "Essentiality and Toxicity in Copper Health Risk Assessment: Overview, Update and Regulatory Considerations". Journal of Toxicology and Environmental Health, Part A. ج. 73 ع. 2: 114–27. DOI:10.1080/15287390903337100. PMID:20077283.
- International Programme on Chemical Safety. 1998. Environmental Health Criteria No. 200: Copper. Geneva: World Health Organization
- Camakaris، J.؛ Voskoboinik، I.؛ Mercer، J.F. (1999). "Molecular Mechanisms of Copper Homeostasis". Biochemical and Biophysical Research Communications. ج. 261 ع. 2: 225–32. DOI:10.1006/bbrc.1999.1073. PMID:10425169.
- Harris، Edward D. (2000). "Cellular copper transport and metabolism". Annual Review of Nutrition. ج. 20 ع. 1: 291–310. DOI:10.1146/annurev.nutr.20.1.291. PMID:10940336.
- Harris، Edward D. (2001). "Copper Homeostasis: The Role of Cellular Transporters". Nutrition Reviews. ج. 59 ع. 9: 281–5. DOI:10.1111/j.1753-4887.2001.tb07017.x. PMID:11570430.
- Bertinato، Jesse؛ L'Abbé، Mary R. (2004). "Maintaining copper homeostasis: regulation of copper-trafficking proteins in response to copper deficiency or overload". The Journal of Nutritional Biochemistry. ج. 15 ع. 6: 316–22. DOI:10.1016/j.jnutbio.2004.02.004. PMID:15157936.
- Lewis, Al, 2009, The Hygienic Benefits of Antimicrobial Copper Alloy Surfaces In Healthcare Settings, a compilation of information and data for the International Copper Association Inc., © 2009, available from International Copper Association Inc., A1335-XX/09
- Stern, B.R. et. al, 2007, Copper And Human Health: Biochemistry, Genetics, And Strategies for Modeling Dose-Response Relationships, Journal of Toxicology and Environmental Health, Part B, 10:157–222
- van Campen، Darrell R.؛ Mitchell، Elizabeth A. (1965). "Absorption of Cu64, Zn65, Mo99, and Fe59 from ligated segments of the rat gastrointestinal tract". The Journal of Nutrition. ج. 86 ع. 2: 120–4. PMID:14302118. مؤرشف من الأصل في 2020-03-13.
- Crampton، R. F.؛ Matthews، D. M.؛ Poisner، Roselle (1965). "Observations on the mechanism of absorption of copper by the small intestine". The Journal of Physiology. ج. 178 ع. 1: 111–26. DOI:10.1113/jphysiol.1965.sp007618. PMC:1357280. PMID:14298103.
- Bearn، AG؛ Kunkel، HG (1955). "Metabolic studies in Wilson's disease using Cu64". The Journal of Laboratory and Clinical Medicine. ج. 45 ع. 4: 623–31. PMID:14368026. مؤرشف من الأصل في 2020-01-03.
- Strickland، GT؛ Beckner، WM؛ Leu، ML (1972). "Absorption of copper in homozygotes and heterozygotes for Wilson's disease and controls: isotope tracer studies with 67 Cu and 64 Cu". Clinical Science. ج. 43 ع. 5: 617–25. DOI:10.1042/cs0430617. PMID:5083937.
- Strickland، GT؛ Beckner، WM؛ Leu، ML؛ O'Reilly، S (1972). "Turnover studies of copper in homozygotes and heterozygotes for Wilson's disease and controls: isotope tracer studies with 67 Cu". Clinical Science. ج. 43 ع. 5: 605–15. DOI:10.1042/cs0430605. PMID:5083936.
- Turnlund، Judith R؛ Keyes، William R؛ Anderson، Helen L؛ Acord، Lorra L (1989). "Copper absorption and retention in young men at three levels of dietary copper by use of the stable isotope 65Cu1–4". The American Journal of Clinical Nutrition. ج. 49 ع. 5: 870–8. PMID:2718922. مؤرشف من الأصل في 2020-09-14.
- Turnlund، Judith R. (1998). "Human whole-body copper metabolism". The American Journal of Clinical Nutrition. ج. 67 ع. 5 Suppl: 960S–964S. PMID:9587136. مؤرشف من الأصل في 2020-01-04.
- Ehrenkranz، Richard A.؛ Gettner، Patricia A.؛ Nelli، Catherine M. (1989). "Nutrient Balance Studies in Premature Infants Fed Premature Formula or Fortified Preterm Human Milk". Journal of Pediatric Gastroenterology and Nutrition. ج. 8 ع. 1: 58–67. DOI:10.1097/00005176-198901000-00012. PMID:2499673.
- World Health Organization. 1998, Guidelines for drinking-water quality. Addendum to Volume 2, 2nd ed. Geneva
- Turnlund، Judith R؛ Swanson، Christine A؛ King، Janet C (1983). "Copper Absorption and Retention in Pregnant Women Fed Diets Based on Animal and Plant Proteins". The Journal of Nutrition. ج. 113 ع. 11: 2346–52. PMID:6631551. مؤرشف من الأصل في 2020-05-12.
- Cousins، Robert J (1985). "Absorption, transport, and hepatic metabolism of copper and zinc: special reference to metallothionein and ceruloplasmin". Physiological Reviews. ج. 65 ع. 2: 238–309. PMID:3885271. مؤرشف من الأصل في 2020-05-26.
- Oestreicher، Paul؛ Cousins، Robert J (1985). "Copper and Zinc Absorption in the Rat: Mechanism of Mutual Antagonism". The Journal of Nutrition. ج. 115 ع. 2: 159–66. PMID:3968585. مؤرشف من الأصل في 2020-05-12.
- Lee، D؛ Schroeder، J؛ Gordon، DT (يناير 1984). "The effect of phytic acid on copper bioavailability". Federation Proceedings. Federation of American Societies for Experimental Biology. ج. 43 ع. 3: 616–20.
- Greger، JL؛ Mulvaney، Jude (1985). "Absorption and Tissue Distribution of Zinc, Iron and Copper by Rats Fed Diets Containing Lactalbumin, Soy and Supplemental Sulfur-Containing Amino Acids". The Journal of Nutrition. ج. 115 ع. 2: 200–10. PMID:4038512. مؤرشف من الأصل في 2020-05-12.
- Werman، Moshe J.؛ Bhathena، Sam J. (1995). "Fructose metabolizing enzymes in the rat liver and metabolic parameters: Interactions between dietary copper, type of carbohydrates, and gender". The Journal of Nutritional Biochemistry. ج. 6 ع. 7: 373–379. DOI:10.1016/0955-2863(95)80005-W. PMID:12049998.
- Wapnir، Raul A (1998). "Copper absorption and bioavailability". The American Journal of Clinical Nutrition. ج. 67 ع. 5 Suppl: 1054S–1060S. PMID:9587151. مؤرشف من الأصل في 2020-05-26.
- Aa sa , R., Ma lm s t r om , B. G., Sa l tm a n , P., and Va n n g a r d , T.: The specific binding of iron (III) and copper (II) to transferrin and conalbumin. Biochim. Biophys. Acta 75:203-222,1963.
- Wil l ia m s , D. M., Ba r b u t o , A. J., At k in , C. L., a n d L e e , G. R.: E v id e n c e for an iro n c a r r ie r s u b s ta n c e in c o p p e r -d e fic ie n t m ito c h o n d ria . T h e R e d C e lls . N ew York, Alan R. L is s, In c ., 1978, p p . 539-545.
- "Archived copy". مؤرشف من الأصل في 2010-10-15. اطلع عليه بتاريخ 2010-10-20.
{{استشهاد ويب}}: صيانة الاستشهاد: الأرشيف كعنوان (link) - Lutsenko، Svetlana؛ Kaplan، Jack H. (1995). "Organization of P-type ATPases: significance of structural diversity". Biochemistry. ج. 34 ع. 48: 15607–13. DOI:10.1021/bi00048a001. PMID:7495787.
- Solioz، Marc؛ Vulpe، Christopher (1996). "CPx-type ATPases: a class of P-type ATPases that pump heavy metals". Trends in Biochemical Sciences. ج. 21 ع. 7: 237–41. DOI:10.1016/S0968-0004(96)20016-7. PMID:8755241.
- Lee، J.؛ Petris، M. J.؛ Thiele، D. J. (2002). "Characterization of mouse embryonic cells deficient in the ctr1 high affinity copper transporter: Identification of a Ctr1-independent copper transport system". The Journal of Biological Chemistry. ج. 277 ع. 43: 40253–9. DOI:10.1074/jbc.M208002200. PMID:12177073.
- Marceau، N؛ Aspin، N؛ Sass-Kortsak، A (1970). "Absorption of copper 64 from gastrointestinal tract of the rat". The American Journal of Physiology. ج. 218 ع. 2: 377–83. PMID:5412451. مؤرشف من الأصل في 2016-09-02.
- Bligh، S.W.Annie؛ Boyle، Helena A.؛ Mcewen، Andrew B.؛ Sadler، Peter J.؛ Woodham، Robert H. (1992). "1H NMR studies of reactions of copper complexes with human blood plasma and urine". Biochemical Pharmacology. ج. 43 ع. 2: 137–45. DOI:10.1016/0006-2952(92)90270-S. PMID:1739401.
- Linder، Maria C؛ Hazegh-Azam، Maryam (1996). "Copper biochemistry and molecular biology". The American Journal of Clinical Nutrition. ج. 63 ع. 5: 797S–811S. PMID:8615367. مؤرشف من الأصل في 2018-01-03.
- Linder، Maria C؛ Wooten، Lisa؛ Cerveza، Philip؛ Cotton، Steven؛ Shulze، Roman؛ Lomeli، Norma (1998). "Copper transport". The American Journal of Clinical Nutrition. ج. 67 ع. 5 Suppl: 965S–971S. PMID:9587137. مؤرشف من الأصل في 2020-05-12.
- Cousins، RJ (1985). "Absorption, transport, and hepatic metabolism of copper and zinc: special reference to metallothionein and ceruloplasmin". Physiological Reviews. ج. 65 ع. 2: 238–309. PMID:3885271. مؤرشف من الأصل في 2020-05-26.
- Winge، Dennis R.؛ Mehra، Rajesh K. (1990). "Host Defenses against Copper Toxicity". International Review of Experimental Pathology. ج. 31: 47–83. DOI:10.1016/b978-0-12-364931-7.50007-0. PMID:2292474.
- Turnlund، Judith R (1998). "Human whole-body copper metabolism". The American Journal of Clinical Nutrition. ج. 67 ع. 5 Suppl: 960S–964S. PMID:9587136. مؤرشف من الأصل في 2020-01-04.
- Aggett، PJ (1999). "An overview of the metabolism of copper". European Journal of Medical Research. ج. 4 ع. 6: 214–6. PMID:10383873.
- WHO/FAO/IAEA, (1996), Trace Elements in Human Nutrition and Health. World Health Organization, Geneva)
- مدلاين بلس Copper in diet
- "Copper". Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc. National Academies Press. 2001. ص. 224–57. ISBN:978-0-309-07279-3.
- Tolerable Upper Intake Levels For Vitamins And Minerals (PDF)، European Food Safety Authority، 2006، مؤرشف من الأصل (PDF) في 2019-10-15
- Peana, Massimiliano & Medici, Serenella & Zoroddu, Maria. (2018)."Biomedical Applications of Metals" ed. Mahendra Rai, Avinash P. Ingle, Serenella Medici.pp98.
- "Overview on Dietary Reference Values for the EU population as derived by the EFSA Panel on Dietetic Products, Nutrition and Allergies" (PDF). 2017. مؤرشف من الأصل (PDF) في 2018-11-13.
- Georgopoulos، PG؛ Roy، A؛ Yonone-Lioy، MJ؛ Opiekun، RE؛ Lioy، PJ (2001). "Environmental copper: its dynamics and human exposure issues". Journal of Toxicology and Environmental Health. Part B, Critical Reviews. ج. 4 ع. 4: 341–94. DOI:10.1080/109374001753146207. PMID:11695043.
- Sadhra، Steven S.؛ Wheatley، Andrew D.؛ Cross، Hilary J. (2007). "Dietary exposure to copper in the European Union and its assessment for EU regulatory risk assessment". Science of The Total Environment. ج. 374 ع. 2–3: 223–34. DOI:10.1016/j.scitotenv.2006.12.041. PMID:17270248.
- World Health Organization. 1998. Copper. Environmental Health Criteria 200. Geneva: IPCS, WHO
- Abstract from ‘Copper Alloys for Human Infectious Disease Control’ by H T Michels, S A Wilks, J O Noyce and C W Keevil.
- Allen V. Barker، David J. Pilbeam. (2013).Handbook of Plant Nutrition.pp321-322
- Stern، Bonnie Ransom (2007). "U-Shaped Dose-Response Curve for Risk Assessment of Essential Trace Elements: Copper as a Case Study". في Robson، Mark G.؛ Toscano، William A. (المحررون). Risk Assessment for Environmental Health. San Francisco: John Wiley and Sons. ص. 555–62. ISBN:978-1-118-42406-3.
- K. G. Daniel, P. Gupta, R. H. Harbach, W. C. Guida, and Q. P. Dou, “Organic copper complexes as a new class of proteasome inhibitors and apoptosis inducers in human cancer cells,” Biochemical Pharmacology, vol. 67, no. 6, pp. 1139–1151, 2004. View at Publisher · View at Google Scholar · View at PubMed · View at Scopus
- "CopperInfo.com - Quick Facts". مؤرشف من الأصل في 2012-02-18.
- Georgopoulos، Panos G؛ Wang، Sheng Wei؛ Georgopoulos، Ioannis G؛ Yonone-Lioy، Mary Jean؛ Lioy، Paul J (2006). "Assessment of human exposure to copper: A case study using the NHEXAS database". Journal of Exposure Analysis and Environmental Epidemiology. ج. 16 ع. 5: 397–409. DOI:10.1038/sj.jea.7500462. PMID:16249795.
- What We Eat In America, NHANES 2001–2002. Table A14: Copper. نسخة محفوظة 10 سبتمبر 2016 على موقع واي باك مشين.
- Spinazzi، Marco؛ De Lazzari، Franca؛ Tavolato، Bruno؛ Angelini، Corrado؛ Manara، Renzo؛ Armani، Mario (2007). "Myelo-optico-neuropathy in copper deficiency occurring after partial gastrectomy". Journal of Neurology. ج. 254 ع. 8: 1012–7. DOI:10.1007/s00415-006-0479-2. PMID:17415508.
- Goodman، B P؛ Bosch، E P؛ Ross، M A؛ Hoffman-Snyder، C؛ Dodick، D D؛ Smith، B E (2009). "Clinical and electrodiagnostic findings in copper deficiency myeloneuropathy". Journal of Neurology, Neurosurgery & Psychiatry. ج. 80 ع. 5: 524–7. DOI:10.1136/jnnp.2008.144683. PMID:18495738.
- Kumar، Neeraj؛ Elliott، Michelle A.؛ Hoyer، James D.؛ Harper، Charles M.؛ Ahlskog، J. Eric؛ Phyliky، Robert L. (2005). "'Myelodysplasia,' Myeloneuropathy, and Copper Deficiency". Mayo Clinic Proceedings. ج. 80 ع. 7: 943–6. DOI:10.4065/80.7.943. PMID:16007901.
- Cordano، A (1978). "Copper deficiency in clinical medicine". في Hambidge، K. M.؛ Nichols، B. L. (المحررون). Zinc and Copper in Clinical Medicine. New York: SP Med. Sci. Books. ص. 119–26.
- Danks، D M (1988). "Copper Deficiency in Humans". Annual Review of Nutrition. ج. 8: 235–57. DOI:10.1146/annurev.nu.08.070188.001315. PMID:3060166.
- Klevay، LM (1980). "The influence of copper and zinc on the occurrence of ischemic heart disease". Journal of Environmental Pathology and Toxicology. ج. 4 ع. 2–3: 281–7. PMID:7007558.
- Strain، J. J. (1994). "Newer aspects of micronutrients in chronic disease: copper". Proceedings of the Nutrition Society. ج. 53 ع. 3: 583–98. DOI:10.1079/PNS19940067. PMID:7886057.
- Salem، Harry؛ Green، Sidney؛ Bigelow، Sanford؛ Borzelleca، Joseph؛ Baskin، Steven (1992). "Preface". Critical Reviews in Food Science and Nutrition. ج. 32 ع. 1: 1–31. DOI:10.1080/10408399209527583. PMID:1290583.
- Kaegi، Jeremias H. R.؛ Schaeffer، Andreas (1988). "Biochemistry of metallothionein". Biochemistry. ج. 27 ع. 23: 8509–15. DOI:10.1021/bi00423a001. PMID:3064814.
- Lönnerdal، Bo (1996). "Bioavailability of copper". The American Journal of Clinical Nutrition. ج. 63 ع. 5: 821S–9S. PMID:8615369. مؤرشف من الأصل في 2020-05-12.
- Kelsay، JL (1987). "Effects of fiber, phytic acid, and oxalic acid in the diet on mineral bioavailability". The American Journal of Gastroenterology. ج. 82 ع. 10: 983–6. PMID:2821800.
- U.S. National Research Council. 2000. Copper in drinking water. Committee on Copper in Drinking Water, Board on Environmental Studies and Toxicology, Commission of Life Sciences. Washington, DC: National Academy Press[بحاجة لرقم الصفحة]
- Bremner، Ian (1998). "Manifestations of copper excess". The American Journal of Clinical Nutrition. ج. 67 ع. 5 Suppl: 1069S–1073S. PMID:9587154. مؤرشف من الأصل في 2020-05-12.
- Bartzokis، George؛ Sultzer، David؛ Cummings، Jeffrey؛ Holt، Lori E.؛ Hance، Darwood B.؛ Henderson، Victor W.؛ Mintz، Jim (2000). "In Vivo Evaluation of Brain Iron in Alzheimer Disease Using Magnetic Resonance Imaging". Archives of General Psychiatry. ج. 57 ع. 1: 47–53. DOI:10.1001/archpsyc.57.1.47. PMID:10632232.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|laysummary=تم تجاهله (مساعدة) - Duce، James A.؛ Tsatsanis، Andrew؛ Cater، Michael A.؛ James، Simon A.؛ Robb، Elysia؛ Wikhe، Krutika؛ Leong، Su Ling؛ Perez، Keyla؛ Johanssen، Timothy؛ Greenough، Mark A.؛ Cho، Hyun-Hee؛ Galatis، Denise؛ Moir، Robert D.؛ Masters، Colin L.؛ McLean، Catriona؛ Tanzi، Rudolph E.؛ Cappai، Roberto؛ Barnham، Kevin J.؛ Ciccotosto، Giuseppe D.؛ Rogers، Jack T.؛ Bush، Ashley I. (2010). "Iron-Export Ferroxidase Activity of β-Amyloid Precursor Protein Is Inhibited by Zinc in Alzheimer's Disease". Cell. ج. 142 ع. 6: 857–67. DOI:10.1016/j.cell.2010.08.014. PMC:2943017. PMID:20817278.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|laysummary=تم تجاهله (مساعدة) - "Am I at risk of developing dementia?". Alzheimer's Society. مؤرشف من الأصل في 2018-03-16.
- Brewer، George J. (2010). "Copper toxicity in the general population". Clinical Neurophysiology. ج. 121 ع. 4: 459–60. DOI:10.1016/j.clinph.2009.12.015. PMID:20071223.
- Llanos، Roxana M.؛ Mercer، Julian F.B. (2002). "The Molecular Basis of Copper Homeostasis Copper-Related Disorders". DNA and Cell Biology. ج. 21 ع. 4: 259–70. DOI:10.1089/104454902753759681. PMID:12042066.
- Copper link to Alzheimer's disease, New Scientist, August 12, 2003, https://www.newscientist.com/article/dn4045-copper-link-to-alzheimers-disease.html نسخة محفوظة 2015-04-30 على موقع واي باك مشين.
- Singh، Itender؛ Sagare، Abhay P.؛ Coma، Mireia؛ Perlmutter، David؛ Gelein، Robert؛ Bell، Robert D.؛ Deane، Richard J.؛ Zhong، Elaine؛ Parisi، Margaret؛ Ciszewski، Joseph؛ Kasper، R. Tristan؛ Deane، Rashid (2013). "Low levels of copper disrupt brain amyloid-β homeostasis by altering its production and clearance". Proceedings of the National Academy of Sciences. ج. 110 ع. 36: 14771–6. Bibcode:2013PNAS..11014771S. DOI:10.1073/pnas.1302212110. PMC:3767519. PMID:23959870.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|laysummary=تم تجاهله (مساعدة) - Loef، Martin؛ Walach، Harald (1 يناير 2012). "Copper and iron in Alzheimer's disease: a systematic review and its dietary implications". The British Journal of Nutrition. ج. 107 ع. 1: 7–19. DOI:10.1017/S000711451100376X. ISSN:1475-2662. PMID:21767446.
- Protective role for copper in Alzheimer's disease, Science News, October 13, 2009, https://www.sciencedaily.com/releases/2009/10/091008133457.htm نسخة محفوظة 2018-07-03 على موقع واي باك مشين.
- T. Borchardt, J. Camakaris, R. Cappai, C. L. Masters, K. Beyreuther, and G. Multhaup, “Copper inhibits β-amyloid production and stimulates the non-amyloidogenic pathway of amyloid-precursor-protein secretion,” Biochemical Journal, vol. 344, no. 2, pp. 461–467, 1999. View at Publisher · View at Google Scholar · View at Scopus
- A. L. Phinney, B. Drisaldi, S. D. Schmidt et al., “In vivo reduction of amyloid-β by a mutant copper transporter,” Proceedings of the National Academy of Sciences of the United States of America, vol. 100, no. 24, pp. 14193–14198, 2003. View at Publisher · View at Google Scholar · View at Scopus
- Kaden، Daniela؛ Bush، Ashley I.؛ Danzeisen، Ruth؛ Bayer، Thomas A.؛ Multhaup، Gerd (2011). "Disturbed Copper Bioavailability in Alzheimer's Disease". International Journal of Alzheimer's Disease. ج. 2011: 345614. DOI:10.4061/2011/345614. PMC:3227474. PMID:22145082.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - Kessler، Holger؛ Bayer، Thomas A.؛ Bach، Daniela؛ Schneider-Axmann، Thomas؛ Supprian، Tillmann؛ Herrmann، Wolfgang؛ Haber، Manfred؛ Multhaup، Gerd؛ Falkai، Peter؛ Pajonk، Frank-Gerald (2008). "Intake of copper has no effect on cognition in patients with mild Alzheimer's disease: a pilot phase 2 clinical trial". Journal of Neural Transmission. ج. 115 ع. 8: 1181–7. DOI:10.1007/s00702-008-0080-1. PMC:2516533. PMID:18587525.
- Kessler، Holger؛ Pajonk، Frank-Gerald؛ Bach، Daniela؛ Schneider-Axmann، Thomas؛ Falkai، Peter؛ Herrmann، Wolfgang؛ Multhaup، Gerd؛ Wiltfang، Jens؛ Schäfer، Stephanie؛ Wirths، Oliver؛ Bayer، Thomas A. (2008). "Effect of copper intake on CSF parameters in patients with mild Alzheimer's disease: a pilot phase 2 clinical trial". Journal of Neural Transmission. ج. 115 ع. 12: 1651–9. DOI:10.1007/s00702-008-0136-2. PMID:18972062.
- Brewer، George J. (2012). "Copper toxicity in Alzheimer's disease: Cognitive loss from ingestion of inorganic copper". Journal of Trace Elements in Medicine and Biology. ج. 26 ع. 2–3: 89–92. DOI:10.1016/j.jtemb.2012.04.019. PMID:22673823.
- Brewer، George J. (2000). "Editorial: Is heterozygosity for a Wilson's disease gene defect an important underlying cause of infantile and childhood copper toxicosis syndromes?". The Journal of Trace Elements in Experimental Medicine. ج. 13 ع. 3: 249–54. DOI:10.1002/1520-670X(2000)13:3<249::AID-JTRA1>3.0.CO;2-L.
- Araya، Magdalena؛ McGoldrick، Marie Clare؛ Klevay، Leslie M.؛ Strain، J.J.؛ Robson، Paula؛ Nielsen، Forrest؛ Olivares، Manuel؛ Pizarro، Fernando؛ Johnson، LuAnn؛ Poirier، Kenneth A. (2001). "Determination of an Acute No-Observed-Adverse-Effect Level (NOAEL) for Copper in Water". Regulatory Toxicology and Pharmacology. ج. 34 ع. 2: 137–45. DOI:10.1006/rtph.2001.1492. PMID:11603956.
- Araya، Magdalena؛ Chen، Bingheng؛ Klevay، Leslie M؛ Strain، J.J؛ Johnson، LuAnn؛ Robson، Paula؛ Shi، Wei؛ Nielsen، Forrest؛ Zhu، Huigang؛ Olivares، Manuel؛ Pizarro، Fernando؛ Haber، Lynne T (2003). "Confirmation of an acute no-observed-adverse-effect and low-observed-adverse-effect level for copper in bottled drinking water in a multi-site international study". Regulatory Toxicology and Pharmacology. ج. 38 ع. 3: 389–99. DOI:10.1016/j.yrtph.2003.08.001. PMID:14623488.
- Pizarro، F.؛ Olivares، M.؛ Gidi، V.؛ Araya، M. (1999). "The Gastrointestinal Tract and Acute Effects of Copper in Drinking Water and Beverages". Reviews on Environmental Health. ج. 14 ع. 4: 231–8. DOI:10.1515/REVEH.1999.14.4.231. PMID:10746735.
- Pizarro، F؛ Olivares، M؛ Uauy، R؛ Contreras، P؛ Rebelo، A؛ Gidi، V (1999). "Acute gastrointestinal effects of graded levels of copper in drinking water". Environmental Health Perspectives. ج. 107 ع. 2: 117–21. DOI:10.1289/ehp.99107117. PMC:1566323. PMID:9924006.
- Zacarías، I؛ Yáñez، CG؛ Araya، M؛ Oraka، C؛ Olivares، M؛ Uauy، R (2001). "Determination of the taste threshold of copper in water". Chemical Senses. ج. 26 ع. 1: 85–9. DOI:10.1093/chemse/26.1.85. PMID:11124219.
- Olivares، Manuel؛ Uauy، Ricardo (1996). "Limits of metabolic tolerance to copper and biological basis for present recommendations and regulations". The American Journal of Clinical Nutrition. ج. 63 ع. 5: 846S–52S. PMID:8615373. مؤرشف من الأصل في 2020-05-12.
- O'Donohue، J؛ Reid، M؛ Varghese، A؛ Portmann، B؛ Williams، R (1999). "A case of adult chronic copper self-intoxication resulting in cirrhosis". European Journal of Medical Research. ج. 4 ع. 6: 252. PMID:10383882.
- Buchanan، Sharunda D.؛ Diseker، Robert A.؛ Sinks، Thomas؛ Olson، David R.؛ Daniel، Jack؛ Flodman، Thomas (1999). "Copper in Drinking Water, Nebraska, 1994". International Journal of Occupational and Environmental Health. ج. 5 ع. 4: 256–61. DOI:10.1179/oeh.1999.5.4.256. PMID:10633241.
- Araya، Magdalena؛ Olivares، Manuel؛ Pizarro، Fernando؛ González، Mauricio؛ Speisky، Hernán؛ Uauy، Ricardo (2003). "Gastrointestinal symptoms and blood indicators of copper load in apparently healthy adults undergoing controlled copper exposure". The American Journal of Clinical Nutrition. ج. 77 ع. 3: 646–50. PMID:12600855. مؤرشف من الأصل في 2020-05-12.
- O’Connor، J.M.؛ Bonham، M.P.؛ Turley، E.؛ McKeown، A.؛ McKelvey-Martin، V.J.؛ Gilmore، W.S.؛ Strain، J.J. (2003). "Copper Supplementation Has No Effect on Markers of DNA Damage and Liver Function in Healthy Adults (FOODCUE Project)". Annals of Nutrition and Metabolism. ج. 47 ع. 5: 201–6. DOI:10.1159/000070486. PMID:12748413.
- Pratt، William B؛ Omdahl، John L؛ Sorenson، John RJ (1985). "Lack of effects of copper gluconate supplementation". The American Journal of Clinical Nutrition. ج. 42 ع. 4: 681–2. PMID:2931973. مؤرشف من الأصل في 2020-05-12.
- Turley، Eithne؛ McKeown، Andrea؛ Bonham، Maxine P.؛ O’Connor، Jacqueline M.؛ Chopra، Mridula؛ Harvey، Linda J.؛ Majsak-Newman، Gosia؛ Fairweather-Tait، Susan J.؛ Bügel، Susanne؛ Sandström، Brittmarie؛ Rock، Edmond؛ Mazur، Andrzej؛ Rayssiguier، Yves؛ Strain، J.J. (2000). "Copper supplementation in humans does not affect the susceptibility of low density lipoprotein to in vitro induced oxidation (FOODCUE project)". Free Radical Biology and Medicine. ج. 29 ع. 11: 1129–34. DOI:10.1016/S0891-5849(00)00409-3. PMID:11121720.
- Olivares، Manuel؛ Pizarro، Fernando؛ Speisky، Hernán؛ Lönnerdal، Bo؛ Uauy، Ricardo (1998). "Copper in Infant Nutrition: Safety of World Health Organization Provisional Guideline Value for Copper Content of Drinking Water". Journal of Pediatric Gastroenterology & Nutrition. ج. 26 ع. 3: 251–7. DOI:10.1097/00005176-199803000-00003. PMID:9523857.
- Milne، David B (1998). "Copper intake and assessment of copper status". The American Journal of Clinical Nutrition. ج. 67 ع. 5 Suppl: 1041S–1045S. PMID:9587149. مؤرشف من الأصل في 2020-05-12.
- J. Wang, H. Slunt, V. Gonzales, D. Fromholt, M. Coonfield, N.G. Copeland, N.A. Jenkins, D.R. Borchelt Copper-binding-site-null SOD1 causes ALS in transgenic mice: aggregates of non-native SOD1 delineate a common feature Hum. Mol. Genet., 12 (2003), pp. 2753-2764
- "CopperInfo.com - Good Health with Copper". مؤرشف من الأصل في 2012-01-01.
- Kaler، Stephen G. (1998). "Metabolic and molecular bases of Menkes disease and occipital horn syndrome". Pediatric and Developmental Pathology. ج. 1 ع. 1: 85–98. DOI:10.1007/s100249900011. PMID:10463276.
- Kaler، Stephen G. (1996). "Menkes disease mutations and response to early copper histidine treatment". Nature Genetics. ج. 13 ع. 1: 21–2. DOI:10.1038/ng0596-21. PMID:8673098.
- Juan M. Pascual*, John H. Menkes†, in Rosenberg's Molecular and Genetic Basis of Neurological and Psychiatric Disease (Fifth Edition), 2015
- Kaler، SG (1994). "Menkes disease". Advances in Pediatrics. ج. 41: 263–304. PMID:7992686.
- "نسخة مؤرشفة". مؤرشف من الأصل في 2011-07-08. اطلع عليه بتاريخ 2018-06-07.[استشهاد منقوص البيانات]
- Mercer، Julian F B (2001). "The molecular basis of copper-transport diseases". Trends in Molecular Medicine. ج. 7 ع. 2: 64–9. DOI:10.1016/S1471-4914(01)01920-7. PMID:11286757.
- Gitlin، Jonathan D (2003). "Wilson disease". Gastroenterology. ج. 125 ع. 6: 1868–77. DOI:10.1053/j.gastro.2003.05.010. PMID:14724838.
- Scheinberg، I Herbert؛ Sternlieb، Irmin (1996). "Wilson disease and idiopathic copper toxicosis". The American Journal of Clinical Nutrition. ج. 63 ع. 5: 842S–5S. PMID:8615372. مؤرشف من الأصل في 2020-05-12.
- Frommer DJ. Defective biliary excretion of copper in Wilson’s disease. Gut 1974;15:125–129
- Ferenci، Peter؛ Caca، Karel؛ Loudianos، Georgios؛ Mieli-Vergani، Georgina؛ Tanner، Stuart؛ Sternlieb، Irmin؛ Schilsky، Michael؛ Cox، Diane؛ Berr، Frieder (2003). "Diagnosis and phenotypic classification of Wilson disease". Liver International. ج. 23 ع. 3: 139–42. DOI:10.1034/j.1600-0676.2003.00824.x. PMID:12955875.
- Brewer، George J.؛ Dick، Robert D.؛ Johnson، Virginia D.؛ Brunberg، James A.؛ Kluin، Karen J.؛ Fink، John K. (1998). "Treatment of Wilson's disease with zinc: XV long-term follow-up studies". Journal of Laboratory and Clinical Medicine. ج. 132 ع. 4: 264–78. DOI:10.1016/s0022-2143(98)90039-7. PMID:9794697.
- Brewer، George J.؛ Johnson، Virginia؛ Dick، Robert D.؛ Kluin، Karen J.؛ Fink، John K.؛ Brunberg، James A. (1996). "Treatment of Wilson Disease With Ammonium Tetrathiomolybdate". Archives of Neurology. ج. 53 ع. 10: 1017–25. DOI:10.1001/archneur.1996.00550100103019. PMID:8859064.
- Garciavillarreal، L؛ Daniels، S؛ Shaw، S؛ Cotton، D؛ Galvin، M؛ Geskes، J؛ Bauer، P؛ Sierrahernandez، A؛ Buckler، A؛ Tugores، A (2000). "High prevalence of the very rare wilson disease gene mutation Leu708Pro in the Island of Gran Canaria (Canary Islands, Spain): A genetic and clinical study". Hepatology. ج. 32 ع. 6: 1329–36. DOI:10.1053/jhep.2000.20152. PMID:11093740.
- Ha-Hao، Duc؛ Hefter، Harald؛ Stremmel، Wolfgang؛ Castañeda-Guillot، Carlos؛ Hernández، Ana Hernández؛ Cox، Diane W؛ Auburger، Georg (1998). "His1069Gln and six novel Wilson disease mutations: analysis of relevance for early diagnosis and phenotype". European Journal of Human Genetics. ج. 6 ع. 6: 616–23. DOI:10.1038/sj.ejhg.5200237. PMID:9887381.
- Wijmenga، C؛ Müller، T؛ Murli، I S؛ Brunt، T؛ Feichtinger، H؛ Schönitzer، D؛ Houwen، R H J؛ Müller، W؛ Sandkuijl، L A؛ Pearson، P L (1998). "Endemic Tyrolean infantile cirrhosis is not an allelic variant of Wilson's disease". European Journal of Human Genetics. ج. 6 ع. 6: 624–8. DOI:10.1038/sj.ejhg.5200235. PMID:9887382.
- Müller، Thomas؛ Müller، Wilfried؛ Feichtinger، Hans (1998). "Idiopathic copper toxicosis". The American Journal of Clinical Nutrition. ج. 67 ع. 5 Suppl: 1082S–1086S. PMID:9587156. مؤرشف من الأصل في 2020-05-12.
- Dieter، HH؛ Schimmelpfennig، W؛ Meyer، E؛ Tabert، M (1999). "Early childhood cirrhoses (ECC) in Germany between 1982 and 1994 with special consideration of copper etiology". European Journal of Medical Research. ج. 4 ع. 6: 233–42. PMID:10383878.
- Goodman، Vicki؛ Brewer، George؛ Merajver، Sofia (2005). "Control of Copper Status for Cancer Therapy". Current Cancer Drug Targets. ج. 5 ع. 7: 543–9. DOI:10.2174/156800905774574066. PMID:16305350.
- Gartner، Elaina M.؛ Griffith، Kent A.؛ Pan، Quintin؛ Brewer، George J.؛ Henja، Gwen F.؛ Merajver، Sofia D.؛ Zalupski، Mark M. (2009). "A pilot trial of the anti-angiogenic copper lowering agent tetrathiomolybdate in combination with irinotecan, 5-flurouracil, and leucovorin for metastatic colorectal cancer". Investigational New Drugs. ج. 27 ع. 2: 159–65. DOI:10.1007/s10637-008-9165-9. PMC:4171042. PMID:18712502.
- Pass، Harvey I.؛ Brewer، George J.؛ Dick، Robert؛ Carbone، Michele؛ Merajver، Sofia (2008). "A Phase II Trial of Tetrathiomolybdate After Surgery for Malignant Mesothelioma: Final Results". The Annals of Thoracic Surgery. ج. 86 ع. 2: 383–9, discussion 390. DOI:10.1016/j.athoracsur.2008.03.016. PMID:18640301.
- Brewer، G. J.؛ Merajver، S. D. (2002). "Cancer Therapy With Tetrathiomolybdate: Antiangiogenesis by Lowering Body Copper—A Review". Integrative Cancer Therapies. ج. 1 ع. 4: 327–37. DOI:10.1177/1534735402238185. PMID:14664727.
- Fan، Chuandong؛ Zhao، Jing؛ Zhao، Baoxiang؛ Zhang، Shangli؛ Miao، Junying (2009). "Novel Complex of Copper and a Salicylaldehyde Pyrazole Hydrazone Derivative Induces Apoptosis through Up-Regulating Integrin β4 in Vascular Endothelial Cells". Chemical Research in Toxicology. ج. 22 ع. 9: 1517–25. DOI:10.1021/tx900111y. PMID:19621939.
- Brewer، George J. (2001). "Copper Control as an Antiangiogenic Anticancer Therapy: Lessons from Treating Wilson's Disease". Experimental Biology and Medicine. ج. 226 ع. 7: 665–73. PMID:11444102. مؤرشف من الأصل في 12 مايو 2020. اطلع عليه بتاريخ أغسطس 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - Lowndes، Sarah A.؛ Harris، Adrian L. (2005). "The Role of Copper in Tumour Angiogenesis". Journal of Mammary Gland Biology and Neoplasia. ج. 10 ع. 4: 299–310. DOI:10.1007/s10911-006-9003-7. PMID:16924372.
- Díez، M.؛ Arroyo، M.؛ Cerdàn، F.J.؛ Muñoz، M.؛ Martin، M.A.؛ Balibrea، J.L. (1989). "Serum and Tissue Trace Metal Levels in Lung Cancer". Oncology. ج. 46 ع. 4: 230–4. DOI:10.1159/000226722. PMID:2740065.
- Sharma، K؛ Mittal، DK؛ Kesarwani، RC؛ Kamboj، VP؛ Chowdhery (1994). "Diagnostic and prognostic significance of serum and tissue trace elements in breast malignancy". Indian Journal of Medical Sciences. ج. 48 ع. 10: 227–32. PMID:7829172. مؤرشف من الأصل في 2016-02-01.
- Daniel، Kenyon G؛ Chen، Di؛ Orlu، Shirley؛ Cui، Qiuzhi؛ Miller، Fred R؛ Dou، Q Ping (2005). "Clioquinol and pyrrolidine dithiocarbamate complex with copper to form proteasome inhibitors and apoptosis inducers in human breast cancer cells". Breast Cancer Research. ج. 7 ع. 6: R897–908. DOI:10.1186/bcr1322. PMC:1410741. PMID:16280039.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - Chen، Jie؛ Du، Changsheng؛ Kang، Jiuhong؛ Wang، Jianmin (2008). "Cu2+ is required for pyrrolidine dithiocarbamate to inhibit histone acetylation and induce human leukemia cell apoptosis". Chemico-Biological Interactions. ج. 171 ع. 1: 26–36. DOI:10.1016/j.cbi.2007.09.004. PMID:17961528.
- Johnson، David K.؛ Murphy، Terrance B.؛ Rose، Norman J.؛ Goodwin، William H.؛ Pickart، Loren (1982). "Cytotoxic chelators and chelates 1. Inhibition of DNA synthesis in cultured rodent and human cells by aroylhydrazones and by a copper(II) complex of salicylaldehyde benzoyl hydrazone". Inorganica Chimica Acta. ج. 67: 159–65. DOI:10.1016/S0020-1693(00)85058-6.
- Pickart، Loren؛ Goodwin، William H.؛ Burgua، William؛ Murphy، Terrance B.؛ Johnson، David K. (1983). "Inhibition of the growth of cultured cells and an implanted fibrosarcoma by aroylhydrazone analogs of the Gly-His-Lys-Cu (II) complex". Biochemical Pharmacology. ج. 32 ع. 24: 3868–71. DOI:10.1016/0006-2952(83)90164-8. PMID:6661260.
- Ainscough، Eric W؛ Brodie، Andrew M؛ Denny، William A؛ Finlay، Graeme J؛ Gothe، Scott A؛ Ranford، John D (1999). "Cytotoxicity of salicylaldehyde benzoylhydrazone analogs and their transition metal complexes: quantitative structure–activity relationships". Journal of Inorganic Biochemistry. ج. 77 ع. 3–4: 125–33. DOI:10.1016/S0162-0134(99)00131-2. PMID:10643654.
- Lu، Yi-Heng؛ Lu، Yu-Wei؛ Wu، Cheng-Li؛ Shao، Qun؛ Chen، Xiao-Ling؛ Bimbong، Rosa Ngo Biboum (2006). "UV–visible spectroscopic study of the salicyladehyde benzoylhydrazone and its cobalt complexes". Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy. ج. 65 ع. 3–4: 695–701. Bibcode:2006AcSpA..65..695L. DOI:10.1016/j.saa.2005.12.032. PMID:16503413.
- Koh، L.L؛ Kon، O.L؛ Loh، K.W؛ Long، Y.C؛ Ranford، J.D؛ Tan، A.L.C؛ Tjan، Y.Y (1998). "Complexes of salicylaldehyde acylhydrazones: Cytotoxicity, QSAR and crystal structure of the sterically hindered t-butyl dimer". Journal of Inorganic Biochemistry. ج. 72 ع. 3–4: 155–62. DOI:10.1016/S0162-0134(98)10075-2. PMID:10094614.
- Xia، Yong؛ Fan، Chuan-Dong؛ Zhao، Bao-Xiang؛ Zhao، Jing؛ Shin، Dong-Soo؛ Miao، Jun-Ying (2008). "Synthesis and structure–activity relationships of novel 1-arylmethyl-3-aryl-1H-pyrazole-5-carbohydrazide hydrazone derivatives as potential agents against A549 lung cancer cells". European Journal of Medicinal Chemistry. ج. 43 ع. 11: 2347–53. DOI:10.1016/j.ejmech.2008.01.021. PMID:18313806.
- Fan، ChuanDong؛ Su، Hua؛ Zhao، Jing؛ Zhao، BaoXiang؛ Zhang، ShangLi؛ Miao، JunYing (2010). "A novel copper complex of salicylaldehyde pyrazole hydrazone induces apoptosis through up-regulating integrin β4 in H322 lung carcinoma cells". European Journal of Medicinal Chemistry. ج. 45 ع. 4: 1438–46. DOI:10.1016/j.ejmech.2009.12.048. PMID:20089331.
- Winner، Brooke؛ Peipert، Jeffrey F.؛ Zhao، Qiuhong؛ Buckel، Christina؛ Madden، Tessa؛ Allsworth، Jenifer E.؛ Secura، Gina M. (2012). "Effectiveness of Long-Acting Reversible Contraception". New England Journal of Medicine. ج. 366 ع. 21: 1998–2007. DOI:10.1056/NEJMoa1110855. PMID:22621627.
- Ortiz، María Elena؛ Croxatto، Horacio B. (يونيو 2007). "Copper-T intrauterine device and levonorgestrel intrauterine system: biological bases of their mechanism of action". Contraception. ج. 75 ع. 6 Suppl: S16‒S30. DOI:10.1016/j.contraception.2007.01.020. PMID:17531610. p. S28:
Conclusions
Active substances released from the IUD or IUS, together with products derived from the inflammatory reaction present in the luminal fluids of the genital tract, are toxic for spermatozoa and oocytes, preventing the encounter of healthy gametes and the formation of viable embryos. The current data do not indicate that embryos are formed in IUD users at a rate comparable to that of nonusers. The common belief that the usual mechanism of action of IUDs in women is destruction of embryos in the uterus is not supported by empirical evidence. The bulk of the data indicate that interference with the reproductive process after fertilization has taken place is exceptional in the presence of a T-Cu or LNG-IUD and that the usual mechanism by which they prevent pregnancy in women is by preventing fertilization. - "CopperInfo.com - Plant and Animal Health". مؤرشف من الأصل في 2012-02-18.
- بوابة طب
- بوابة علم الأحياء
- بوابة مطاعم وطعام