عظم
العظم[1] هو عضو صلب يكوّن جزء من الهيكل العظمي، يدعم العظم ويحمي الأعضاء المختلفة للجسم، وينتج كريات الدم الحمراء وخلايا الدم البيضاء، ويخزن المعادن، ويوفر الدعم للجسم، ويمكن من الحركة، تأخذ العظام العديد من الأشكال والأحجام ولها تركيب داخلي وخارجي معقد، رغم أن العظام خفيفة، إلا أنها قوية وصلبة، وتؤدي العديد من الوظائف.
| عظم | |
|---|---|
 | |
| تفاصيل | |
| يتكون من | عظم طويل، وعظم قصير، وعظم مسطح، وعظام غير منتظمة، وعظم سمسمي |
| نوع من | عضو حيواني ، ومنتج حيواني، وكيان تشريحي معين |
| جزء من | هيكل عظمي |
| معرفات | |
| ترمينولوجيا أناتوميكا | 02.0.00.000 |
| ترمينولوجيا هستولوجيكا | H3.01.00.0.00001 |
| FMA | 5018 |
| UBERON ID | 0001474 |
| ن.ف.م.ط. | A02.835.232، وA10.165.265 |
| ن.ف.م.ط. | D001842 |

النسيج العظمي هو نسيج صلب، وهو نوع من أنواع النسيج الضام الكثيف، وله مادة خلوية تشبه قرص العسل من الداخل، تساعد على صلابة العظام. يتكون نسيج العظام من أنواع عديدة من الخلايا العظمية، تشترك الخلايا العظمية والخلايا بانية العظم في تكوين وتمعدن العظم، فيما تشارك ناقضة العظم في تشربه، بانيات العظم المعدلة تصبح الخلايا المبطنة التي تكون طبقة وقائية على سطح العظمة. تملك المادة الخلوية المتمعدنة لنسيح العظم مكون عضوي من الكولاجين بشكل رئيسي، ومكون غير عضوي من معدن العظام، يتكون من أملاح مختلفة. النسيج العظمي هو نسيج متمعدن من نوعين، عظم قشري وعظم اسفنجي. تشمل أنواع الأنسجة الأخرى الموجودة في العظم نخاع العظام، وبطانة العظم، والسمحاق، والأعصاب، والأوعية الدموية، والغضروف.
يوجد ما يزيد عن 270 عظمة في جسم الإنسان عند الولادة،[2] لكن العديد منها يلتحم معًا خلال النمو، تاركًا 206 عظمة منفصلة في الشخص البالغ،[3] وذلك دون احتساب العظام السمسمية الصغيرة العديدة. العظمة الأكبر في الجسم هي عظمة الفخذ، أما الأصغر فهي الركاب في الأذن الوسطى.
التركيب

العظم ليس صلبًا بشكل موحد، وإنما يحتوي على مادة خلوية متينة. تكون تلك المادة الخلوية حوالي 30% من العظمة، فيما تتكون الـ70% الباقية من الأملاح التي تعطيها القوة. تتكون المادة الخلوية من حوالي 90-95% من ألياف الكولاجين، فيما تكون المادة الأساسية النسبة الباقية.[4] النسيج الأولي للعظمة، النسيج العظمي، يكون صلد نسبيًا وخفيف الوزن. وتتكون مادته الخلوية في الأغلب من مادة مركبة تشتمل على فوسفات الكالسيوم غير العضوي في التركيب الكيميائي المسمى هيدروكسيل أباتيت الكالسيوم (هذا هو معدن العظام الذي يعطي العظام صلابتها) والكولاجين، وهو بروتين مرن يزيد من المقاومة للكسور.[5] يعرف كولاجين العظام باسم عظمين.[6] يتكون العظم عن طريق تصلب تلك المادة الخلوية حول الخلايا المحتجزة. حين تصبح تلك الخلايا محتجزة تتحول من بانيات العظم إلى خلايا عظمية.
العظم القشري
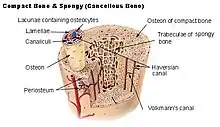
تتكون الطبقة الخارجية الصلبة للعظام من العظم القشري الذي يسمى كذلك عظم مدمج لكونه أكثر كثافة بكثير من العظم الاسفنجي، يشكل العظم القشري القشرة الخارجية الصلبة للعظم. يعطي العظم القشري العظمة مظهرها الأبيض، الصلب، الأملس، ويمثل 80% من الكتلة العظمية الكلية في هيكل الشخص البالغ. ويسهل من الوظائف الرئيسية للعظم: دعم الجسم بالكامل، وحماية الأعضاء، وتوفير رافعات للحركة، وتخزين وإطلاق المكونات الكيميائية، بالأخص الكالسيوم. يتكون العظم القشري من العديد من الأعمدة المجهرية، يسمى كل واحد منها عظمون. كل عمود هو عبارة عن طبقات عديدة من بانيات العظم والخلايا العظمية حول قناة مركزية تسمى قناة هافرس. قنوات فولكمان توصل الأعمدة ببعض بزاوية قائمة. تلك الأعمدة نشطة أيضيًا، وكلما يحدث تشرب للعظم وتكوينه من جديد تتغير طبيعة ومواقع تلك الخلايا خلال العظمون. يغطَّى العظم القشري بسمحاق على سطحه الخارجي، وبطانة العظم على سطحه الداخلي. بطانة العظام هي الحد الفاصل بين العظم القشري والعظم الاسفنجي.[7] الوحدة التشريحية والوظيفية الأولية للعظم القشري هي العظمون.
العظم الاسفنجي

العظم الإسفنجي، يسمى كذلك العظم التربيقي،[7] هو النسيج الداخلي للعظمة الهيكلية وهو عبارة عن شبكة خلوية مسامية مفتوحة. يمتلك العظم الإسفنجي نسبة مساحة السطح للحجم أكبر من تلك في العظم القشري نظرًا لأنه أقل كثافة. يجعله هذا أضعف وأكثر مرونة. كذلك تجعله مساحة السطح الأكبر مناسبًا للنشاطات الأيضية مثل تبادل أيونات الكالسيوم. يوجد العظم الإسفنجي تقليديًا في نهايات العظام الطويلة، وبالقرب من المفاصل، وفي داخل الفقرات. العظم الإسفنجي وعائي بشكل كبير ويحتوي عادة على نخاع عظام أحمر حيث يتم تكوين الدم، أي إنتاج خلايا الدم. الوحدة التشريحية والوظيفية الأولية للعظم الإسفنجي هي التربيق. تصطف الترابيق نحو توزيع الحمل الميكانيكي الذي يواجه العظام في العظام الطويلة مثل عظم الفخذ. فيما يخص العظام القصيرة، تم دراسة توزيع الترابيق في الفقرات.[8] تصنع تشكيلات رفيعة من بانيات العظم المغطاة ببطانة العظم شبكة غير منتظمة من المساحات،[7] تعرف باسم الترابيق. خلال هذه المساحات يوجد نخاع العظام والخلايا الجذعية المكونة للدم التي تكون الصفائح الدموية، وكريات الدم الحمراء، وخلايا الدم البيضاء.[7] النخاع التربيقي يتكون من شبكة العناصر المشابهة للعصيان ووالصفائح تجعل العضو أخف وتوفر مساحة للأوعية الدموية ونخاع العظام. يمثل العظم الإسفنجي 20% من الكتلة العظمية الكلية لكن مساحة سطحه تبلغ تقريبًا 10 أضعاف العظم القشري.[9]
الكلمات إسفنجي وتربيقي تشير للوحدات الصغيرة التي تشبه الشعرية (الترابيق) التي تكون النسيج. تم وصفها بشكل دقيق لأول مرة في نقوش كريزوستومو مارتينيز.[10]
نخاع العظام
نخاع العظام، يعرف كذلك باسم نقي العظم في نخاع العظام الأحمر، يمكن إيجاده بالكاد في أي عظمة تحتوي على عظم إسفنجي. في حديثي الولادة، تمتلئ كل تلك العظام بالنخاع الأحمر فقط أو النخاع المكون للدم، ولكن كلما زاد سن الطفل، تقل النسبة المكونة للدم من حيث الكمية فيما تزيد النسبة الشحمية/الصفراء من حيث الكمية. في البالغين، يوجد نخاع العظام الأحمر غالبا في نخاع العظام في عظمة الفخذ، والضلوع، والفقرات، وعظام الورك.[11]
النسيج العظمي

العظم هو نسيج نشط أيضيًا يتكون من أنواع متعددة من الخلايا. تشمل تلك الخلايا بانيات العظم، التي تشارك في صنع وتمعدن نسيج العظم، والخلايا العظمية، وناقضات العظم، التي تشارك فيتشرب العظم. تُشتق الخلايا العظمية وبانيات العظم من خلايا السليفة العظمية، فيما تُشتق ناقضات العظم من نفس الخلايا التي تتمايز لتكوين بلاعم وخلايا وحيدة.[7] يوجد كذلك خلال نخاع العظام الخلايا الجذعية المكونة للدم. تنشئ تلك الخلايا خلايا أخرى تشمل خلايا الدم البيضاء، وكريات الدم الحمراء، والصفائح الدموية.[7]
بانية العظم

- بانيات العظم هي خلايا أحادية النواة مكونة للعظم. توجد على سطح طبقات العظمون وتصنع مزيج من البروتينات يعرف باسم النسيج العظماني، والذي يتمعدن ليصبح عظمًا.[7] طبقة النسيج العظماني هي منطقة ضيقة من مادة خلوية عضوية حديثة التكون، لم تتمعدن بعد، وتوجد على سطح العظمة. يتكون النسيج العظماني بشكل رئيسي من كولاجين النوع الأول. تصنع كذلك بانيات العظم هرمونات، مثل بروستاغلاندين، لتعمل على العظمة نفسها. تصنع بانيات العظم وتصلح العظم الجديد عن طريق البناء حول نفسها. أولًا، تضع بانية العظم ألياف الكولاجين. تُستخدم ألياف الكولاجين تلك كإطار لعمل بانيات العظم. ثم تقوم بانيات العظم بترسيب فوسفات الكالسيوم الذي يتم تصليبه بواسطة أيونات الهيدروكسيد والبيكربونات. يسمى العظم الجديد الذي أنشأته بانيات العظم نسيج عظماني.[12] بمجرد إنهاء بانية العظم عملها يتم احتجهازها داخل العظمة بمجرد تصلبها. حين تصبح بانية العظم محتجزة، تسمى خلية عظمية.[13] تبقى بانيات عظم أخرى على سطح العظم الجديد وتستخدم لحماية العظم، وتصبح تلك الخلايا الخلايا المبطنة.
الخلية العظمية
الخلايا العظمية هي غالبا بانيات عظم غير نشطة.[7] تنشأ الخلايا العظمية من بانيات العظم التي هاجرت للداخل وأصبحت محتجزة ومحاطة بالمادة الخلوية للعظام التي أنتجتها بنفسها.[7] المساحات التي تشغلها تعرف باسم الجوبات. تمتلك الخلايا العظمية العديد من الزوائد التي تمتد لملاقاة بانيات العظم والخلايا العظمية الأخرى بهدف التواصل. تظل الخلايا العظمية على اتصال بالخلايا الأخرى في العظم عن طريق المفاصل الفجوية.
ناقضة العظم
- ناقضات العظم هي خلايا كبيرة جدا متعددة النوى مسؤولة عن انهيار العظام عن طريق عملية تشرب العظم. يتم بعد ذلك تكوين عظم جديد بواسطة بانيات العظم. يتم باستمرار تجدد العظم عن طريق التشرب والتصنيع.[7] ناقضات العظم هي خلايا كبيرة بها العديد من الأنوية وتتواجد على سطح العظم فيما يعرف باسم جوبات هاوشيب (أو حفر التشرب). تلم الجوبات تنتج عن تشرب العظم المحيط بها.[7] نظرًا لأن ناقضات العظم تُشتق من الخلايا الجذعية للخلايا الوحيدة، يتم تزويدها بآليات شبيهة بالبلعمة مشابهة للبلاعم التي تدور في الدم.[7] تنضج ناقضات العظم و/أو تهاجر لأسطح عظمية مختلفة. عند وصولها، يتم إفراز إنزيمات نشطة ضد الركيزة المعدنية. يلعب تشرب العظم بواسطة ناقضات العظم دورًا في استتباب الكالسيوم.[7]
النسيج البيني خارج الخلية
يتكون العظم من خلايا حية مغمورة في مادة خلوية عضوية متمعدنة. تتكون تلك المادة الخلوية من مكونات عضوية، كولاجين النوع الأول بشكل رئيسي، ومكونات غير عضوية، بشكل رئيسي هيدروكسيل أباتيت وأملاح أخرى من الكالسيوم والفوسفات. يتكون أكثر من 30% من الجزء غير الخلوي من العظم من المكونات العضوية، و70% من الأملاح.[14] تعطي ألياف الكولاجين العظم قوته المقاومة للشد، وتعطيه بلورات الهيدروكسيل أباتيت المتناثرة قوته المقاومة للانضغاط. تلك التأثيرات تآزرية.[14]
التركيب غير العضوي للعظم (معدن العظام) يتكون بشكل رئيسي من أملاح الكالسيوم والفوسفات، فيما يتمثل الملح الرئيسي في هيدروكسيل أباتيت Ca10(PO4)6(OH)2.[14] قد يكون التركيب الدقيق للمادة الخلوية عرضة للتغير عبر الوقت بسبب التغذية، والتمعدن الحيوي، حيث تتنوع نسبة الكالسيوم للفوسفات بين 1.30 لـ2، كما توجد معادن نادرة كذلك مثل الماغنسيوم، والصوديوم، والبوتاسيوم، والكربونات.[14]
يشكل كولاجين النوع الأول 90-95% من المادة الخلوية العضوية، فيما يتمثل الباقي في سائل متجانس يسمى المادة الأساسية تتكون بروتيوغليكانات مثل حمض الهيالورونيك، وسلفات الكوندرويتين،[14] بالإضافة للبروتينات غير الكولاجينية مثل أوستيوكالسين، أو أوستيوبونتين، أو سيالوبروتين العظم. يتكون الكولاجين من خيوط من وحدات التكرار، والتي تعطي العظمة القوة المقاومة للشد، وترتب بشكل متقاطع يمنع الإجهاد السطحي. أما وظيفة المادة الأساسية فغير معروفة بالكامل.[14] يمكن التعرف على نوعين من العظام مجهريًا وفقًا لترتيب الكولاجين: محبوك وصفائحي
- العظم المحبوك، (يعرف كذلك بالعظم الليفي) والذي يتميز بترتيب عشوائي لألياف الكولاجين وضعيف ميكانيكيًا.[15]
- العظم الصفائحي، والذي يملك ترتيب منظم متوازي للكولاجين في صفائح وقوي ميكانيكيًا.[15]

يتكون العظم المحبوك حين تنتج بانيات العظم نسيج عظماني سريعًا، وهو ما يحدث أوليًا في كل عظم الجنين، ولكن يستبدل لاحقًا بعظم صفائحي أكثر مرونة. في البالغين يتم تصنيعه بعد الكسور أو في مرض بادجيت. العظم المحبوك أضعف، وله عدد أصغر من ألياف الكولاجين الموزعة عشوائيًا، لكنه يتكون بسرعة، ويسمى محبوك بسبب مظهر المادة الخلوية الليفية. يستبدل بعد ذلك بالعظم الصفائحي، المنظم بشكل كبير في صفائح متحدة المركز مع نسبة أقل بكثير من الخلايا العظمية للنسيج المحيط. العظم الرقائقي، الذي يظهر لأول مرة في الجنين في الثلث الأخير من الحمل، أقوى ويمتلئ بالعديد من ألياف الكولاجين الموازية لألياف أخرى في نفس الطبقة (تسمى تلك الأعمدة المتوازية عظمونات). فيالمقطع العرضي، تجري الألياف في اتجاهات متعاكسة في طبقات متبادلة، كما في الأبلكاش، ما يساعد العظم على مقاومة قوى اللي. بعد الكسر، يتكون العظم المحبوك أولًا ثم يستبدل تدريجيًا بالعظم الرقائقي في عملية تعرف بـ«التبديل العظمي». مقارنة بالعظم المحبوك، العظم الرقائقي يتكون بشكل أبطأ. يحد الترسيب المنظم لألياف الكولاجين من تكوين النسيج العظماني إلى 1-2 ميكرومتر في اليوم.
التطور
.jpg.webp)
تكوين العظام يسمى التعظم. خلال تطور الجنين يحدث التعظم عن طريق عمليتين: التعظم الغشائي والتعظم داخل الغضروف. التعظم الغشائي يشمل تكوين عظم جديد من النسيج الضام بينما يشمل التعظم داخل الغضروف تكوين عظم من الغضروف.
التعظم الغشائي يحدث بشكل رئيسي خلال تكوين عظام الجمجمة المسطحة ولكن يحدث كذلك في الفك السفلي، والفك العلوي، والترقوة، يتكون العظم من نسيج ضام مثل نسيج اللحمة المتوسطة بدلا من الغضروف. تتضمن العملية: تطور ونشأة مركز التعظم، والتكلس، وتكون الترابيق ونشأة السمحاق.
التعظم داخل الغضروف يحدث في العظام الطويلة وأغلب العظام الأخرى في الجسم، ويشمل تطور العظم من الغضروف. تتضمن تلك العملية نشأة نموذج الغضروف، ونموه وتطوره، ونشأة مراكز التعظم الأولية والثانوية، وتكوين غضروف مفصلي والصفائح المشاشية.
يبدأ التعظم داخل الغضروف من نقط في الغضروف تسمى «مراكز التعظم الأولية». تظهر غالبا خلال تطور الجنين، رغم أن بعض العظام القصيرة تبدأ تعظمها الأولي بعد الولادة. تلك المراكز مسؤولة عن تكوين جسم العظام الطويلة، والقصيرة وبعض أجزاء العظام غير المنتظمة. يحدث التعظم الثانوي بعد الولادة، ويكون مشاشة العظام الطويلة وأطراف العظام المسطحة وغير المنتظمة. ينفصل جسم العظمة الطويلة عن المشاشتين بمنطقة من الغضروف النامي (الصفيحة المشاشية). عند النضج العظمي (من 18 لـ25 سنة)، تستبدل كل الغضاريف بعظام، ويلتحم جسم العظمة مع المشاشتين. في الأطراف العلوية، يتعظم فقط جسم العظام الطويلة ولوح الكتف. فيما تظل المشاشات، وعظام الرسغ، والناتئ الغرابي، والحافة الأنسية للوح الكتف، والأخرم غضروفية.[16]
تحدث الخطوات التالية في تحويل الغضروف إلى عظم:
- منطقة الغضروف المستريح. تحتوى هذه المنطقة علي غضروف طبيعي زجاجي ليس عليه أي علامات للتحول لعظم تلك المنطقة هي الأبعد عن جوف النقي.[17]
- منطقة انتشار الخلايا. أقرب بقليل لجوف النقي، في هذه المنطقة، تنقسم الخلايا الغضروفية سريعا وتشكل مظهر متكدس متميز.[17]
- منطقة تضخم الخلايا. بعد ذلك، تتوقف الخلايا الغضروفية عن الانقسام وتبدأ في التضخم، كما تفعل في مركز التعظم الأولي في الجنين.[17]
- منطقة التكلس. يتم ترسيب المعادن في المادة الخلوية ما يحدث تكلس للغضروف. تلك ليست الرواسب المعدنية الدائمة للعظمة، وإنما مجرد دعم مؤقت للغضروف الذي بدونها يصبح ضعيفًا.
- منطقة التعظم. الخلايا سليفة العظمية تغزو المنطقة وتتمايز الي بانيات عظم، وهذا يفصل المادة الخلوية التي أصبحت عظمية علي سطح الغضروف المتعظم. ويتبعه تشرب الغضروف المتعظم.[17]
الوظيفة
| وظائف العظم |
|---|
وظائف ميكانيكية
|
وظائف تصنيعية
|
وظائف أيضية
|
للعظام العديد من الوظائف:
ميكانيكية
تفيد العظام في العديد من الوظائف الميكانيكية. حيث تشكل العظام معًا الهيكل العظمي للجسم والذي يوفر إطارًا لدعم الجسم، ونقاط توصيل للعضلات الهيكلية، والأوتار، والأربطة، والمفاصل، والتي تؤدي معًا لتوليد ونقل قوى لجعل جزء من الجسم أو الجسم بالكامل يتحرك في مساحة ثلاثية الأبعاد (تتم دراسة العلاقة بين العظم والعضلات في الميكانيكا الحيوية).
تحمي العظام الأعضاء الداخلية، فمثلا تحمي الجمجمة المخ وتحمي الضلوع القلب والرئتين. بسبب الطريقة التي تتكون بها العظام، فإنها تملك قوة كبيرة مقاومة للانضغاط تبلغ 170 باسكال (1800 كيلوغرام ثقلي/سم²)،[5] وقوة ضعيفة مقاومة للشد تبلغ 104-121 باسكال، وقوة منخفضة للغاية لإجهاد القص (51.6 باسكال).[18][19] يعني هذا أن العظام تقاوم الضغط جيدًا، وتقاوم الشد بشكل أقل، ولكنها بالكاد تقاوم إجهاد القص (كما في أحمال اللي). وبينما العظام هشة، فإنها تملك درجة كبيرة من المرونة، تنتج بشكل رئيسي عن الكولاجين.[20]
تلعب العظام كذلك دورًا خاصا في السمع. العظيمات هي 3 عظمات صغيرة في الأذن الوسطى تساهم في نقل الصوت.
تصنيعية
يحتوي الجزء الإسفنجي من العظم على نخاع العظام. ينتج نخاع العظام خلايا الدم في عملية تسمى تكون الدم.[21] خلايا الدم التي تصنع في نخاع العظام تشمل كريات الدم الحمراء، والصفائح الدموية، وخلايا الدم البيضاء. الخلايا المولدة مثل الخلية الجذعية المكونة للدم تنقسم في عملية تسمى الانقسام المتساوي (الميتوزي) لإنتاج الخلايا السلائف. وتتضمن الخلايا السلائف التي تنشئ في النهاية خلايا الدم البيضاء وكريات الدم الحمراء. على عكس خلايا الدم الحمراء والبيضاء، المصنوعة بالانقسام الميتوزي، تنسل الصفائح الدموية من خلايا كبيرة جدا تسمى خلية نواء. عملية التمايز التدريجي تلك تحدث في نخاع العظام. بعدما تنضج الخلايا، فإنها تدخل جهاز الدوران. يوميًا، يتم إنتاج ما يزيد عن 2.5 مليار كرية دم حمراء، وصفيخة دموية و50-100 مليار خلية محببة.[7]
بالإضافة لصنع الخلايا، يعد نخاع العظام واحدًا من المواقع الرئيسية التي يتم فيها تدمير كريات الدم الحمراء المسنة أو التالفة.
أيضية
- تخزين المعادن - تعمل العظام كمخازن للمعادن المهمة للجسم، وبالأخص الكالسيوم والفسفور[22][23]
- التوازن الحمضي القاعدي - يعادل العظم الدم ضد التغيرات الزائدة في الأس الهيدروجيني عن طريق امتصاص أو إخراج الأملاح القلوية
- إزالة السموم - تستطيع أنسجة العظم تخزين المفلزات الثقيلة وغيرها من العناصر الغريبة، بحيث تزيلهم من الدم وتقلل من تأثيرهم على الأنسجة الأخرى. تم تطلقهم بعد ذلك تدريجيًا من أجل الإخراج.
- عضو في جهاز الغدد الصماء - يتحكم العظم في أيض الفوسفات عن طريق إطلاق مادة تعمل على الكلى لتقليل إعادة امتصاص الفوسفات. كذلك تطلق خلايا العظم هرمون يسمى أوستيوكالسين، يساهم في تنظيم سكر الدم والنسيج الدهني. يزيد أوستيوكالسين من إفراز وحساسية الإنسولين، بالإضافة لزيادة عدد الخلايا المفرزة للإنسولين وتقليل مخازن الدهون.[24] الهدف من تجدد العظام هو تنظيم استتباب الكالسيوم، وصيانة العظام التالفة على المستوى المجهري من الضغط اليومي، ولتشكيل الهيكل خلال النمو. الإجهاد المتكرر، مثل رياضة رفع الأثقال، أو التئام العظم، يتسببان في زيادة سمك العظمة في نقطة الإجهاد الأقصى. من المفترض أن هذا يحدث بسبب خاصية الكهرباء الانضغاطية للعظم، التي تجعل العظمة تولد جهد كهربي صغير عند الإجهاد.[25]
يتم التحكم في وظيفة بانيات وناقضات العظم عن طريق عدد من الإنزيمات التي تحفز أو تثبط نشاط خلايا تجدد العظام، متحكمة في معدل تصنيع، وتدمير العظام وتغيير شكلها. على سبيل المثال، معدل تشرب العظام بواسطة ناقضات العظم يتم تثبيطه بواسطة الكالسيتونين وosteoprotegerin. يتم إنتاج الكالسيتونين بواسطة الغدة الدرقية، ويمكن أن يرتبط بالمستقبلات على ناقضات العظم لتثبيط نشاطها بشكل مباشر. Osteoprotegerin يتم إفرازه بواسطة بانيات العظم ويثبط تحفيز ناقضات العظم
يمكن أن يتم تحفيز بانيات العظم لزيادة الكتلة العظمية من خلال زيادة إفراز العظماني وعن طريق تثبيط قدرة ناقضات العظم على تكسير النسيج العظمي. زيادة إفراز العظماني تتم عن طريق تحفيزه بواسطة إفراز هرمون النمو من الغدة النخامية، وهرمون الثيروكسين من الدرقية، والهرمونات الجنسية (إستروجين وأندروجين). تزيد تلك الهرمونات كذلك من إفراز osteoprotegerin.[26] يمكن كذلك تحفيز بانيات العظم لإفراز عدد من السيتوكينات التي تساعد على تشرب العظم بواسطة تحفيز نشاط ناقضات العظم وتمايزها من خلايا السليفة العظمية. فيتامين د، والهرمون الجار درقي والمحفزات من الخلايا العظمية تحفز بانيات العظم لزيادة إفراز إنترلوكين 6، وربيطة RANK، التي تزيد من تشرب العظم. نفس تلك المركبات كذلك تزيد إفراز عامل تحفيز مستعمرات الخلايا الأكولة بواسطة بانيات العظم، والذي يساعد على تمايز خلايا السليفة العظمية إلى ناقضات العظم ويقلل من إفراز بروتين أوستيوبروتيجرين [الإنجليزية].
حجم العظم
يعتمد حجم العظم على معدلات تكوين وتشرب العظم. اقترح بحثًا حديثًا أن بعض عوامل النمو قد تعمل موضعيًا لتعدل من تكوين العظم عن طريق زيادة نشاط بانية العظم. العديد من عوامل النمو المشتقة من العظم تم فصلها وتصنيفها من خلال مزارع العظم. تشمل تلك العوامل عامل النمو شبيه الانسولين 1 و2، وعامل النمو المحول بيتا، وعوامل نمو الأرومة الليفية، وعامل النمو المشتق من الصفيحات.[27] تقترح الأدلة أن خلايا العظم تنتج عوامل نمو للتخزين خارج الخلية في النسيج البيني. قد يتسبب إطلاق تلك المواد من النسيج البيني في انقسام سلائف بانيات العظم. اقترح البحث أن حجم العظم الإسفنجي في هشاشة العظام بعد سن اليأس يمكن تحديدها بالعلاقة بين السطح الكلي لتشكيل العظام ونسبة تشرب السطح.[28]الأهمية السريرية
يؤثر عدد من الأمراض على العظام، ويشمل التهاب المفاصل، والكسور، والعدوى، وهشاشة العظام، والأورام. الأمراض المتعلقة بالعظام يمكن علاجها بواسطة مجموعة متنوعة من الأطباء، وتشمل طبيب روماتزم للمفاصل، وجراح عظام، الذي قد يجري جراحة لإصلاح العظام المكسورة. أطباء آخرون مثل أخصائيو إعادة التأهيل يمكن أن يشاركوا في التعافي، وأطباء الأشعة في تفسير الأشعة، وأطباء علم الأمراض في دراسة سبب المرض، وطبيب العائلة قد يلعب دورًا في منع مضاعفات مرض العظام كالهشاشة.
حين يرى الطيب مريضًا، يتم أخد التاريخ المرضي وفحص المريض. يتم بعد ذلك غالبًا تصوير العظام، فيما يعرف بالتصوير الشعاعي. وقد يشمل ذلك الموجات فوق الصوتية، والأشعة السينية، والتصوير المقطعي، وأشعة الرنين المغناطيسي، وصور أخرى مثل الأشعة الملونة، التي يمكن استخدامها لدراسة حالات السرطان.[29] يمكن عمل اختبارات أخرى مثل اختبارات الدم للبحث عن علامات أمراض المناعة الذاتية، أو نضح السائل الزلالي.[29]
الكسور
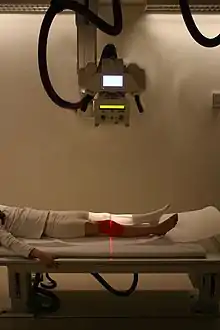 تصوير شعاعي للتعرف على كسور العظم المحتملة بعد إصابة للركبة
تصوير شعاعي للتعرف على كسور العظم المحتملة بعد إصابة للركبةفي العظم الطبيعي، تحدث الكسور حين تتعرض لقوة كبيرة، أو رضة متكررة لمدة طويلة. يمكن كذلك أن تحدث الكسور حين تصبح العظام ضعيفة، كما في هشاشة العظام، أو حين تكون هناك مشكلة تركيبية، مثلا عندما يتجدد العظم بشكل مبالغ فيه (مثل مرض بادجيت) أو في مكان نمو سرطان.[30] الكسور الشائعة تتضمن كسور الرسغ، وكسور الورك، والكسور المصاحبة لهشاشة العظام، وكسور الفقرات المصاحبة للسرطان أو الرضة عالية الطاقة، وكسور العظام الطويلة. ليست كل الكسور مؤلمة.[30] حين تكون الكسور خطيرة، بحسب نوع الكسر ومكانه، قد تشمل المضاعفات الصدر السائب، ومتلازمة الحيز، والانصمام الدهني. الكسور المضاعفة تتضمن اختراق العظم للجلد. بعض الكسور المعقدة يمكن علاجها باستخدام إجراءات التطعيم العظمي التي تستبدل قطع العظم المفقودة.
يتم التحقق من الكسور وأسبابها بواسطة الأشعة السينية، والتصوير المقطعي، والتصوير بالرنين المغناطيسي.[30] توصف الكسور بمكانها وشكلها، وتوجد أنظمة تصنيف عديدة، بحسب موقع الكسر. أحد الكسور الشائعة في العظام الطويلة في الأطفال هي كسور سالتر هاريس.[31] أثناء علاج الكسور، يتم إعطاء مسكن للألم، وتثبيت المنطقة المكسورة. يساعد هذا على التئام الكسر. بالإضافة لذلك، قد يتم استخدام إجراءات جراحية مثل التثبيت الداخلي.[30]
الأورام
توجد أنواع عديدة من الأورام التي تؤثر على العظم، الأمثلة على أورام العظام الحميدة تشمل الورم العظمي، والورم العظمي العظماني، والورم العظمي الغضروفي، وورم بانيات العظام، والورم الغضروفي الباطن، وورم الخلايا العملاقة للعظم، وتمدد تكيسات العظام.[32]
السرطان
يمكن أن ينشأ السرطان في نسيج العظام، والعظام أيضًا هي أماكن شائعة لانبثاث السرطانات الأخرى.[33] تسمى السرطانات التي تنشأ في العظام سرطانات «أولية» رغم أن مثل ذلك النوع من السرطان نادر.[33] الانبثاث للعظم يسمى سرطان «ثانوي»، وأكثر السرطانات شيوعًا في ذلك المجال هي سرطان الثدي، وسرطان الرئة، وسرطان البروستاتا، وسرطان الغدة الدرقية، وسرطان الكلية.[33] يمكن للسرطانات الثانوية التي تؤثر على العظم أن تدمر العظم (سرطان حال) أو أن تصنع العظم (سرطان تصلبي). سرطانات نخاع العظام يمكن أن تصيب كذلك نسيج العظم نفسه، مثل ابيضاض الدم والورم النخامي المتعدد. يمكن أن تتأثر العظام بسرطانات في أجزاء أخرى من الجسم. حيث تفرز تلك السرطانات هرمون جار درقي أو بيبتيد مرتبط بذلك الهرمون ما يزيد من تشرب العظم وقد يؤدي لكسر العظم.
نسيج العظم الذي يتم تدميره أو تبديله بسبب السرطان يكون مشوه، وضعيف، وأكثر عرضة للكسر. قد يؤدي ذلك إلى انضغاط النخاع الشوكي، وتدمير النخاع ما يؤدي إلى الرضة، والنزف، وتثبيط المناعة، وهو أحد أسباب ألم العظام. إذا كان السرطان منبثًا، قد تكون هناك أعراض أخرى بحسب مكان السرطان الأصلي.
يتم علاج سرطانات العظام بحسب نوعها، ومرحلتها، والمآل، والأعراض التي تسببها. العديد من السرطانات الأولية تعالج بالأشعة. سرطانات نخاع العظام قد تحتاج للعلاج الكيميائي، وبعض أنواع العلاج ألأخرى مثل العلاج المناعي.[33] الرعاية التلطيفية، التي تركز على تحسين جودة حياة المريض، قد تلعب دورًا في العلاج، بالأخص إذا كانت فرصة النجاة لخمس سنوات ضعيفة.
الأمراض المؤلمة
- التهاب العظم والنقي بسبب العدوى البكتيرية.
- تكون العظم الناقص
- التهاب العظم والغضروف السالخ
- التهاب المفاصل
- التهاب الفقار القسطي
- التسمم الهيكلي بالفلور هو مرض عظمي بسبب تراكم الفلوريد في العظام. في الحالات المتقدمة، يتسبب المرض في تلف العظام والمفاصل ويكون مؤلمًا
هشاشة العظام
هشاشة العظام هي مرض يصيب العظام تقل فيه كثافة العظام، ما يزيد من احتمالية الكسر.[34] تعرف منظمة الصحة العالمية هشاشة العظام في النساء على أنها كثافة عظم تبلغ 2.5 انحراف معياري أقل من ذروة الكتلة العظمية، بالنسبة للسن والجنس. يتم قياس الكثافة باستخدام مقياس امتصاص الأشعة السينية ثنائي البواعث، ويطلق مصطلح «هشاشة عظام مثبتة» على الحالات التي تشمل كسر مرضي.[35] هشاشة العظام أكثر شيوعًا في النساء بعد سن اليأس، لكنه قد يحدث في الرجال وفي النساء قبل سن اليأس في وجود اختلالات هرمونية معينة وأمراض مزمنة أخرى، أو نتيجة للتدخين أو الأدوية، بالأخص كورتيكوستيرويد.[34] غالبا لا تظهر أعراض لهشاشة العظام حتى يحدث كسر.[34] لذلك، يتم عمل مقياس امتصاص الأشعة السينية ثنائي البواعث في الأشخاص الذين لديهم عامل خطر واحد أو كثر، والذين لديهم هشاشة بالفعل ومعرضين للكسر.[34]
يشمل علاج هشاشة العظام النصيحة بوقف التدخين، وتقليل الكحوليات، وممارسة الرياضة بانتظام، واتباع نظام غذائي صحي. قد يتم إعطاء كالسيوم ومعادن نادرة، وفيتامين د كذلك. في حالة استخدام الأدوية فقد تشمل بيسفوسفونات، ورانيلات السترونشيوم، والعلاج باستخدام الهرمونات البديلة.[36]
الطب التقويمي
الطب التقويمي هو مدرسة من الفكر الطبي نشأة بشكل أساسي اعتمادًا على فكرة الترابط بين الجهاز العضلي والصحة بشكل عام، إلا أنه الآن أصبح مشابه للغاية للطب الشائع. اعتبارًا من 2012، ما يزيد عن 77,000 طبيب تدربوا في كليات الطب التقويمي في الولايات المتحدة.[37]
علم العظام
إلى دراسة العظام والأسنان بعلم العظام. يستخدم عادة في علم الإنسان، وعلم الآثار، وعلم الأدلة الجنائية للعديد من المهام. قد يتضمن ذلك تحديد الحالة الغذائية، أو الصحية للشخص، أو سنه، أو إصابته. تحضير عظام اللحم لهذه الأنواع من الدراسات يمكن أن ينطوي على عملية التعطين. عظمة الفخذ والعضد لشخص من العصر الروماني، مع دليل على كسور ملتئمة يشار
عظمة الفخذ والعضد لشخص من العصر الروماني، مع دليل على كسور ملتئمة يشارعادة يدرس علماء الإنسان وعلماء الآثار الأدوات العظمية المصنوعة بواسطة الإنسان العاقل والنياندرتال. قد تفيد العظام في عدد من الاستعمالات مثل استعمالها كقذائف أو كصبغات فنية.
حيوانات أخرى
 تسمم هيكلي بالفلور في ساق بقرة، بسبب التلوث الصناعي
تسمم هيكلي بالفلور في ساق بقرة، بسبب التلوث الصناعي عظم الساق وحزام الحوض في طائر
عظم الساق وحزام الحوض في طائرهياكل الطيور خفيفة الوزن جدا. عظامهم أصغر وأرفع لتساعد على الطيران. ضمن الثدييات، الخفافيش هي الأقرب للطيور فيما يتعلق بكثافة العظام، ما يقترح أن الكثافة الصغيرة للعظم هي تكيف على الطيران. العديد من عظام الطيور تحتوي على نخاع قليل نظرا لكونها مجوفة.[38]
منقار الطائر مصنوع بشكل رئيسي من العظم في صورة بروز من الفك السفلي ومغطى بالكيراتين.
تتكون قرون الغزال من عظم وهو مثال غير تقليدي لعظم خارج جلد الحيوان بمجرد تقشير المخمل.[39]
سمك دنكليوستيوس المفترس له حواف حادة من العظم بطول فكيه.[40][41]
تمتلك العديد من الحيوانات هيكل خارجي غير مصنوع من العظم ويشمل ذلك الحشرات والقشريات.
قد تكون نسبة العظم القشري والتي تبلغ 80% في الهيكل البشري أقل بكثير في حيوانات أخرى، بالأخص في الثدييات البحرية، والسلاحف البحرية، أو في زواحف بحرية متنوعة من العصور الوسطى مثل اكتيوصور،[42] وغيره.[43]
تمارس العديد من الحيوانات بالأخص الحيوانات العاشبة تناول العظم كطعام. يتم ذلك غالبًا لتعويض نقص الفوسفات.
تصيب العديد من أمراض العظام البشرية الفقاريات الأخرى مثل التسمم الهيكلي بالفلور.
المجتمع والثقافة
لعظام الحيوانات المذبوحة عدد من الاستعمالات. في عصر ما قبل التاريخ، تم استخدامها في صنع الأدوات العظمية. تم استخدامها كذلك في نحت العظام، وكانت مهمة في فن ما قبل التاريخ، وكذلك تم استخدامها في العصور الحديثة كمواد صياغة للأزرار، والخرز، والمقابض، والنرد، والحلي، والبكر، إلخ.
يتم تصنيع الصمغ الحيواني عن طريق الغلى المطول للعظام المكسورة أو المطحونة، ثم تصفيتها وتبخيرها لزيادة سمك السائل الناتج. تاريخيًا، كان الصمع الحيواني مهمًا للغاية إلا أن له استعمالات محددة معدودة الآن، كما في ترميم التحف القديمة. تستخدم نفس الطريقة مع مزيد من التعديل، وزيادة السمك، والتجفيف لتحضير الجيلاتين.
يصنع المرق عن طريق طبخ العديد من المكونات على نار هادئة لفترة طويلة، وتقليديا تشمل تلك المكونات العظام.
تستخدم العظام المطحونة كسماد فوسفوري نيتروجيني عضوي وكإضافة لغذاء الحيوانات. العظام، بالأخص بعد تكليس رماد العظام، تستخدم كمصدر لفوسفات الكالسيوم لإنتاج الخزف العظمي.
الفحم العظمي، وهو مادة سوداء مسامية حبيبية، تستخدم بشكل رئيسي للترشيح وكذلك كصبغة سوداء، يتم إنتاجه عن طريق تفحيم عظام الثدييات.
توجيه العظم نحو شخص ما يعتبر حظًا سيئًا في بعض الثقافات، مثل الأستراليون الأصليون.
تم استخدام فريقة الدجاوزيات للكهانة، ولا يزال يتم استخدامها عادة في تقليد لتحديد أي من الشخصين اللذان يشدان نهايتي العظمة قد يقوم بتمني أمنية.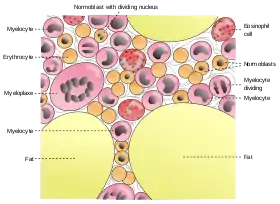 خلايا في نخاع العظام
خلايا في نخاع العظام صورة مجهرية بالمجهر الإلكتروني للعظم بتكبير 100 مرة
صورة مجهرية بالمجهر الإلكتروني للعظم بتكبير 100 مرة
صور إضافية
انظر أيضًا
مراجع
- المعجم الموحد لمصطلحات علم الأحياء، قائمة إصدارات سلسلة المعاجم الموحدة (8) (بالعربية والإنجليزية والفرنسية)، تونس العاصمة: مكتب تنسيق التعريب، 1993، ص. 57، OCLC:929544775، QID:Q114972534
- Steele, D. Gentry؛ Claud A. Bramblett (1988). The Anatomy and Biology of the Human Skeleton. Texas A&M University Press. ص. 4. ISBN:0-89096-300-2. مؤرشف من الأصل في 2020-01-02.
- Mammal anatomy : an illustrated guide. New York: Marshall Cavendish. 2010. ص. 129. ISBN:9780761478829. مؤرشف من الأصل في 2022-06-23.
{{استشهاد بكتاب}}: صيانة الاستشهاد: التاريخ والسنة (link) - Hall، John (2011). Textbook of Medical Physiology (ط. 12th). Philadelphia: Elsevier. ص. 957–960. ISBN:978-08089-2400-5.
- Schmidt-Nielsen, Knut (1984). "Scaling: Why Is Animal Size So Important?". Cambridge: Cambridge University Press: 6. ISBN:0-521-31987-0. مؤرشف من الأصل في 2022-06-30.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة) - "ossein". The Free Dictionary. مؤرشف من الأصل في 2018-08-10.
- Deakin 2006.
- Gdyczynski، C.M.؛ Manbachi، A.؛ وآخرون (2014). "On estimating the directionality distribution in pedicle trabecular bone from micro-CT images". Journal of Physiological Measurements. ج. 35 ع. 12: 2415–2428. DOI:10.1088/0967-3334/35/12/2415.
- Hall، Susan J. (2007). Basic Biomechanics with OLC (ط. 5th ed., Revised.). McGraw-Hill Higher Education. ص. 88. ISBN:0-07-126041-2.
- Gomez، Santiago (فبراير 2002). "Crisóstomo Martinez, 1638-1694: the discoverer of trabecular bone". Endocrine. ج. 17 ع. 1: 3–4. DOI:10.1385/ENDO:17:1:03. ISSN:1355-008X. PMID:12014701.
- Barnes-Svarney، Patricia L.؛ Svarney، Thomas E. (2016). The Handy Anatomy Answer Book : Includes Physiology. Visible Ink Press. ص. 90–91. ISBN:9781578595426.
- Washington. "The O' Cells." Bone Cells. University of Washington, n.d. Web. 03 Apr. 2013.
- Davis, Michael. "DrTummy.com | DrTummy.com." DrTummy.com | DrTummy.com. Dr. Tummy, n.d. Web. 03 Apr. 2013.
- Hall 2005.
- Currey, John D. (2002). "The Structure of Bone Tissue", pp. 12–14 in Bones: Structure and Mechanics. Princeton University Press. Princeton, NJ. (ردمك 9781400849505) نسخة محفوظة 25 أبريل 2017 على موقع واي باك مشين. [وصلة مكسورة]
- Agur، Anne (2009). Grant's Atlas of Anatomy. Lippincott, Williams, and Wilkins. ص. 598. ISBN:978-0-7817-7055-2.
- Saladin، Kenneth (2012). Anatomy and Physiology: The Unity of Form and Function. McGraw-Hill. ص. 217. ISBN:978-0-07-337825-1.
- Vincent, Kevin. "Topic 3: Structure and Mechanical Properties of Bone". BENG 112A Biomechanics, Winter Quarter, 2013. Department of Bioengineering, University of California. مؤرشف من الأصل في 28 مايو 2018. اطلع عليه بتاريخ أكتوبر 2020.
{{استشهاد بكتاب}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - Turner، C.H.؛ Wang، T.؛ Burr، D.B. (2001). "Shear Strength and Fatigue Properties of Human Cortical Bone Determined from Pure Shear Tests". Calcified Tissue International. ج. 69 ع. 6: 373–378. DOI:10.1007/s00223-001-1006-1. PMID:11800235.
- Levrero، F.؛ Margetts، L.؛ وآخرون (2016). "Evaluating the macroscopic yield behaviour of trabecular bone using a nonlinear homogenisation approach". Journal of the Mechanical Behavior of Biomedical Materials. ج. 61: 384–396. DOI:10.1016/j.jmbbm.2016.04.008. مؤرشف من الأصل في 2018-10-04.
- Doyle, Máire E.; Jan de Beur, Suzanne M.; McGrath, Cody; Wu, Xin; Sen, Buer; Uzer, Gunes; Xie, Zhihui; Zong, Xiaopeng; Styner, Martin A (2017-05-01). "The Skeleton: Endocrine Regulator of Phosphate Homeostasis". Current Osteoporosis Reports (بالإنجليزية). 6: 134–141. DOI:10.1007/s11914-008-0024-6. ISSN:1523-4681. Archived from the original on 2018-01-26 – via Google Scholar.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|سنة=/|تاريخ=mismatch (help)تحقق من التاريخ في:|year= / |date= mismatch -
وفقًا للفصيلة، والسن، ونوع العظم، تمثل خلايا العظم حوالي 15% من العظم.
- تخزين عامل النمو - المادة الخلوية المتمعدنة للعظم تخزن عوامل نمو هامة مثل عامل النمو شبيه الانسولين، وعامل النمو المحول وغيرهما.
- توازن الكالسيوم - عملية تشرب العظم بواسطة ناقضات العظم تطلق الكالسيوم المخزن إلى جهاز الدوران وهي عملية مهمة في تنظيم توازن الكالسيوم. بينما يثبت تكوين العظام الكالسيوم الموجود في الدورة الدموية في شكله المعدني، ما يزيله من تيار الدم، يقوم تشرب العظم بعمل العكس ما يزيد مستوى الكالسيوم في الدم.
تجدد العظم
يتم باستمرار تصنيع العظم واستبداله في عملية تعرف بتجدد العظام. هذا الدوران المستمر للعظم هو عبارة عن عملية تشرب العظم متبوعة باستبداله بعظم مع تغير بسيط في الشكل. يحدث ذلك عن طريق بانيات العظم وناقضات العظم. يتم تحفيز الخلايا بواسطة إشارات مختلفة. تتجدد حوالي 10% من الكتلة الهيكلية للشخص البالغ سنويا.<ref>Manolagas، SC (أبريل 2000). "Birth and death of bone cells: basic regulatory mechanisms and implications for the pathogenesis and treatment of osteoporosis". Endocrine Reviews. ج. 21 ع. 2: 115–37. DOI:10.1210/edrv.21.2.0395. PMID:10782361. - Boulpaep, Emile L.، Russell T. Woodburne..., consulting؛ Boron, Walter F. (1999). Anatomy, physiology, and metabolic disorders (ط. 5. print.). Novartis Pharmaceutical Corp. ص. 187–189. ISBN:0-914168-88-6.
{{استشهاد بكتاب}}: تحقق من التاريخ في:|سنة=لا يطابق|تاريخ=(مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link)تحقق من التاريخ في:|year= / |date= mismatch - Boulpaep, Emile L.؛ Boron, Walter F. (2005). Medical physiology: a cellular and molecular approach. Saunders. ص. 1089–1091. ISBN:1-4160-2328-3. مؤرشف من الأصل في 2022-06-10.
- Mohan, S.؛ Baylink, D. J. (1991). "Bone growth factors". Clinical Orthopaedics and Related Research ع. 263: 30–48. DOI:10.1097/00003086-199102000-00004. PMID:1993386.
- Nordin، BE؛ Aaron, J؛ Speed, R؛ Crilly, RG (8 أغسطس 1981). "Bone formation and resorption as the determinants of trabecular bone volume in postmenopausal osteoporosis". Lancet. ج. 2 ع. 8241: 277–9. DOI:10.1016/S0140-6736(81)90526-2. PMID:6114324.
- Britton 2010، صفحات 1059–1062.
- Britton 2010، صفحات 1068.
- Salter RB، Harris WR (1963). "Injuries Involving the Epiphyseal Plate". J Bone Joint Surg Am. ج. 45 ع. 3: 587–622. DOI:10.2106/00004623-196345030-00019. مؤرشف من الأصل في 2 ديسمبر 2016. اطلع عليه بتاريخ أكتوبر 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - "Benign Bone Tumors". Cleveland Clinic. 2017. مؤرشف من الأصل في 2017-03-30. اطلع عليه بتاريخ 2017-03-29.
- Britton 2010.
- Britton 2010، صفحات 1116–1121.
- WHO (1994). "Assessment of fracture risk and its application to screening for postmenopausal osteoporosis. Report of a WHO Study Group". World Health Organization technical report series. ج. 843: 1–129. PMID:7941614.
- Britton، the editors Nicki R. Colledge, Brian R. Walker, Stuart H. Ralston ; illustrated by Robert (2010). Davidson's principles and practice of medicine (ط. 21st). Edinburgh: Churchill Livingstone/Elsevier. ص. 1116–1121. ISBN:978-0-7020-3085-7.
{{استشهاد بكتاب}}:|الأول=باسم عام (مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) صيانة الاستشهاد: التاريخ والسنة (link) - "2012 OSTEOPATHIC MEDICAL PROFESSION REPORT" (PDF). Osteopathic.org. American Osteopathic Organisation. مؤرشف من الأصل (PDF) في 2016-12-24. اطلع عليه بتاريخ 2014-11-26.
- Dumont، E. R. (17 مارس 2010). "Bone density and the lightweight skeletons of birds". Proceedings of the Royal Society B: Biological Sciences. ج. 277 ع. 1691: 2193–2198. DOI:10.1098/rspb.2010.0117. PMID:20236981.
- Hans J. Rolf؛ Alfred Enderle (1999). "Hard fallow deer antler: a living bone till antler casting?". The Anatomical Record. ج. 255 ع. 1: 69–77. DOI:10.1002/(SICI)1097-0185(19990501)255:1<69::AID-AR8>3.0.CO;2-R. PMID:10321994.
- "Dunkleosteus". American Museum of Natural History. مؤرشف من الأصل في 2018-08-13.
- cmnh.org نسخة محفوظة 2 يناير 2020 على موقع واي باك مشين.
- de Buffrénil V.؛ Mazin J.-M. (1990). "Bone histology of the ichthyosaurs: comparative data and functional interpretation". Paleobiology. ج. 16: 435–447. JSTOR:2400968.
- Laurin، M.؛ Canoville، A.؛ Germain، D. (2011). "Bone microanatomy and lifestyle: a descriptive approach". Comptes Rendus Palevol. ج. 10 ع. 5–6: 381–402. DOI:10.1016/j.crpv.2011.02.003.
- بوابة تشريح
- بوابة طب
- بوابة علم الأحياء

