بلوتونيوم
البلوتونيوم (بالإنجليزية: Plutonium)هو معدن ثقيل جداً وعالي الكثافة، أكثف من الرصاص بـ 1,74 مرة تقريباً، مشعٌّ وسام، وعددهُ الذري 94، اكتُشفَ في الولايات المتحدة عام 1940م كحال اليورانيوم 235 فهو عنصر قابل للانشطار، الذي تُستَخدم طاقته لصناعة القنابل النووية ويستخدم في إنتاج الطاقة في بعض المفاعلات النووية يُستخدم أيضاً في المختبرات.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المظهر | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
أبيض فضي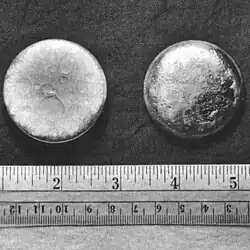 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص العامة | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الاسم، العدد، الرمز | بلوتونيوم، 94، Pu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| تصنيف العنصر | أكتينيدات | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | n/a, 7، f | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكتلة الذرية | (244) غ·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع إلكتروني | Rn]; 5f6 7s2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 8, 18, 32, 24, 8, 2 (صورة) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الفيزيائية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الطور | صلب | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | 19.816 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| كثافة السائل عند نقطة الانصهار | 16.63 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الانصهار | 912.5 ك، 639.4 °س، 1182.9 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الغليان | 3505 ك، 3228 °س، 5842 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة الانصهار | 2.82 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة التبخر | 333.5 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | 35.5 جول·مول−1·كلفن−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ضغط البخار | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الذرية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| أرقام الأكسدة | 7, 6, 5, 4, 3 (أكاسيده مذبذبة) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكهرسلبية | 1.28 (مقياس باولنغ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| طاقات التأين | الأول: 584.7 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر ذري | 159 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر تساهمي | 187±1 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| خواص أخرى | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| البنية البلورية | نظام بلوري أحادي الميل | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المغناطيسية | مغناطيسية مسايرة[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مقاومة كهربائية | 1.460 ميكروأوم·متر (0 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الناقلية الحرارية | 6.74 واط·متر−1·كلفن−1 (300 كلفن) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| التمدد الحراري | 46.7 ميكرومتر·متر−1·كلفن−1 (25 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سرعة الصوت | 2260 متر/ثانية | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل يونغ | 96 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل القص | 43 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نسبة بواسون | 0.21 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رقم CAS | 7440-07-5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر البلوتونيوم | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
أصله
البلوتونيوم عُنصُر كيميائي ينتج حصريّاً منذ 1940م إلى يومنا هذا، ينتج البلوتونيوم من قذف نظير الديتيريوم على كتلة من اليورانيوم في المفاعلات النووية، نتيجة لتحول أجزاء من اليورانيوم (بواسطة انبعاث النيوترونات) الذي يكون الوقود النووي، المفاعل النووي ينتج تقريبا 0.8 ذرة بلوتونيوم 239 لكل انشطار من اليورانيوم 235، أي 1 غرام من البلوتونيوم تقريباً يوميًا.
اكتشافه
أفاد إنريكو فيرمي وفريق من العلماء في جامعة روما سابينزا أنهم اكتشفوا العنصر 94 في عام 1934م.[3] وصف فيرمي العنصر بـ "hesperium" وذكره في محاضرة نوبل التي ألقاها في عام 1938.[4] كانت العينة في الواقع عبارة عن خليط من الباريوم والكريبتون وعناصر أخرى، ولكن لم يكن هذا معروفًا في ذلك الوقت.[5] تم اكتشاف الانشطار النووي في ألمانيا في عام 1938 على يد أوتو هان وفريتز ستراسمان. ثم تم تفسير آلية الانشطار نظريًا من قبل ليز مايتنر وأوتو روبرت فريش.[6]
كان غلين سيبورغ وفريقه في بيركلي أول من أنتج البلوتونيوم.
تم إنتاج البلوتونيوم (على وجه التحديد، بلوتونيوم 238) لأول مرة وعزله في 14 ديسمبر 1940، وتم تصنيفه كيميائيًا في 23 فبراير 1941، على يد غلين سيبورغ، وإدوين ماكميلان، وجوزيف كينيدي، وآرثر واهل عن طريق قذف اليوترون لليورانيوم في جهاز سيكلوترون 60 سم (150 سم) في مختبر لورنس بيركلي الوطني للإشعاع في جامعة كاليفورنيا، بيركلي.[7][8] في تجربة عام 1940، تم إنشاء النبتونيوم 238 مباشرة بواسطة القصف ولكن تم تحطيمها عن طريق انبعاث بيتا مع عمر نصف يزيد قليلًا عن يومين، مما يشير إلى تكوين العنصر 94.[9]
تم إعداد ورقة توثق الاكتشاف من قبل الفريق وأرسلت إلى مجلة Physical Review في مارس 1941، ولكن تأخر النشر حتى بعد عام من نهاية الحرب العالمية الثانية بسبب مخاوف أمنية.[10] في مختبر كافنديش في كامبريدج، أدرك إيغون بريتشير ونورمان فيذر أن المفاعل النيوتروني البطيء المزود باليورانيوم من شأنه نظريًا إنتاج كميات كبيرة من البلوتونيوم 239 كمنتج ثانوي، وحسبوا أن العنصر 94 سيكون قابلًا للانشطار، وله ميزة إضافية تتمثل في كونه يختلف كيميائيًا عن اليورانيوم، ويمكن فصله بسهولة عنه.[11]
وقد أطلق ماكميلان مؤخراً على أول عنصر من النبتونيوم في ما بعد اليورانيوم بعد الكوكب نبتون (Neptune)، واقترح تسمية العنصر 94، الذي يمثل العنصر التالي في السلسلة، لما اعتبره الكوكب التالي، بلوتو.[12][note 1] اقترح نيكولاس كيمر من فريق كامبريدج بشكل مستقل نفس الاسم، بناءً على نفس المنطق مثل فريق بيركلي. اعتبر سيبورغ في الأصل اسم «البلوتوم»، ولكن في وقت لاحق اعتقد أنه ليس جيدًا مثل «البلوتونيوم».[14] اختار الحروف «بو» على سبيل المزاح، في إشارة إلى "PU" للإشارة إلى وجود رائحة مثيرة للاشمئزاز، والتي مرت دون إشعار في الجدول الدوري.[14] كانت هناك أسماء بديلة نظر فيها سيبورغ وآخرون مثل "ultimium" أو «التطرف» بسبب الاعتقاد الخاطئ بأنهم عثروا على آخر عنصر كيميائي في الجدول الدوري.[15]
عُثر على أن التركيب الكيميائي للبلوتونيوم يشبه اليورانيوم بعد بضعة أشهر من الدراسة الأولية. واستمر البحث المبكر في مختبر الميتالورجيك السري التابع لجامعة شيكاغو. في 20 أغسطس 1942، تم عزل كمية ضئيلة من هذا العنصر وقياسها للمرة الأولى. تم إنتاج حوالي 50 ميكروغرام من البلوتونيوم 239 مع اليورانيوم ومنتجات الانشطار وتم عزل 1 ميكروغرام فقط.[16][17] مكن هذا الإجراء الكيميائيين من تحديد الوزن الذري للعنصر الجديد.[18][note 2] في 2 ديسمبر 1942، على ملعب مضرب تحت المدرج الغربي في جامعة ستيغ في شيكاغو، قام باحثون برئاسة إنريكو فيرمي بأول تفاعل متسلسل ذاتي الاستدامة في جرافيت وكد اليورانيوم المعروف باسم CP-1. باستخدام المعلومات النظرية التي تم الحصول عليها من تشغيل CP-1، قامت دوبونت ببناء مفاعل إنتاج تجريبي تبرد بالهواء، والمعروف باسم X-10، ومرفق فصل كيميائي رائد في أوك ريدج. قام مرفق الفصل، باستخدام الطرق التي طورها غلين سيبورغ وفريق من الباحثين في مختبر ميت Met Lab، بإزالة البلوتونيوم من اليورانيوم المشع في مفاعل X-10. كانت المعلومات الواردة من CP-1 مفيدة أيضًا لعلماء مختبر ميت Met Lab الذين صمموا مفاعلات إنتاج البلوتونيوم المبردة بالماء في هانفورد. بدأ البناء في الموقع في منتصف عام 1943.[19]
في نوفمبر 1943 تم اختزال بعض ثلاثي فلوريد البلوتونيوم لتُصنع أول عينة من معدن البلوتونيوم: بضع ميكروغرامات من الخرز المعدني. تم إنتاج ما يكفي من البلوتونيوم لجعله أول عنصر صناعي الصنع يمكن رؤيته بالعين المجردة.[20]
تمت دراسة الخصائص النووية للبلوتونيوم 239. وجد الباحثون أنه عندما يصاب نيوترون فإنه ينشطر عن طريق إطلاق المزيد من النيوترونات والطاقة. يمكن لهذه النيوترونات أن تضرب ذرات أخرى من البلوتونيوم 239 وما إلى ذلك في تفاعل متسلسل سريع بشكل سريع. هذا يمكن أن يؤدي إلى انفجار كبير بما يكفي لتدمير مدينة إذا تم تركيز ما يكفي من النظائر لتشكيل كتلة حرجة.
خلال المراحل المبكرة من البحث، تم استخدام الحيوانات لدراسة آثار المواد المشعة على الصحة. بدأت هذه الدراسات عام 1944 في مختبر كاليفورنيا للإشعاع في بيركلي، وأجراها جوزيف ج. هاملتون. كان هاميلتون يتطلع إلى الإجابة عن أسئلة حول كيفية اختلاف البلوتونيوم في الجسم تبعًا لنمط التعرض (الابتلاع عن طريق الفم، والاستنشاق، والامتصاص من خلال الجلد)، ومعدلات الاحتفاظ، وكيفية تثبيت البلوتونيوم في الأنسجة وتوزيعه بين الأعضاء المختلفة. بدأ هاملتون بإعطاء أجزاء ميكروجرام قابلة للذوبان من مركبات البلوتونيوم 239 إلى الجرذان باستخدام حالات تكافؤ مختلفة وطرق مختلفة لإدخال البلوتونيوم (عن طريق الفم، في الوريد، وما إلى ذلك). وفي نهاية المطاف، أجرى المختبر في شيكاغو تجارب حقن البلوتونيوم الخاصة به باستخدام حيوانات مختلفة مثل الفئران والأرانب والأسماك وحتى الكلاب. أظهرت نتائج الدراسات التي أجريت في بيركلي وشيكاغو أن السلوك الفيزيولوجي للبلوتونيوم اختلف بشكل كبير عن سلوك الراديوم. وكانت النتيجة الأكثر إثارة للقلق أن هناك ترسبًا كبيرًا للبلوتونيوم في الكبد وفي جزء «التمثيل الفعال» للعظام. وعلاوةً على ذلك، اختلف معدل إزالة البلوتونيوم في الفضلات بين أنواع الحيوانات بنسبة تصل إلى خمسة أضعاف. جعل مثل هذا التنوع من الصعب للغاية تقدير ما سيكون المعدل بالنسبة للبشر.[21]
التطبيقات
النظير بلوتونيوم 239 هو مفتاح عملية الانشطار في مكونات السلاح النووي، ذلك بسبب توافره وسهولة انشطاره، تغليف تجويف القنبلة في التصميم يؤدي إلى تقليل كمية البلوتونيوم المطلوبة للوصل إلى الكتلة الحرجة عبر عكس النيوترونات الهاربة إلى مركز البلوتونيوم، هذا يؤدي إلى تقليص الكمية من 16 كجم إلى 10 كجم، وبالتالي تصبح قياسات الكرة حوالي 10 سم، هذه الكتلة الحرجة هي حوالي ثلث كتلة اليورانيوم 235.
توضيح
البلوتونيوم معدن ثقيل جدّاً، وهش، وصلب في درجات الحرارة الاعتيادية ولهُ درجة ذوبان منخفضة نسبياً (640)°س. البلوتونيوم هو أحد الفضلات النووية في المفاعلات النووية المدنية لتوليد الطاقة الكهربائية
تكوين البلوتونيوم
يُكون البلوتونيوم 239 بثلاث خطوات هي:
- إكساب اليورانيوم 238 نيوترونات لتحويله إلى يورانيوم 239.
- تحول اليورانيوم 239(نصف العمر: 23 دقيقة) إلى نبتونيوم 239.
- تحول النبتونيوم 239 (نصف العمر: 2.3 يوم) إلى بلوتونيوم 239.
البلوتونيوم عنصر شديد الإشعاع ولكن النظائر 238 و241 هما الأكثر إشعاعاً ويسببان أمراضاً خطيرة، يتفاعل مع الماء والأوكسجين والأحماض ولكنه لا يتفاعل مع القواعد.
ملاحظات
- This was not the first time somebody suggested that an element be named "plutonium". A decade after barium was discovered, a Cambridge University professor suggested it be renamed to "plutonium" because the element was not (as suggested by the لغة يونانية root, barys, it was named for) heavy. He reasoned that, since it was produced by the relatively new technique of تحليل كهربائي, its name should refer to نار. Thus he suggested it be named for the Roman god of the underworld, بلوتو (ميثولوجيا).[13]
- Room 405 of the George Herbert Jones Laboratory, where the first isolation of plutonium took place, was named a معلم تاريخي وطني (الولايات المتحدة) in May 1967.
المراجع
- Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- BNL-NCS 51363, vol. II (1981), pages 835ff
- Holden، Norman E. (2001). "A Short History of Nuclear Data and Its Evaluation". 51st Meeting of the USDOE Cross Section Evaluation Working Group. Upton (NY): National Nuclear Data Center, Brookhaven National Laboratory. مؤرشف من الأصل في 2017-11-08. اطلع عليه بتاريخ 2009-01-03.
- Fermi، Enrico (12 ديسمبر 1938). "Artificial radioactivity produced by neutron bombardment: Nobel Lecture" (PDF). Royal Swedish Academy of Sciences. مؤرشف من الأصل (PDF) في 2004-07-22.
- Darden، Lindley (1998). "The Nature of Scientific Inquiry". College Park: Department of Philosophy, University of Maryland. مؤرشف من الأصل في 2012-08-17. اطلع عليه بتاريخ 2008-01-03.
- Bernstein 2007، صفحات 44–52.
- Seaborg, Glenn T. "An Early History of LBNL: Elements 93 and 94". Advanced Computing for Science Department, Lawrence Berkeley National Laboratory. مؤرشف من الأصل في 2014-11-05. اطلع عليه بتاريخ 2008-09-17.
- Glenn T. Seaborg. "The plutonium story". Lawrence Berkeley Laboratory, University of California. LBL-13492, DE82 004551. مؤرشف من الأصل في 2013-05-16.
- Emsley 2001، صفحات 324–329
- Seaborg & Seaborg 2001، صفحات 71–72.
- Clark 1961، صفحات 124–125.
- Heiserman 1992، صفحة 338
- Heiserman 1992، صفحة 338.
- Clark، David L.؛ Hobart, David E. (2000). "Reflections on the Legacy of a Legend: Glenn T. Seaborg, 1912–1999" (PDF). Los Alamos Science. ج. 26: 56–61, on 57. مؤرشف من الأصل (PDF) في 2016-06-03. اطلع عليه بتاريخ 2009-02-15.
- "Frontline interview with Seaborg". Frontline. Public Broadcasting Service. 1997. مؤرشف من الأصل في 2019-04-03. اطلع عليه بتاريخ 2008-12-07.
- Miner 1968، صفحة 541
- Glenn T. Seaborg (1977). "History of MET Lab Section C-I, April 1942 – April 1943". California Univ., Berkeley (USA). Lawrence Berkeley Lab. DOI:10.2172/7110621.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة) - "Room 405, George Herbert Jones Laboratory". National Park Service. مؤرشف من الأصل في 2008-02-08. اطلع عليه بتاريخ 2008-12-14.
- "Periodic Table of Elements". Los Alamos National Laboratory. مؤرشف من الأصل في 2019-02-12. اطلع عليه بتاريخ 2015-09-15.
- Miner 1968، صفحة 540
- "Plutonium". Atomic Heritage Foundation. مؤرشف من الأصل في 2019-05-06. اطلع عليه بتاريخ 2015-09-15.
اقرأ أيضًا
- متآصلات البلوتونيوم
- وحدة تسخين بالنظائر المشعة
- بطارية نظائر مشعة
- وقود نووي
- بلوتونيوم-239
- سداسي فلوريد البلوتونيوم
- بوابة الحرب العالمية الثانية
- بوابة العناصر الكيميائية
- بوابة الفيزياء
- بوابة الكيمياء
- بوابة تاريخ العلوم
- بوابة تقانة نووية
