استشراب سائل مع مطيافية الكتلة
الكروماتوغرافيا السائلة مع مطيافية الكتلة (LC-MS) هوأحد تقنيات الكيمياء التحليلية التي تجمع بين قدرات الفصل الفيزيائي بواسطة الاستشراب السائل (أو HPLC) مع قدرات مطيافية الكتلة(MS). إن دمج تقنيات الفصل الكروماتوجرافى مع مطيافية الكتلة أمر شائع في التحليل الكيميائي لأن ذلك يعزز القدرات الفردية لكل تقنية. في حين أن الفصل الكروماتوغرافي السائل يفصل المكونات المتعددة للمخاليط، يوفر مطياف الكتلة البُنى الكيميائية للجزيئات بدقة وحساسية عالية. تستغل مميزات هذا الدمج بين التقنيات في تحليل المركبات الكيميائية الحيوية والعضوية وغير العضوية الموجودة عادة في العينات المعقدة من الأصل البيئي والبيولوجي. لذلك، يستخدم LC-MS في مجموعة واسعة من القطاعات بما في ذلك التكنولوجيا الحيوية، الرصد البيئي، معالجة الأغذية وصناعة الدواء، الكيماويات الزراعية وصناعة مستحضرات التجميل.[1][2]
 | |
| اختصار | LCMS |
|---|---|
| تصنيف | كروماتوغرافيا مطيافية الكتلة |
| متحللات | مركبات عضوية جزيئات حيوية |
| مصنعون | Agilent Technologies Bruker ثيرمو فيشر العلمية شركة داناهر Shimadzu Corp. |
| Other techniques | |
| متعلقة | استشراب غازي-مطياف كتلة |
يحتوي نظام LC-MS على واجهة بينية تنقل المكونات المنفصلة بكفاءة من عمود جهاز الكروماتوغرافيا السائلة إلى مصدر الأيونات. [2][3] ووجود الواجهة أمر ضروري لأن أجهزة LC وMS نظرياً أنظمة غير متوافقة. في حين أن الطور المتحرك في نظام LC هو سائل مضغوط، تعمل أجهزة مطياف الكتلة عادة تحت ضغط عالٍ (حوالي -7 10/ -6 10 تور). وبالتالي، فإنه ليس من الممكن ضخ مباشرة المادة المدمصة والوسط الحامل من عمود الفصل الكروماتوغرافي إلى مصدر الأيونات بمطياف الكتلة، من الناحية الميكانيكية تعتبر الواجهة أبسط جزء في جهاز الفصل الكروماتوغرافي المزود بمقياس طيف الكتلة والتي يسمح لها تركيبها البسيط بنقل أكبر قدر ممكن من المادة المدمصة، والتخلص من جزء كبير من الطور المتحرك المستخدم في LC مع الحفاظ على الهوية الكيميائية للمادة المطلوب تحليلها (خاملة كيميائيًا). ومن أهم الشروط التي يجب توافرها في الواجهة ألا يتداخل عملهامع كفاءة التأين وظروف الفراغ لنظام مطيافية الكتلة [2] في الوقت الحاضر، تعتمد معظم واجهات LC-MS المطبقة على نطاق واسع على استراتيجيات تأين الضغط الجوي (API) مثل التأين بالترذيذ الإلكتروني (EI)، التأين الكيميائي تحت الضغط الجوي (APCI)، والتّايُّنُ الفوتونِيُّ تحت الضغط الجوي (APPI).أصبحت هذه الواجهات متوفرة في التسعينيات بعد عملية بحث وتطوير استمرت عقدين من الزمن.[4]
نبذة تاريخية
تُعد تقنية اقتران الفصل الكروماتوغرافي مع مطيافية الكتلة ستراتيجية تحليل كيميائي متطورة تعود إلى الخمسينيات من القرن الماضى. حيث تم الدمج بين كروماتوغرافيا الغاز (GC) -ومطيافية الكتلة MS في عام 1952، عندما كان AT James و AJP Martin يحاولان تطوير تقنيات تحليل الفصل الكُتلى بالترادف.[5]
تخرج مكونات العينة المطلوب تحليلها من خلال عمود الفصل في أجهزة الفصل الكروماتوجرافي الغازي في صورة غازية وبالتالى يكون الاتصال مع مصدر الأيونات المعتمد على التأين بالترذيذ الألكترونى (EI) أو التأين الكيميائي (CI) أمرا سهلاً من الناحية الفنية ولهذا السبب، كان تطوير أنظمة GC-MS أسرع من LC-MS حيث تم تسويق هذه الأنظمة لأول مرة في السبعينيات من القرن الماضي.[3] استغرق تطوير أنظمة LC-MS وقتًا أطول من GC-MS وارتبط هذا الأمر بشكل مباشر بتطوير واجهات (وصلات بَيْنِيّة) مناسبة. بدأ VL Tal'roze والمعاونون تطوير LC-MS في أوائل السبعينيات، عندما استخدموا الأوعية الشعرية لتوصيل أعمدة الفصل الكروماتوغرافي السائل ومصدر الأيونات في مقياس طيف الكتلة. [6][4]
قام مكلافيرتي ومعاونوه بالتحقيق في إستراتيجية مماثلة عام 1973. كانت هذه هي الطريقة الأولى والأكثر وضوحًا للربط بين LC و MS ، وكانت تعرف «واجهة المدخل الشعري». حققت هذه الواجهة الرائدة لجهاز LC-MS نفس الكفاءة التحليلية تقريبا التي يحققها جهاز GC-MS وكان يقتصر على تحليل المواد المتطايرة إلى حد ما والمركبات غير القطبية ذات الكتلة الجزيئية المنخفضة (أقل من 400 دالتون).
واجهة الحزام المتحرك
تم تطوير واجهة الحزام المتحرك (MBI) في عام 1977. وتتكون من حزام متحرك باستمرار يستقبل تدفق السائل من عمود الفصل. حيث يتم تبخير المذيب بالتسخين بلطف واستنفاد أبخرة المذيبات بكفاءة تحت ضغط منخفض في غرفتين مفرغتين. بعد إزالة الطور السائل، تُمتص المواد المطلوب تحليلها من الحزام وتنتقل إلى مصدر الأيونات في مطياف الكتلة. تم استخدام MBI بنجاح لتطبيقات LC-MS بين عامي 1978 و1990.
واجهة استقبال السوائل مباشرة
تم تطوير واجهة إدخال السائل مباشرة (DLI) في عام 1980. تم التفكير في هذه الواجهة كحل لتبخر السائل داخل واجهة المدخل الشعيري، حيث تم استخدام مرذاذ لتفكيك جزء من السائل المتدفق من العمود. تم استخدام حاجز صغير لتكوين نفاثة سائلة مكونة من قطرات صغيرة تم تجفيفها لاحقًا في غرفة مفرغة تحت ضغط.
واجهة الترذيذ الحرارى
تم تطوير واجهة الترذيذ الحراري (TPS) في عام 1983 من قبل مختبرات Vestal في جامعة هيوستن. نتجت الواجهة عن مشروع بحث طويل الأجل يهدف إلى إيجاد واجهة LC-MS قادرة على التعامل مع معدلات التدفق العالية (1 مل / دقيقة) وتجنب تقسيم التدفق في واجهات DLI.[2][3][7]
واجهات تعتمد على القصف الديناميكي للذرات السريعة
تم تطوير واجهتي فريت القصف الديناميكي للذرات السريعة وواجهة القصف الديناميكي للذرات السريعة ذات التدفق المستمر في عامي 1985 و1986 على التوالي.[7]
الإستشراب السائل
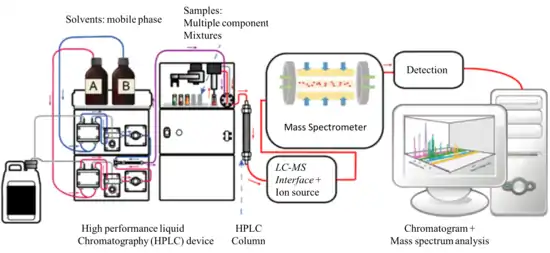
الكروماتوغرافيا السائلة هي الفصل المادي لمكونات السوائل حيث يتم فيها توزيع مكونات السائل بين طورين عَدِيمَى الاِمْتِزاجِ (طور ثابت وطور متحرك). يمكن تقسيم الكروماتوغرافيا السائلة إلى خمس فئات، الاستشراب انجذابي، استشراب التبادل الأيوني، استشراب استبعاد الحجم، استشراب الادمصاص، استشراب تقاسمي والنوع الأكثر شيوعاً هو وضع الطور العكسي (RP) لتقنية الاستشراب التقاسمي، حيث يتم استخدام طورًا ثابتًا غير قطبي (كاره للماء) وطور متحرك قطبي. في التطبيقات الشائعة، الطور المتحرك عبارة عن مزيج من الماء والمذيبات القطبية الأخرى (مثل الميثانول والإيزوبروبانول والأسيتونيتريل)، ويتم تحضير الطور الثابت عن طريق ربط مجموعات ألكيل طويلة السلسلة (على سبيل المثال، n-octadecyl أو C18) إلى سطح جزيئات السيليكا قطرها 5 ميكرون بشكل غير منتظم أو كروي. [2]
عادة يتم حقن 20 ميكرولتر من العينة في جهاز الـ HPLC تسري في تيار الطور المتحرك الذي تضخه مضخة الضغط العالي. يسرى الطور المتحرك حاملا جزيئات المادة المطلوب تحليلها في جزيئات الطور الثابت في اتجاه محدد. يتم فصل مكونات الخليط اعتمادًا على الألفة الكيميائية بينها وبين الطور الثابت والمتحرك يحدث الانفصال بعد تكرار الامتصاص والامتزاز الخطوات التي تحدث عندما يتفاعل السائل مع الطور الثابت. [4] يتم ضخ الطور المتحرك تحت ضغط عالٍ (يصل إلى 400 بار) في عمود معبأ يحتوي على الطور الثابت. ويستخدم الضغط العالي لتحقيق معدل تدفق ثابت لتجارب الكروماتوغرافيا القابلة للتكرار. اعتمادًا على التقاسم بين الطور الثابت والطور المتحرك، سوف تتدفق مكونات العينة من العمود في أوقات مختلفة.[7]
عمود الفصل هو العنصر الأكثر أهمية في نظام LC وهو مصمم لتحمل الضغط العالي للسوائل. يبلغ طول أعمدة LC التقليدية 100-300 مم ويبلغ قطرها الخارجي 6.4 ملم (1/4 بوصة) وقطرها الداخلي 3.0-4.6 مم. بالنسبة للتطبيقات التي تتضمن LC-MS، يمكن أن يكون طول أعمدة الكروماتوغرافيا السائلة أقصر (30-50 مم) وجزيئات التعبئة قطرها 3-5 ميكرون. بالإضافة إلى النموذج التقليدي، تمثل أعمدة LC الأخرى نماذج ضيقة التجويف narrow bore، ذات تجويف ميكرو، شعرية دقيقة، ونانو. تحتوي هذه الأعمدة على أقطار داخلية أصغر، وتسمح بفصل أكثر كفاءة، وتتعامل مع التدفقات السائلة التي تقل عن 1 مل / دقيقة (معدل التدفق التقليدي). [4] من أجل تحسين كفاءة الفصل، يمكن استخدام (UPLC) بدلاً من HPLC. والذي يستخدم أعمدة معبأة بجزيئات أصغر من السيليكا (قطرها حوالي 1.7 ميكرون) ويتطلب ضغوط تشغيل أعلى في حدود 310.000 إلى 775.000 تور. [2]
مطياف الكتلة
مقياس طيف الكتلة (MS) هو تقنية تحليلية تقيس نسبة الكتلة إلى الشحنة (ك /ش) للجسيمات المشحونة (الأيونات). على الرغم من وجود عدة أنواع من مطيافية الكتلة، فجميعها يستخدم المجالات الكهربائية أو المغناطيسية لمعالجة حركة الأيونات الناتجة من المادة المستهدفة بالتحليل وتحديد m/z لها.[8] المكونات الأساسية لمقياس طيف الكتلة هي:
- مصدر الأيونات، حيث تتأين جزيئات العينة الداخلة إلى جهاز مطياف الكتلة بواسطة الأشعة المهبطية، أشعة الفوتون (الأشعة فوق البنفسجية)، حزم أشعة الليزر، التفريغ الهالي.
- محلل الكتلة.
- كاشف.
- أنظمة البيانات.
- نظام التفريغ تحت ضغط.
في حالة التأين بالإرذاذ الإلكتروني، يقوم مصدر الأيونات بتحويل الأيونات الموجودة في العينات السائلة إلى الحالة الغازية. حيث يقوم مصدر الأيونات بشطر وتحويل الجزيئات المتعادلة الموجودة في العينة إلى أيونات غازية الطور يتم إرسالها إلى محلل الكتلة. بينما يطبق محلل الكتلة الحقول الكهربائية والمغناطيسية لفرز الأيونات حسب كتلها، يقوم المكشاف بقياس وتضخيم التيار الأيوني لحساب وفرة كل أيون. من أجل توليد طيف كتلي يمكن مشاهدته بالعين المجردة، وتقوم النظم الالكترونية بتسجيل البيانات ومعالجتها وعرضها على أجهزة الكمبيوتر. [2] يُستخدم الطيف الكتلي لتحديد كتلة المادة المطلوب تحليلها، نظائره وتركيبه العنصرى، أو توضيح التركيب الكيميائي للعينة. [2] قياس الطيف الكتلي هو تجربة يجب أن تتم في الحالة الغازية وفي حيز مفرغ تحت ضغط (1.33 * 10-2 إلى 1.33 * 10-6 باسكال). لذلك، فإن تطوير الأجهزة التي تُسهل نقل العينات من مرحلة الضغط العالي والحالة المكثفة (الصلبة أو السائلة) إلى نظام الفراغ تحت الضغط أمراً ضرورياً لتطوير مقياس طيف الكتلة كأداة فعالة لتحديد وتقدير المركبات العضوية والببتيدات.[9]
يُستخدم مقياس طيف الكتلة حالياً في المختبرات التحليلية التي تدرس الخصائص الفيزيائية أو الكيميائية أو البيولوجية لمجموعة كبيرة ومتنوعة من المركبات. من بين العديد من الأنواع المختلفة من أجهزة تحليل الكتلة، نظمة التحليل الكتلي رباعية الاستقطاب ومطياف الكتلة المختلط، المصيدة الأيونية، مطياف زمن الطيران.[3]
الواجهات (وصلات بَيْنِيّة)
شَكل تطوير واجهة مناسبة تصل بين جهاز الاستشراب السائل (HPLC) والذي يتميز بالتدفق المستمر للمحاليل السّائلة التي تنشأ عن عملية الاستخراج، وتقنية مطياف الكتلة الذي يتميز بوجود فراغ تحت ضغط تحدياً عظيما أمام تطوير أجهزة LCMS. أحدث ظهور تأين بالترذيذ الإلكتروني طفرة في تطوير LCMS . حاليًا، أكثر واجهات LC-MS شيوعًا هي تأين بالترذيذ الإلكتروني (ESI) والتأين الكيميائي تحت الضغط الجوي (APCI) والتأين الفوتوني تحت الضغط الجوي[10][3]
تأين بالترذيذ الإلكتروني ESI
{رئيسي|تأين بالترذيذ الإلكتروني}} تم تطوير واجهة ESI لأنظمة LC-MS بواسطة جون فين ومعاونيه في عام 1988. [11] يمكن استخدام هذا النوع (مصدر الأيونات/ الواجهة الأيونية) في تحليل الجزيئات متعادلة القُطْبِيّة على سبيل المثال (الأيضات، والغرائب الحيوية، والببتيدات). يتم ضخ السائل الخارج من عمود LC من خلال أوعية شعيرية معدنية تحت قوة محركة كهربائية ثابتة من 3 إلى 5 كيلو فولت.
التأين الكيميائي تحت الضغط الجوي (APCI)
بدأ تطوير واجهة APCI بواسطة هورننج ومعاونيه في أوائل عام 1973. [12] ومع ذلك، تم تقديم تطبيقه التجاري في بداية التسعينيات بعد أن قام هنيون ومعاونوه بتحسين واجهة LC-APCI-MS في عام 1986 .[4] يمكن استخدام مصدر الأيونات / واجهة APCI في تحليل الجزيئات صغيرة والمحايدة وغير قطبية والمستقرة حرارياً (مثل الستيرويدات والليبيدات والفيتامينات القابلة للذوبان في الدهون). هذه المركبات ليست مؤينة بشكل جيد وبالتالى لا يمكن استخدام ESI
التّايُّنُ الفوتونِيُّ تحت الضغط الجوي (APPI)
تم تطوير واجهة APPI بشكل آني بواسطة برنس وسياج في عام 2000 [13][4] يستخدم في تحليل المركبات المحايدة التي لا يمكن أن تتأين باستخدام ESI. [3] تشبه واجهة التأين الكيميائي تحت الضغط الجوي (APCI)، ولكن يحدث التأين باستخدام فوتونات تولد بواسطة مصباح تفريغ شحنات.
التطبيقات
أحدث اقتران مطيافية الكتلة مع أنظمة الكروماتوغرافيا السائلة طفرة هائلة لأن الفصل الكروماتوغرافي السائل يمكن أن يفصل المخاليط الطبيعية البسيطة وكذلك المعقدة، والتي يجب التعرف على تركيبها الكيميائي بدقة عالية (مثل السوائل البيولوجية والعينات البيئية والعقاقير). علاوة على ذلك، يمكن استخدام LC-MS في تحليل البقايا المتطايرة للمتفجرات.[14] يُعد HPLC-MS تقنية رائدة في تحليل البروتيوميات وفي المختبرات الصيدلانية.[3][2] والعديد من التطبيقات المهمة الأخرى مثل تحليل الغذاء، والمبيدات الأفات والفينولات النباتية.[4]
الحَرائِكُ الدَّوائِيَّةُ
يستخدم الجهاز على نطاق واسع في مجال الاختبارات البيولوجية وتشارك بشكل خاص في الحركية الدوائية في الدراسات الصيدلانية حيث هناك حاجة ملحة لدراسات الحركية الدوائية لتحديد مدى سرعة تخلص أعضاء الجسم والدورة الدموية الكبدية من الدواء. تعد مطيافية الكتلة من التقنيات المفيدة في هذه الدراسات بسبب دقتها وسرعتها مقارنة بكاشفات الأشعة فوق البنفسجية المرتبطة عادةً بأنظمة HPLC. ومن المميزات الرئيسية هي استخدامها جنبا إلى جنب MS-MS، حيث يمكن برمجة الكاشف لتحديد أيونات معينة لتكسيرها إلى أيونات أصغر. الكمية المقاسة هي مجموع شظايا الجزيء التي يختارها مستخدم الجهاز. طالما لا توجد تداخلات أو قمع ايوني، يكون الفصل LC سريع جدا.[15]
بروتيوميات/ميتابولوميات
يستخدم LC-MS في البروتيوميات كوسيلة لاكتشاف وتحديد مكونات خليط معقد. نهج دراسة البروتيوم تصاعدياً بواسطة LC-MS يتطلب هضم إنزيم البروتييز ودنترته باستخدام التربسين كنوع من البروتييز، واليوريا لتشويه بنية البروتين الثالثية، ويودو أسيتاميد لتعديل بقايا السيستين. بعد الهضم، يستخدم جهاز الـ LC-MSللكشف عن البصمة الوراثية للبتيد أو يستخدم جهاز الـ LC-MS / MS (الترادفي) لاشتقاق تسلسل الببتيدات الفردية. [16]
يستخدم LC-MS/MS في تحليل البروتينات في العينات معقدة التركيب حيث يمكن أن تتداخل كتل الببتيد حتى مع استخدام أجهزة قياس الطيف الكتلي عالية الدقة. يمكن تحليل عينات البيولوجية المعقدة مثل مصل الدم البشري باستخدام أنظمة LC-MS/MS الحديثة، والتي يمكن أن تحدد أكثر من 1000 بروتين. ومع ذلك، لا يمكن تحقيق هذا المستوى العالي من تحديد البروتين إلا بعد فصل العينة عن طريق هلام SDS-PAGE أو HPLC-SCX. [15] برز LC-MS كواحد من أكثر التقنيات شيوعًا في التوصيف الكُلّيّ لمستقلب الأنسجة البيولوجية (مثل بلازما الدم والمصل والبول). [17]
كان أول تطبيق لـ LC-MS في التمثيل الغذائي النباتي هو اكتشاف مجموعة واسعة من المستقلبات شديدة الاستقطاب، سكريات قليلة التعدد، أحماض أمينية، السكريات الأمينية ونيوكليوتيدات السكر من أنسجة لحاء قرع الماكسيما. [18] ومن الأمثلة الأخرى الفصل الفعال للجلوكوز، السكروز، والرافينوز، والستاكيوزو الفيرباكوز من مستخلص أوراق نبات رشاد أذن الفأر [19]
تطوير العقاقير
يستخدم LC-MS على نطاق واسع في مجال تطوير الأدوية والعقاقير لأنه يقوم بتأكيد الوزن الجزيئي وتحديد التركيب الكيميائي بسرعة ودقة. هذه الميزات تسرع عملية تخليق واختبار والثبت من كفاءة الاكتشاف بدءا من تخليق مجموعة واسعة من المنتجات حتى التثبت من التطبيقات المحتملة. تطبيقات LC-MS لتطوير الأدوية هي طرق مؤتمتة للغاية تستخدم لرسم خرائط الببتيد، بروتين سكري، وتنقية المنتجات الطبيعية، فحص التنوع البيولوجي، فحص العقاقير في الجسم الحي، وفحص الاستقرار الأيضي، وتحديد المستقلب، وتحديد الشوائب، كميا وكيفيا وكذلك مراقبة جودة الأدوية.[20]
انظر أيضاً
مصادر
- Chaimbault, Patrick (1 Jan 2014). "The Modern Art of Identification of Natural Substances in Whole Plants". In Jacob, Claus; Kirsch, Gilbert; Slusarenko, Alan; Winyard, Paul G.; Burkholz, Torsten (eds.). Recent Advances in Redox Active Plant and Microbial Products (بالإنجليزية). Springer Netherlands. pp. 31–94. DOI:10.1007/978-94-017-8953-0_3. ISBN:9789401789523.
- Dass, Chhabil (1 Jan 2007). "Hyphenated Separation Techniques". Fundamentals of Contemporary Mass Spectrometry (بالإنجليزية). John Wiley & Sons, Inc. pp. 151–194. DOI:10.1002/9780470118498.ch5. ISBN:9780470118498.
- Pitt، James J (12 مارس 2017). "Principles and Applications of Liquid Chromatography-Mass Spectrometry in Clinical Biochemistry". The Clinicast Reviews. ج. 30 ع. 1: 19–34. ISSN:0159-8090. PMC:2643089. PMID:19224008.
- Niessen، Wilfried M. A (2006). Liquid Chromatography-Mass Spectrometry, Third Edition. Boca Raton: CRC Taylor & Francis. ص. 50–90. ISBN:9780824740825. OCLC:232370223.
- James, A. T.; Martin, A. J. P. (1 Mar 1952). "Gas-liquid partition chromatography: the separation and micro-estimation of volatile fatty acids from formic acid to dodecanoic acid". Biochemical Journal (بالإنجليزية). 50 (5): 679–690. DOI:10.1042/bj0500679. ISSN:0264-6021. PMC:1197726. PMID:14934673.
- Tal'roze، V.L.؛ Gorodetskii، I.G.؛ Zolotoy، N.B؛ Karpov، G.V.؛ Skurat، V.E.؛ Maslennikova، V.Ya. (1978). "Capillary system for continuous introducing of volatile liquids into analytical MS and its application". Adv. Mass Spectrom. ج. 7: 858.
- Ardrey, Robert E. (1 Jan 2003). "Introduction". Liquid Chromatography – Mass Spectrometry: An Introduction. Analytical Techniques in the Sciences (AnTS) (بالإنجليزية). John Wiley & Sons, Ltd. pp. 1–5. DOI:10.1002/0470867299.ch1. ISBN:9780470867297.
- Roberts, Gordon (2013). Encyclopedia of Biophysics - Springer (بالإنجليزية). DOI:10.1007/978-3-642-16712-6. ISBN:978-3-642-16711-9.
- Sharp, Thomas R. (1 Jan 2009). "Mass Spectrometry". In Nassar, Ala F.; Collegiateessor, Paul F. Hollenberg; VP, JoAnn Scatina (eds.). Drug Metabolism Handbook (بالإنجليزية). John Wiley & Sons, Inc. pp. 167–227. DOI:10.1002/9780470439265.ch8. ISBN:9780470439265.
- Arpino، Patrick (1992). "Combined liquid chromatography mass spectrometry. Part III. Applications of thermospray". Mass Spectrometry Reviews. ج. 11 ع. 1: 3–40. Bibcode:1992MSRv...11....3A. DOI:10.1002/mas.1280110103.
- Fenn, J. B.; Mann, M.; Meng, C. K.; Wong, S. F.; Whitehouse, C. M. (6 Oct 1989). "Electrospray ionization for mass spectrometry of large biomolecules". Science (بالإنجليزية). 246 (4926): 64–71. Bibcode:1989Sci...246...64F. CiteSeerX:10.1.1.522.9458. DOI:10.1126/science.2675315. ISSN:0036-8075. PMID:2675315.
- Horning، E. C.؛ Horning، M. G.؛ Carroll، D. I.؛ Dzidic، I.؛ Stillwell، R. N. (1 مايو 1973). "New picogram detection system based on a mass spectrometer with an external ionization source at atmospheric pressure". Analytical Chemistry. ج. 45 ع. 6: 936–943. DOI:10.1021/ac60328a035. ISSN:0003-2700.
- Robb، null؛ Covey، null؛ Bruins، null (1 أغسطس 2000). "Atmospheric pressure photoionization: an ionization method for liquid chromatography-mass spectrometry". Analytical Chemistry. ج. 72 ع. 15: 3653–3659. DOI:10.1021/ac0001636. ISSN:1520-6882. PMID:10952556.
- Widmer، Leo؛ Watson، Stuart؛ Schlatter، Konrad؛ Crowson، Andrew (2002). "Development of an LC/MS method for the trace analysis of triacetone triperoxide (TATP)". The Analyst. ج. 127 ع. 12: 1627–1632. DOI:10.1039/b208350g. ISSN:0003-2654. مؤرشف من الأصل في 2019-12-09.
- Sudhakar, P.; Latha, P.; Reddy, P. V. (5 Apr 2016). Phenotyping Crop Plants for Physiological and Biochemical Traits (بالإنجليزية). Academic Press. ISBN:9780128041109. Archived from the original on 2020-01-25.
- Wysocki VH, Resing KA, Zhang Q, Cheng G؛ Resing؛ Zhang؛ Cheng (2005). "Mass spectrometry of peptides and proteins". Methods. ج. 35 ع. 3: 211–22. DOI:10.1016/j.ymeth.2004.08.013. PMID:15722218.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - Gika، Helen G.؛ Theodoridis، Georgios A.؛ Plumb، Robert S.؛ Wilson، Ian D. (يناير 2014). "Current practice of liquid chromatography–mass spectrometry in metabolomics and metabonomics". Journal of Pharmaceutical and Biomedical Analysis. ج. 87: 12–25. DOI:10.1016/j.jpba.2013.06.032. ISSN:0731-7085. PMID:23916607.
- Tolstikov, Vladimir V.; Fiehn, Oliver (2002). "Analysis of Highly Polar Compounds of Plant Origin: Combination of Hydrophilic Interaction Chromatography and Electrospray Ion Trap Mass Spectrometry". Analytical Biochemistry (بالإنجليزية). 301 (2): 298–307. DOI:10.1006/abio.2001.5513. PMID:11814300.
- Antonio، Carla؛ Larson، Tony؛ Gilday، Alison؛ Graham، Ian؛ Bergström، Ed؛ Thomas-Oates، Jane (2008). "Hydrophilic interaction chromatography/electrospray mass spectrometry analysis of carbohydrate-related metabolites fromArabidopsis thaliana leaf tissue". Rapid Communications in Mass Spectrometry. ج. 22 ع. 9: 1399–1407. DOI:10.1002/rcm.3519. PMID:18384194.
- Lee، Mike S.؛ Kerns، Edward H. (1999). "LC/MS applications in drug development". Mass Spectrometry Reviews. ج. 18 ع. 3–4: 187–279. Bibcode:1999MSRv...18..187L. DOI:10.1002/(SICI)1098-2787(1999)18:3/4<187::AID-MAS2>3.0.CO;2-K. PMID:10568041.
- بوابة الكيمياء
- بوابة الكيمياء الحيوية
- بوابة علم الأحياء الخلوي والجزيئي