إفراز
الإفراز[1][2] هو حركة المواد من نقطة إلى أخرى، مثل إفراز مادة كيماوية من الخلية أو الغدة. بالمقابل، إن الإخراج، هو إزالة مواد أو فضلات محددة من خلية أو عضو. إن الآلية التقليدية لإفراز الخلية هو عبر بوابات إفرازية في الغشاء الخلوي البلازمي المسماة الأجسام المسامية [الإنجليزية] .[2][3] إن الأجسام المسامية هي بنى جزيئية ضخمة دائمة، شحمية بروتينية، تأخذ شكل الكأس موجودة في الغشاء الخلوي للخلايا حقيقية النوى حيث إن الحويصلات الإفرازية ترسو عليها بشكل مؤقت عبر عملية التحام الحويصلات [الإنجليزية] والإفراز. تتم عملية الالتحام العابر لغشاء الحويصل الإفرازي عند قاعدة الجسيم الإفرازي بتواسط بروتينات سنار [الإنجليزية]، مما يؤدي إلى تشكل مسام الالتحام أو الاستمرارية من أجل تحرير المحتويات الموجودة داخل الحويصل والمطلوب إفرازها من الخلية. بعد أن تكتمل عملية الإفراز، فإن مسام الالتحام المتشكل بشكل مؤقت في قاعدة جسيم الإفراز يغلق. إن الجسيمات المسامية تكون متناهية في الصغر من حيث الحجم حيث تقيس بضعة نانومترات وتحتوي على أنماط مختلفة ومتعددة من البروتينات، خاصة أقنية الكالسيوم والكلور، الأكتين وبروتينات سنار التي تتواسط في عملية رسو والتحام الحويصلات مع غشاء الخلية. حالما تنتهي الحويصلات من عملية الرسو باستخدام بروتينات سنار فإنها تنتفخ، مما يزيد من الضغط الداخلي فيها. تلتحم الحويصلات عندئذ بشكل عابر مع قاعدة الجسيم المسامي، وتضغط المحتويات الموجودة ضمنها وتقذفها خارج الخلية. إن فحص الخلايا بعد عملية الإفراز باستخدام المجهر الإلكتروني، يوضح وجود متزايد للحويصلات الفارغة بشكل جزئي بعد عملية الإفراز. إن هذا يقترح بإنه خلال عملية الإفراز، فقط جزء من المحتويات الحويصلية يكون من الممكن إخراجها من الخلية.
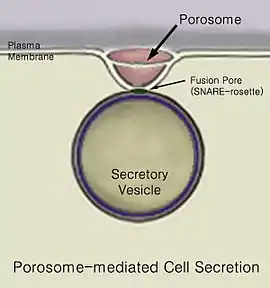
إن الإفراز في أنواع الجراثيم يعني عبور أو تبدل موضع الجزيئات المستجيبة للمنبهات على سبيل المثال: البروتينات، الأنزيمات أو الذيفانات (مثل ذيفان الكوليرا في الجراثيم الممرضة على سبيل المثال ضمات الكوليرا من داخل (السيتوبلازم أو العصارة الخلوية) للخلية الجرثومية إلى خارجها. إن الإفراز هو عملية في غاية الأهمية من أجل الوظيفة الجرثومية والعملية الجرثومية في بيئتها المحيطة من أجل التأقلم والنجاة.
في الخلايا حقيقة النوى
الآلية
تمتلك الخلايا حقيقة النوى، بما فيها الخلايا البشرية ، عملية إفراز متطورة للغاية. يتم تصنيع البروتينات المستهدف ارسالها للخارج بواسطة الريبوسومات الملتصقة بالشبكة الإندوبلازمية الخشنة. حالما يتم تصنيع هذه البروتينات يتم نقلها إلى داخل لمعة الشبكة البلازمية الداخلية الخشنة، حيث تتم عملية اقترانها بالسكريات glycosylated ( عملية الاقتران بالسكريات تعني التعديل الإضافي والارتباط التساهمي لبقايا الكربوهيدرات مع جزيء الركيزة) ومن ثم تساعد بروتينات الشابرون chaperones في عملية تطوي البروتين protein folding (عملية تطوي البروتين هي تحويل جزئي البروتين من الشكل الخطي ثنائي الأبعاد إلى البنية ثلاثي الأبعاد لجزيئ البروتين). إن البروتينات المطواة بشكل خاطئ يتم تحديدها عادة هنا ويتم نقلها بواسطة الشبكة البلازمية الداخلية الخشنة إلى السائل الخلوي، حيث يتم تدركها وتحطيمها بواسطة الأجسام الحالة proteasome (إن الأجسام الحالة هي معقدات بروتينية داخل خلوية تقوم بوظيفة تحلل وتدرك البروتينات غير الضرورية والتالفة ضمن الخلية). إن الحويصلات vesicles التي تحتوي على البروتينات المطواة بشكل مناسب وصحيح تدخل عندئذ جهاز كولجي Golgi apparatus. في جهاز كولجي، يتم تعديل ارتباط السكريات على البروتينات ويمكن أن تحدث تعديلات إضافية أخرى على البروتين أبعد من شكله بعد مرحلة الترجمة posttranslational modifications، بما في ذلك تقسيمه cleavage وتحويله إلى بروتين وظيفي. عندئذ يتم نقل البروتينات proteins إلى داخل الحويصلات الإفرازية التي تسير على طول الهيكل الخلوي cytoskeleton إلى حافة الخلية. إن تعديلات إضافية يمكن أن تحدث في الحويصل الإفرازي (على سبيل المثال إن تقسيم طليعة الأنسولين proinsulin للحصول على الأنسولين insulin يتم داخل الحويصل الإفرازي).
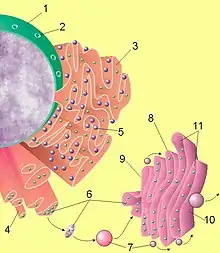
في النهاية، يحدث اندماج الحويصل vesicle fusion حيث يتم إندماج الحويصل الإفرازي مع الغشاء الخلوي بمستوى البنية الخلوية المسماة الجسيم المسامي، وذلك من خلال عملية تسمى الإفراز الخارجي exocytosis، حيث تفرغ الحويصلات الإفرازية محتوياتها خارج بيئة الخلية.[4]
إن عملية ضبط كيميائية حيوية biochemical صارمة للغاية تحكم هذه السلسلة المتعاقبة من الأحداث الخاصة بالنقل والإفراز وذلك باستخدام ممال درجة الحموضة pH gradient: حيث إن درجة حموضة السائل الخلوي هي 7.4، درجة حموضة الشبكة البلازمية الداخلية الخشنة هي 7.0، درجة الحموضة داخل جهاز كولجي هي 6.5. درجة الحموضة داخل الحويصلات الإفرازية تتراوح بين 6.0 و 5.0؛ بعض الحويصلات الإفرازية تتطور لتشكل الأجسام الحالة lysosomes، والتي تمتلك درجة حموضة 4.8.
الإفراز غير التقليدي
هناك العديد من البروتينات مثل البروتين FGF1 والمعروف بـ aFGF ، البروتين FGF2 والمعروف بـ bFGF، الانترلوكين 1 (IL1) الخ والتي لا تمتلك تسلسل الإشارة. إن هذه البروتينات لا تستعمل الطريق التقليدي المتمثل بالشبكة البلازمية الداخلية الخشنة - جهاز كولجي ER-Golgi pathway.
على الأقل هناك أربع طرق غير تقليدية موصوفة لنقل البروتينات.[5] تتضمن هذه الطرق:
1. النقل المباشر للبروتينات عبر الغشاء البلازمي ومن المحتمل أن هذا الأمر يتم من خلال نواقل الغشاء.
2. النقل بطريقة تشكل الدمعات blebbing، وذلك بتشكيل انتفاخ في الغشاء البلازمي للخلية يشبه الدمعة.
3. إفراز الجسيمات الحالة lysosomal secretion
4. التحرر عبر الأجسام الخارجية المشتقة من أجسام حويصلية متعددة. بالإضافة لذلك، يمكن أن تتحرر البروتينات من الخلايا من خلال الجروح الميكانيكية والفيزيولوجية [6] ومن خلال المسام السرطانية العابرة غير القاتلة في الغشاء البلازمي المحدثة بواسطة غسل الخلايا باستخدام الوسائط أو السوائل الدرائة الخالية المصل.[7]
في النسج البشرية
إن العديد من أنماط الخلايا البشرية تمتلك القدرة على أن تكون خلايا إفرازية. إنها تمتلك جهاز شبكي بلازمي داخلي وجهاز كولجي متطوران ليلبيا متطلبات هذه الوظيفة. إن الأنسجة التي تنتج مفرزات تتضمن السبيل المعدي المعوي والذي يفرز الأنزيمات الهاضمة والحمض المعدي ، الرئتيان واللتان تفرزان السورفكتانت surfactants وهي مادة خافضة للتوتر السطحي مما تسمح للأسناخ الرئوية بالبقاء منفتحة وتمنع انخماصها، والغدد الزهمية sebaceous glands التي تفرز الزهم sebum لتزيت الجلد والشعر. كذلك تفرز غدد ميبوميان Meibomian glands الموجودة في العين مادة الميبوم meibum التي تعمل على تزيت وحماية العين.
في الجراثيم سلبية الغرام بكتيريا سلبية الغرام
في الجراثيم سلبية الغرام نجد ستة أنماط لأنظمة الإفراز، بالإضافة إلى وجود طريقة مختلفة عن الأنظمة الستة السابقة متمثلة بتكوين حويصلات الغشاء الجرثومي الخارجي وتحريرها.
| نظام الإفراز | الاسم المختصر | الآلية | |
|---|---|---|---|
| 1 | نظام الإفراز من النمط الأول | T1SS | Hly ,Tol |
| 2 | نظام الإفراز من النمط الثاني | T2SS | Sec , Tat |
| 3 | نظام الإفراز من النمط الثالث | T3SS | Hrp , lcrV |
| 4 | نظام الإفراز من النمط الرابع | T4SS | icm , dot |
| 5 | نظام الإفراز من النمط الخامس | T5SS | Sec |
| 6 | نظام الإفراز من النمط السادس | T6SS | Hcp , VrgG |
| 7 | طريقة مختلفة عن الأنظمة الستة السابقة تمتلكها الجراثيم سلبية الغرام
هي تكوين حويصلات الغشاء الجرثومي الخارجي وتحريرها نحو الوسط الخارجي |
outer membrane vesicles | تكوين حويصلات الغشاء الجرثومي الخارجي |
إن الإفراز ليس عملية فريدة ومقتصرة على الخلايا حقيقية النواة eukaryotes - إنها أيضا عملية موجودة لدى العتائق archaea (العتائق مفردها عتيقة وهي مجموعة من العضيات بدائية النواة prokaryotes وحيدm الخلية والتي تفتقر إلى وجود نواة حقيقية وتمتلك بدلا من ذلك طليعة نواة) بالإضافة إلى الجراثيم (وهي الشكل الآخر لبدائيات النوى prokaryotes الأكثر تطورا من العتائق archaea). تعتبر النواقل من نوع النمط ABC ذات الشريطة الرابطة للأدينوزين ثلاثي الفوسفات ATP (المصطلح الإنكليزي ATP binding cassette) شائعة في قطاعات الحياة الثلاثة (الخلايا حقيقة النوى والجراثيم والعتائق). إن بعض البروتينات المفرزة والمنقولة عبر الغشاء البلازمي الخلوي بواسطة الناقل الإفرازي المسمى Sec translocon، وهو واحد من إثنين من أنظمة النقل، والتي تتطلب وجود ببتيد إشارة انتهائي في النهاية الأميدية N على البروتين المفرز. إن بقية البروتينات تنقل عبر الغشاء البلازمي الخلوي عبر طريق النقل ذو الأرجنين التوأم twin-arginine translocation pathway Tat. إن الجراثيم سلبية الغرام Gram-negative bacteria تمتلك غشائين إثنين، وبالتالي تجعل عملية النقل طوبوغرافيا أصعب. يوجد على الأقل ستة أنظمة نقل لدى الجراثيم سلبية الغرام. إن العديد من البروتينات المفرزة تكون هامة بشكل خاص في إحداث الإمراضية الجرثومية.[8]
نظام الإفراز من النمط الأول
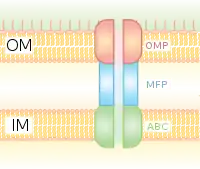
إن الإفراز من النمط 1 هو نظام إفراز يعتمد على المرافق chaperone باستخدام مجموعات المورثات Hly وTol. تبدأ العملية عندما يتم التعرف على التسلسل الرئيسي للبروتين المراد إفرازه بواسطة HlyA وربط HlyB على الغشاء. إن تسلسل الإشارة هذا محدد للغاية بالنسبة للناقل ABC. يقوم المعقد HlyAB بتحفيز HlyD الذي يبدأ بفك اللفائف ويصل إلى الغشاء الخارجي حيث يقوم TolC بتمييز الجزيئ أو الإشارة النهائية على HlyD. يقوم HlyD بتجنيد TolC إلى الغشاء الداخلي ويتم إطراح HlyA خارج الغشاء الخارجي عن طريق قناة بروتين طويلة النفق long-tunnel protein channel. إن نظام الإفراز من النمط I ينقل جزيئات متنوعة، من الشوارد، الأدوية، إلى البروتينات المتنوعة الحجم (20 -900 كيلو دالتون). تختلف الجزيئات التي تم إفرازها في الحجم من ببتيد الكوليسين الخامس colicin V الخاص بجرثومة الإيشريشيا كولي Escherichia coli والذي يبلغ وزنه 10 كيلو دالتون، إلى بروتين الالتصاق الخلوي LapِِA الخاص بجرثومة الزوائف الفلورسينية Pseudomonas fluorescens التي يصل وزنها إلى 520 كيلو دالتون.[9] أفضل ما يميز نظام الإفراز من النمط الأول هو سموم ر.ت.إكس RTX toxins والليباز lipases. إن نظام الإفراز من النمط الأول يشارك أيضًا في تصدير ركائز غير بروتينية مثل البيتا غلوكانات الحلقية cyclic β-glucans والسكريات المتعددة polysaccharides.
نظام الإفراز من النمط الثاني
إن البروتينات المفرزة من خلال نظام الإفراز من النمط الثاني، أو الفرع الطرفي الرئيسي للطريق الإفرازي العام، تعتمد على نظام Sec أو Tat من أجل النقل البدئي إلى داخل البلازما المحيطية periplasm (إن البلازما المحيطية تعريفا هي المطرق المركز الشبيه بالجل concentrated gel-like matrix في المسافة ما بين الغشاء البلازمي الخلوي الداخلي والغشاء الخارجي لدى الجراثيم سلبية الغرام).
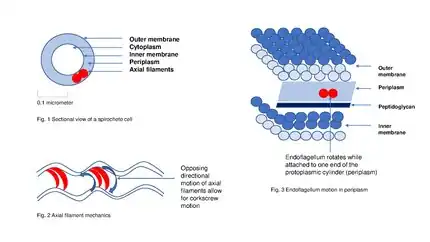
بمجرد وصول البروتينات المقرر إفرازها إلى البلازما المحيطية periplasm، فإنها تمر من خلال الغشاء الخارجي عبر معقد مسام متعدد الأقطاب multimeric complex of pore (مؤلف من 12-14 وحدة فرعية subunits) مكون من بروتينات السيكريتين secretin. بالإضافة إلى بروتين السيكريتن ، فإن 10-15 بروتينا من البروتينات الغشائية الداخلية والخارجية الأخرى يتشاركون جميعا في تشكيل جهاز الإفراز الكامل full secretion apparatus، والعديد من هذه البروتينات لا تزال مجهولة الوظيفة. إن النمط الرابع من جهاز الوخز الحركي Type IV Pilus Twitching Motility لدى سلبيات الغرام يستخدم نسخة معدلة من نظام الإفراز من النمط الثاني Type II secretion system من أجل تشكلها الحيوي biogenesis، وفي بعض الحالات يتم مشاركة بعض البروتينات بين معقد الوخز الحركي pilus complex ونظام الإفراز من النمط الثاني Type II secretion system ضمن الأنواع الجرثومية الواحدة single bacterial species.
نظام الإفراز من النمط الثالث
إن نظام الإفراز من النمط الثالث متماثل مع الجسم القاعدي في الأسواط البكتيرية. إنه يشبه حقنة جزيئية التي يمكن من خلالها للجرثوم (مثل أنواع معينة من السالمونيلا Salmonella، والشيغيلا Shigella، واليرسينيا Yersinia، والضمات Vibrio) حقن البروتينات في الخلايا حقيقية النواة eukaryotic cells. إن تركيز شوارد الكالسيوم Ca2+ المنخفض في السائل الخلوي يفتح البوابة التي تنظم نظام الإفراز من النمط الثالث T3SS. إن أحد الآليات التي تقوم بتحري انخفاض تركيز الكالسيوم قد تم توضيحها بواسطة المستضد lcrV (الاستجابة للكالسيوم المنخفض) lcrV (Low Calcium Response) antigen المستخدمة من قبل اليَرْسَنِيَّةٌ الطَاعُونِيَّة Yersinia pestis والتي تستخدم للكشف عن تركيزات الكالسيوم المنخفضة وتحرض على الارتباط بنظام الإفراز من النمط الثالث T3SS.
يقوم نظام Hrp لدى العوامل الممرضة للنبات بحقن الهاربينات harpins والبروتينات المسببة للمرض من خلال آلية مشابهة داخل النباتات. (ملاحظة: الهاربينات harpins هي بروتينات مستقرة ضمن الظروف الحرارية وهي غنية بالغلايسين وهي تفرز من قبل نظام الإفراز من النمط الثالث T3SS في الجراثيم سلبية الغرام المسببة للأمراض في النباتات). تم اكتشاف نظام الإفراز هذا لأول مرة في اليَرْسَنِيَّةٌ الطَاعُونِيَّة Yersinia pestis وأظهر أنه من الممكن حقن السموم toxins مباشرة من السائل البلازمي الجرثومي في السائل البلازمي لخلايا مضيفها بدلاً من مجرد إن يتم إفراز هذه السموم ببساطة ضمن الوسط خارج الخلية الجرثومية extracellular medium.[10]
نظام الإفراز من النمط الرابع
إن نظام الإفراز من النمط الرابع مماثل لآلية اقتران conjugation machinery الجراثيم. إن هذا النظام قادر على نقل كلا من الحمض الريبي النووي منقوص الأكسجين DNA والبروتينات proteins. لقد تم اكتشاف هذا النظام في جرثومة الأَجْرَعِيَّةُ المورِمَة Agrobacterium tumefaciens ، والتي تستخدم هذا النظام لإدخال الجزء T-DNA من البلازميد Ti plasmid إلى النبات المضيف، والذي بدوره يتسبب في تطور المنطقة المصابة إلى مرارة تاجية crown gall (ورم tumor). (ملاحظة: إن المرارة التاجية crown gall هي مرض يصيب النبات والذي يحدث بسبب الجراثيم التي تعيش في التربة والمسماة الأَجْرَعِيَّةُ المورِمَة Agrobacterium tumefaciens. إن هذا الجرثوم يسبب نموا غير طبيعي أو ما يعرف بالمرارات galls (النتوءات) على الجذور roots، الأغصان twigs والفروع branches في شجيرات الإيونيموس euonymus shrubs (وهي شجيرات دائمة الخضرة موزعة على نطاق واسع أو أشجار صغيرة أو كروم) أو الشجيرات الأخرى بشكل أساسي في عائلة الورد rose family. إن هذه الجراثيم تحرض على النمو السريع لخلايا النبات مما يسبب تشكل المرارات galls.
إن جراثيم المتلوية البوابية Helicobacter pylori تستخدم نظام الإفراز من النمط الرابع لنقل CagA إلى داخل الخلايا الظهارية المعدية gastric epithelial cells، والتي تترافق مع التسرطن المعدي gastric carcinogenesis.[11]
تفرز جرثومة البورديتيلا الشاهوقية Bordetella pertussis، وهي العامل الممرض المسبب للسعال الديكي whooping cough، سموم السعال الديكي pertussis toxin بشكل جزئي من خلال نظام الإفراز من النمط الرابع T4SS.

إن الفَيْلَقِيَّةٌ الأَلِيفَةُ للرِئَة Legionella pneumophila (وهي العامل المسبب لمرض الفيلقة legionellosis المعروف بداء الفيالق Legionnaires' disease) تمتلك نظام الإفراز من النمط الرابع B (بالإنكليزية: type IVB secretion system)، والذي يعرف بنظام icm/dot (أي نظام التضاعف داخل الخلوي/ الخلل في مورثات تهريب العضيات، حيث أن المصطلح باللغة الإنكليزية يأخذ الحرف الأول من كل كلمة: intracellular multiplication / defect in organelle trafficking genes system ). إن الفَيْلَقِيَّةٌ الأَلِيفَةُ للرِئَة Legionella pneumophila تستخدم نظام icm/dot لنقل البروتينات الضخمة المستجيبة للمنبهات numerous effector proteins إلى داخل الخلية حقيقية النواة المضيفة للجرثوم.[12]

إن النموذج الأولي prototype لنظام الإفراز من النمط الرابع A (المصطلح بالإنكليزية: Type IVA secretion system) هو المعقد VirB الخاص بالأَجْرَعِيَّةُ المورِمَة Agrobacterium tumefaciens.[13]

إن أعضاء البروتين في هذه العائلة هم مكونات نظام الإفراز من النمط الرابع. إن هذه البروتينات تتواسط عملية النقل داخل الخلوي intracellular للجزيئات الكبيرة macromolecules عبر آلية مرتبطة سلفًا بتلك الآليات الخاصة بالاقتران الجرثومي bacterial conjugation.[14][15]
الوظيفة
باختصار، إن نظام الإفراز من النمط الرابع (T4SS) ، هو الآلية العامة التي تفرز بها الخلايا الجرثومية الجزيئات الكبيرة أو تقبطها. آليتها الدقيقة لا تزال غير معروفة. يتم ترميز نظام الإفراز من النمط الرابع على عناصر الاقتران سلبية الغرام Gram-negative conjugative elements في الجراثيم bacteria . إن نظام الإفراز من النمط الرابع هو عبارة عن معقدات ممتدة لتغلف الخلية cell envelope-spanning complexes أو بعبارة أخرى مجموعة بروتينات أساسية يتراوح عددها بين 11-13 تشكل قناة والتي يمكن من خلالها انتقال الحمض الريبي النووي منقوص الأكسجين DNA والبروتينات من البلازما الخلوية التابعة للخلية المانحة إلى البلازما الخلوية التابعة للخلية المتلقية.
بالإضافة إلى ذلك ، يفرز نظام الإفراز من النمط الرابع (T4SS) أيضًا بروتينات عامل الفوعة virulence factor proteins مباشرة داخل الخلايا المضيفة بالإضافة إلى قبط الحمض الريبي النووي منقوص الأكسجين DNA من الوسط medium أثناء التحول الطبيعي natural transformation، مما يدل على براعة جهاز إفراز الجزيئات الكبيرة هذا.[16]
البنية
في نظام الإفراز من النمط الرابع يتكون TraC، على وجه الخصوص من حزمة حلزونية ثلاثية وزائدة كروي فضفاضة.[15]
التفاعلات
إن نظام الإفراز من النمط الرابع يحتوي على نوعين إثنين من البروتينات المستجيبة للمنبهات:
الأول: ATS-1، والذي يرمز إلى الركيزة -1 المنقولة بجراثيم الأنابلازما (بالإنكليزية: Anaplasma translocated substrate 1 ).ثانيا: AnkA،والذي يرمز إلى البروتين A الحاوي على نطاق تكرار الأنكيرين (بالإنكليزية: ankyrin repeat domain-containing protein A).
بالإضافة إلى ذلك ، فإن بروتينات اقتران نظام الإفراز من النمط الرابع هي VirD4، التي تقوم بالارتباط بـ VirE2.[17]
ملاحظة: إن الأنابلاسما Anaplasma هي جنس genus جرثومي bacteria من جراثيم بروتوس ألفا alpha proteobacterial (تم تسميتها هكذا نسبة إلى إله البحر اليوناني بروتيوس Proteus القادر على اتخاذ العديد من الأشكال المختلفة (وليس نسبة إلى جرثوم البروتيوس Proteus)، وذلك نظرًا للتنوع الكبير في الأشكال الموجودة في هذه المجموعة) من رتبة الريكيتيسيات order Rickettsiales، عائلة الأنابلاسماتاسيا family Anaplasmataceae.
إن الريكتسيا Rickettsia هي كائنات دقيقة طفيلية وتعتبر بين البكتيريا والفيروس.
نظام الإفراز من النمط الخامس
إن نظام الإفراز من النمط الخامس يسمى أيضًا نظام الناقل الآلي autotransporter system،[18] ويتضمن نظام الإفراز من النمط الخامس استخدام نظام Sec لعبور الغشاء الداخلي. تتمتع البروتينات التي تستخدم هذا الطريق بالقدرة على تكوين برميل بيتا beta-barrel مع طرفه سي C-terminus الذي يدخل في الغشاء الخارجي، مما يسمح لبقية الببتيد (القطاع المسافر the passenger domain) بالوصول إلى خارج الخلية. في كثير من الأحيان، يتم قطع الناقلات الآلية autotransporters مما يترك قطاع البرميل بيتا beta-barrel domain معلقا في الغشاء الخارجي ومحررا القطاع المسافر the passenger domain. يعتقد بعض الباحثين أن بقايا الناقلات الآلية أدت إلى ظهور البورينات porins التي تشكل هياكل بيتا برميلية مماثلة.
إن البورين porin هو أي صنف من البروتينات التي يمكن لجزيئاتها أن تشكل أقنية channels (هذه الأقنية تكون كبيرة بما يكفي لتسمح بمرور الشوارد الصغيرة والجزيئات) عبر الأغشية الخلوية. من الأمثلة الشائعة على الناقل الآلي الذي يستخدم نظام الإفراز من النمط الخامس هو الناقل الآلي الثلاثي الخاص بنقل مواد الالتصاق Trimeric Autotransporter Adhesins.[19]
ملاحظة: إن المواد اللاصقة Adhesins هي مكونات أو زوائد من سطح الخلية الجرثومية والتي تسهل الالتصاق أو الالتحام مع الخلايا الأخرى أو الأسطح الأخرى، والتي عادة ما تكون في المضيف الذي تصيبه هذه الجراثيم بالإنتان أو تعيش ضمنه. إن المواد اللاصقة Adhesins هي أحد أنماط عامل ضراوة الجرثوم virulence factor.
نظام الإفراز من النمط السادس
تم تحديد نظام الإفراز من النمط السادس أصلا في عام 2006 من قبل مجموعة جون ميكالانوس John Mekalanos في كلية الطب بجامعة هارفارد Harvard Medical School (بوسطن Boston، الولايات المتحدة الأمريكية USA) في اثنين من العوامل الممرضة الجرثومية، ضمات الكوليرا Vibrio cholerae و الزوائف الزنجارية Pseudomonas aeruginosa.[20][21]
تم تحديد هذا النظام الإفرازي من النمط السادس عندما أدت الطفرات في جينات Hcp و VrgG في ضمات الكوليرا Vibrio cholerae إلى انخفاض الضراوة virulence والقدرة على إحداث المرض pathogenicity.
منذ ذلك الحين، تم العثور على نظام الإفراز من النمط السادس في 25% من جميع مورثات جراثيم بروتوس proteobacterial genomes، بما في ذلك العوامل الممرضة pathogens الحيوانية والنباتية والبشرية ، بالإضافة إلى جراثيم التربة، البيئة أو البحر.[22][23]

في حين أن معظم الدراسات المبكرة المجراة حول نظام الإفراز من النمط السادس قد ركزت على دوره في إحداث الإمراضية pathogenesis لدى الكائنات الحية العليا higher organisms، فإن الدراسات الحديثة المجراة مؤخرا اقترحت دورًا فيزيولوجيًا أوسع في الدفاع ضد الخلايا المفترسة حقيقية النواة البسيطة simple eukaryotic predators ودورها في التفاعلات بين الجراثيم inter-bacteria interactions.[24][25]
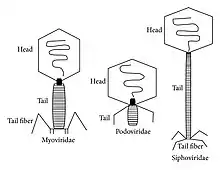
إن مجموعات مورثات نظام الإفراز من النمط السادس تحتوي على مورثات يتراوح عددها من 15 إلى أكثر من 20 مورثة، اثنتان من هذه المورثات هما Hcp و VgrG، قد ثبت أنها ركائز لهذا النظام substrates of the system مُفرزة دوما تقريبًا بدون استثناء. إن التحليل البنيوي Structural analysis لهذه البروتينات وغيرها من البروتينات الموجودة في نظام الإفراز من النمط السادس تحمل تشابهًا صارخًا مع شوكة ذيل الفَيْرُوسٌ المفترس للجراثيم T4 (المصطلح الإنكليزي: tail spike of the T4 phage)، ويُعتقد أن نشاط هذا النظام الإفرازي من النمط السادس يشابه وظيفيا إصابة الجراثيم بالفَيْرُوسٌ الجرثومي phage.[26]
تحرر حويصلات الغشاء الخارجي
بالإضافة إلى استخدام المعقدات متعددة البروتينات multiprotein complexes المذكورة أعلاه ، تمتلك الجراثيم سلبية الغرام Gram-negative bacteria طريقة أخرى لإطلاق المادة خارج الخلية وهي: تكوين حويصلات الغشاء الجرثومي الخارجي bacterial outer membrane vesicles.[27]
يتم اقتطاع أجزاء من الغشاء الخارجي للجرثوم، وتشكيل هياكل كروية من حجم نانو مؤلفة من طبقة ثنائية من الدهون الغنية بعديد السكاريد وهذه الهياكل الكروية تحتوي في داخلها على مواد البلازما المحيطية periplasmic materials (إن البلازما المحيطية periplasma هي البلازما الموجودة أساسا بين الغشاء الداخلي والغشاء الخارجي للجرثوم) وتسمى هذه الهياكل الكروية بحويصلات الغشاء الخارجي outer membrane vesicles حيث يتم نقل المحتويات المصنعة داخل الخلية حقيقة النواة من مواضع التصنيع والتخزين إلى حويصلات الغشاء الخارجي outer membrane vesicles ليتم بعد ذلك نشرها وتفريغ محتوياتها خارج الجرثوم حيث تعرف هذه العملية بتهريب الحويصلات الغشائية membrane vesicle trafficking والتي تسمح للجرثوم بالتلاعب بالبيئة المحيطة به أو أن يغزو مضيفا من خلال واجهة المضيف - العامل الممرض host-pathogen interface.
_Host-pathogen_Interface.png.webp)
لقد وُجد أن حويصلات الغشاء الخارجي outer membrane vesicles التابعة لعدد من الأنواع البكتيرية تحتوي على عوامل ضراوة virulence factors، وبعضها له تأثيرات معدلة مناعية ، وبعضها يمكن أن تلتصق مباشرة بالخلايا المضيفة وتسممها. تم إثبات إطلاق الحويصلات كاستجابة عامة لظروف الشدة stress conditions، ويبدو أن عملية تحميل بضائع البروتينات process of loading cargo proteins انتقائية.[28]
الإفراز لدى الجراثيم إيجابية الغرام
لدى بعض أنواع المكورات العنقودية Staphylococcus والمكورات العقدية Streptococcus، يتعامل النظام الإفرازي الإضافي مع تصدير البروتينات السكرية المخصصة للالتصاق المتكرر repetitive adhesion glycoproteins.
المراجع
- مصطفى الشهابي (2003). أحمد شفيق الخطيب (المحرر). معجم الشهابي في مصطلحات العلوم الزراعية (بالعربية والإنجليزية واللاتينية) (ط. 5). بيروت: مكتبة لبنان ناشرون. ص. 648. ISBN:978-9953-10-550-5. OCLC:1158683669. QID:Q115858366.
- المعجم الموحد لمصطلحات علم الأحياء، قائمة إصدارات سلسلة المعاجم الموحدة (8) (بالعربية والإنجليزية والفرنسية)، تونس العاصمة: مكتب تنسيق التعريب، 1993، ص. 308، OCLC:929544775، QID:Q114972534
- Lee، Jin-Sook؛ Jeremic، Aleksandar؛ Shin، Leah؛ Cho، Won Jin؛ Chen، Xuequn؛ Jena، Bhanu P. (2012). "Neuronal porosome proteome: Molecular dynamics and architecture". Journal of Proteomics. ج. 75 ع. 13: 3952–62. DOI:10.1016/j.jprot.2012.05.017. PMID:22659300.
- Anderson LL (2006). "Discovery of the 'porosome'; the universal secretory machinery in cells". Journal of Cellular and Molecular Medicine. ج. 10 ع. 1: 126–31. DOI:10.1111/j.1582-4934.2006.tb00294.x. PMC:3933105. PMID:16563225.
- Nickel W، Seedorf M (2008). "Unconventional mechanisms of protein transport to the cell surface of eukaryotic cells". Annual Review of Cell and Developmental Biology. ج. 24: 287–308. DOI:10.1146/annurev.cellbio.24.110707.175320. PMID:18590485.
- McNeil PL، Steinhardt RA (2003). "Plasma membrane disruption: repair, prevention, adaptation". Annual Review of Cell and Developmental Biology. ج. 19: 697–731. DOI:10.1146/annurev.cellbio.19.111301.140101. PMID:14570587.
- Chirico WJ (أكتوبر 2011). "Protein release through nonlethal oncotic pores as an alternative nonclassical secretory pathway". BMC Cell Biology. ج. 12: 46. DOI:10.1186/1471-2121-12-46. PMC:3217904. PMID:22008609.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - Wooldridge، K، المحرر (2009). Bacterial Secreted Proteins: Secretory Mechanisms and Role in Pathogenesis. Caister Academic Press. ISBN:978-1-904455-42-4.[بحاجة لرقم الصفحة]
- Boyd CD، Smith TJ، El-Kirat-Chatel S، Newell PD، Dufrêne YF، O'Toole GA (أغسطس 2014). "Structural features of the Pseudomonas fluorescens biofilm adhesin LapA required for LapG-dependent cleavage, biofilm formation, and cell surface localization". Journal of Bacteriology. ج. 196 ع. 15: 2775–88. DOI:10.1128/JB.01629-14. PMC:4135675. PMID:24837291.
- Salyers, A. A. & Whitt, D. D. (2002). Bacterial Pathogenesis: A Molecular Approach, 2nd ed., Washington, D.C.: ASM Press. (ردمك 1-55581-171-X)[بحاجة لرقم الصفحة]
- Hatakeyama M، Higashi H (ديسمبر 2005). "Helicobacter pylori CagA: a new paradigm for bacterial carcinogenesis". Cancer Science. ج. 96 ع. 12: 835–43. DOI:10.1111/j.1349-7006.2005.00130.x. PMID:16367902. S2CID:5721063.
- Cascales E، Christie PJ (نوفمبر 2003). "The versatile bacterial type IV secretion systems". Nature Reviews. Microbiology. ج. 1 ع. 2: 137–49. DOI:10.1038/nrmicro753. PMC:3873781. PMID:15035043.
- Christie PJ، Atmakuri K، Krishnamoorthy V، Jakubowski S، Cascales E (2005). "Biogenesis, architecture, and function of bacterial type IV secretion systems". Annual Review of Microbiology. ج. 59: 451–85. DOI:10.1146/annurev.micro.58.030603.123630. PMC:3872966. PMID:16153176.
- Christie PJ (نوفمبر 2004). "Type IV secretion: the Agrobacterium VirB/D4 and related conjugation systems". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. ج. 1694 ع. 1–3: 219–34. DOI:10.1016/j.bbamcr.2004.02.013. PMC:4845649. PMID:15546668.
- Yeo HJ، Yuan Q، Beck MR، Baron C، Waksman G (ديسمبر 2003). "Structural and functional characterization of the VirB5 protein from the type IV secretion system encoded by the conjugative plasmid pKM101". Proceedings of the National Academy of Sciences of the United States of America. ج. 100 ع. 26: 15947–52. Bibcode:2003PNAS..10015947Y. DOI:10.1073/pnas.2535211100. JSTOR:3149111. PMC:307673. PMID:14673074.
- Lawley TD، Klimke WA، Gubbins MJ، Frost LS (يوليو 2003). "F factor conjugation is a true type IV secretion system". FEMS Microbiology Letters. ج. 224 ع. 1: 1–15. DOI:10.1016/S0378-1097(03)00430-0. PMID:12855161.
- Rikihisa Y، Lin M، Niu H (سبتمبر 2010). "Type IV secretion in the obligatory intracellular bacterium Anaplasma phagocytophilum". Cellular Microbiology. ج. 12 ع. 9: 1213–21. DOI:10.1111/j.1462-5822.2010.01500.x. PMC:3598623. PMID:20670295.
- Thanassi DG، Stathopoulos C، Karkal A، Li H (2005). "Protein secretion in the absence of ATP: the autotransporter, two-partner secretion and chaperone/usher pathways of gram-negative bacteria (review)". Molecular Membrane Biology. ج. 22 ع. 1–2: 63–72. DOI:10.1080/09687860500063290. PMID:16092525. S2CID:2708575.
- Gerlach RG، Hensel M (أكتوبر 2007). "Protein secretion systems and adhesins: the molecular armory of Gram-negative pathogens". International Journal of Medical Microbiology. ج. 297 ع. 6: 401–15. DOI:10.1016/j.ijmm.2007.03.017. PMID:17482513.
- Pukatzki S، Ma AT، Sturtevant D، Krastins B، Sarracino D، Nelson WC، Heidelberg JF، Mekalanos JJ (يناير 2006). "Identification of a conserved bacterial protein secretion system in Vibrio cholerae using the Dictyostelium host model system". Proceedings of the National Academy of Sciences of the United States of America. ج. 103 ع. 5: 1528–33. Bibcode:2006PNAS..103.1528P. DOI:10.1073/pnas.0510322103. JSTOR:30048406. PMC:1345711. PMID:16432199.
- Mougous JD، Cuff ME، Raunser S، Shen A، Zhou M، Gifford CA، Goodman AL، Joachimiak G، Ordoñez CL، Lory S، Walz T، Joachimiak A، Mekalanos JJ (يونيو 2006). "A virulence locus of Pseudomonas aeruginosa encodes a protein secretion apparatus". Science. ج. 312 ع. 5779: 1526–30. Bibcode:2006Sci...312.1526M. DOI:10.1126/science.1128393. PMC:2800167. PMID:16763151.
- Bingle LE، Bailey CM، Pallen MJ (فبراير 2008). "Type VI secretion: a beginner's guide" (PDF). Current Opinion in Microbiology. ج. 11 ع. 1: 3–8. DOI:10.1016/j.mib.2008.01.006. PMID:18289922. مؤرشف من الأصل (PDF) في 2020-03-29.
- Cascales E (أغسطس 2008). "The type VI secretion toolkit". EMBO Reports. ج. 9 ع. 8: 735–41. DOI:10.1038/embor.2008.131. PMC:2515208. PMID:18617888.
- Schwarz S، Hood RD، Mougous JD (ديسمبر 2010). "What is type VI secretion doing in all those bugs?". Trends in Microbiology. ج. 18 ع. 12: 531–7. DOI:10.1016/j.tim.2010.09.001. PMC:2991376. PMID:20961764.
- Coulthurst SJ (2013). "The Type VI secretion system - a widespread and versatile cell targeting system". Research in Microbiology. ج. 164 ع. 6: 640–54. DOI:10.1016/j.resmic.2013.03.017. PMID:23542428.
- Silverman JM، Brunet YR، Cascales E، Mougous JD (2012). "Structure and regulation of the type VI secretion system". Annual Review of Microbiology. ج. 66: 453–72. DOI:10.1146/annurev-micro-121809-151619. PMC:3595004. PMID:22746332.
- Kuehn MJ، Kesty NC (نوفمبر 2005). "Bacterial outer membrane vesicles and the host-pathogen interaction". Genes & Development. ج. 19 ع. 22: 2645–55. DOI:10.1101/gad.1299905. PMID:16291643.
- McBroom AJ، Kuehn MJ (يناير 2007). "Release of outer membrane vesicles by Gram-negative bacteria is a novel envelope stress response". Molecular Microbiology. ج. 63 ع. 2: 545–58. DOI:10.1111/j.1365-2958.2006.05522.x. PMC:1868505. PMID:17163978.
- بوابة الكيمياء
- بوابة طب
- بوابة علم الأحياء
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة علم وظائف الأعضاء