ارتباط إلكتروني
الارتباط الإلكتروني (بالإنجليزية : Electronic correlation) هو التفاعل بين الإلكترونات في البنية الإلكترونية لنظام الكم .[1] إن طاقة الارتباط هي مقياس لمدى تأثر حركة إلكترون واحد بوجود كل الإلكترونات الأخرى.
النظم الذرية والجزيئية
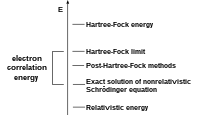
ضمن طريقة Hartree – Fock للكيمياء الكم، تقارب الدالة الموجية غير المتماثلة بواسطة محدد سلايدر مفرد. ومع ذلك، لا يمكن التعبير عن وظائف الموجات الدقيقة بشكل عام كمحددات فردية. لا يأخذ تقدير التقريب الأحادي بعين الاعتبار ارتباط كولومب، مما يؤدي إلى طاقة إلكترونية كلية مختلفة عن الحل الدقيق لمعادلة شرودنجر غير النسبية داخل تقريب بورن-أوبنهايمر. لذلك، يكون حد Hartree – Fock دائماً فوق هذه الطاقة الدقيقة. يدعى الفرق طاقة الارتباط، وهو مصطلح ابتكره Löwdin تمت دراسة مفهوم طاقة الارتباط في وقت سابق من قبل Wigner. يتم بالفعل اعتبار كمية معينة من ارتباط الإلكترون ضمن تقريب HF ، الموجود في مصطلح تبادل الإلكترون الذي يصف الارتباط بين الإلكترونات مع الدوران المتوازي. هذه العلاقة الأساسية تمنع إلكترونين متوازيين الدوران من العثور على نفس النقطة في الفضاء وغالبا ما يطلق عليهما ارتباط فيرمي. من ناحية أخرى، يصف ارتباط كولومب العلاقة بين الموقع المكاني للإلكترونات بسبب نفورها الكولوني، وهو مسؤول عن التأثيرات الكيميائية المهمة مثل تشتت لندن. هناك أيضًا علاقة مرتبطة بالتناظر الكلي أو السبين الكلي للنظام المدروس.
يجب استخدام كلمة طاقة الارتباط بحذر. أولاً، عادة ما يتم تعريفه على أنه فرق الطاقة لطريقة مرتبطة بالطاقة. لكن هذه ليست طاقة الارتباط الكاملة لأن بعض الارتباط موجود بالفعل في HF. وثانيا، تعتمد طاقة الارتباط بشكل كبير على أساس المجموعة المستخدمة. الطاقة «الدقيقة» هي الطاقة ذات الارتباط الكامل ومجموعة الأساس الكاملة.
ينقسم الارتباط الإلكتروني أحيانًا إلى علاقة ديناميكية وغير ديناميكية (ثابتة). الارتباط الديناميكي هو الارتباط بين حركة الإلكترونات ويوصف في ديناميكيات ارتباط الإلكترون وكذلك بطريقة تفاعل التهيئة (CI). إن الارتباط الثابت مهم بالنسبة للجزيئات حيث يتم وصف الحالة الأرضية بشكل جيد فقط بأكثر من واحد (محدد تقريبا). في هذه الحالة فإن الدالة الموجه Hartree – Fock (محدد واحد فقط) خاطئة نوعياً. تأخذ طريقة الحقل (MCSCF) المتسقة ذات التهيئة الذاتية المتعددة في الحسبان هذه العلاقة الثابتة، ولكن ليس الارتباط الديناميكي.
إذا أراد المرء حساب طاقات الإثارة (اختلافات الطاقة بين الأرض والحالات المثارة) يجب على المرء توخي الحذر من أن كلتا الحالتين متوازنة بالتساوي (على سبيل المثال، تفاعل تكوين ). بعبارات بسيطة، يتم تحسين المدارات الجزيئية لطريقة Hartree – Fock من خلال تقييم طاقة إلكترون في كل مدار مداري جزيئي يتحرك في الحقل المتوسط لجميع الإلكترونات الأخرى، بدلاً من تضمين التنافر الفوري بين الإلكترونات. لحساب ترابط الإلكترون هناك العديد من أساليب ما بعد Hartree – Fock ، بما في ذلك: تفاعل التكوين (CI) واحدة من أهم الطرق لتصحيح الارتباط المفقود هي طريقة تفاعل التهيئة (CI). بدءا من الدالة الموجية كمحدد أرضي، يأخذ المرء توليفة خطية من الأرض والمحددات المحفزة كوظيفة الموجة المترابطة ويحسن عوامل الوزن {وفقًا لـ مبدأ التباين. عند اتخاذ جميع المحددات مثير متحمس واحد يتحدث عن كامل CI. في وظيفة الموجة الكاملة CI ترتبط كل الإلكترونات بشكل كامل. بالنسبة للجزيئات غير الصغيرة، فإن نظام CI الكامل يكون مكلفًا جدًا من الناحية الحسابية. واحد يقطع توسيع CI ويحصل على موجات دالة بشكل جيد وطاقات مترابطة بشكل جيد وفقا لمستوى الاقتطاع.
تعطي نظرية التشويش الطاقات المترابطة، لكن لا توجد أي موجات جديدة. PT ليست متغيرة. هذا يعني أن الطاقة المحسوبة ليست الحد الأعلى للطاقة بالضبط. من الممكن تقسيم طرائق نظرية Møller – Plesset عن طريق تقاطع الطاقة ذرة تفاعلية (IQA) (على الرغم من أنه في الغالب لا يتم تقسيم طاقة الارتباط). هذا امتداد لنظرية الذرات في الجزيئات. يتيح تقسم الطاقة IQA واحد للنظر بالتفصيل في مساهمات الطاقة الارتباط من الذرات الفردية والتفاعلات الذرية. لقد ثبت أيضًا أن تقسيم طاقة ارتباط IQA ممكن مع طرق عنقودية مقترنة.
هناك أيضا مجموعات ممكن. مثلا يمكن للمرء أن يكون لديه بعض المحددات التي تتحلل تقريبًا لطريقة الحقل المتسقة ذات التهيئة المتعددة لحساب العلاقة الثابتة أو بعض طريقة CI المقتطعة للجزء الأكبر من الارتباط الديناميكي أو على رأس بعض anzatz الاضطرادي للاضطراب الصغيرة (غير مهم) المحددات. ومن أمثلة تلك التركيبات CASPT2 و SORCI.
أنظمة بلورية
في فيزياء المادة المكثفة ، يتم وصف الإلكترونات عادة بالإشارة إلى شبكة دورية من النوى الذرية. وبالتالي، فإن الإلكترونات غير المتفاعلة عادة ما يتم وصفها بواسطة موجات بلوخ، والتي تتوافق مع المدارات الجزيئية المتناظرة المتناظرة المتناظرة المستخدمة في الجزيئات (في حين تتطابق وظائف وانير مع المدارات الجزيئية الموضعية). وقد اقترح عدد من التقريبية النظرية الهامة لشرح الارتباطات الإلكترون في هذه الأنظمة البلورية.
إن النموذج السائل Fermi للإلكترونات المترابطة في المعادن قادر على تفسير اعتماد درجة الحرارة على المقاومة من خلال تفاعلات الإلكترون الإلكتروني. كما أنه يشكل الأساس لنظرية BCS للموصلية الفائقة، والتي هي نتيجة لتفاعلات الإلكترون الإلكترون بوساطة الفونون. يقال أن الأنظمة التي تفلت من وصف السائل Fermi ترتبط ارتباطًا وثيقًا. تلعب التفاعلات دورًا مهمًا في ظهور ظواهر جديدة نوعيًا. هذه هي الحالة، على سبيل المثال، عندما تكون الإلكترونات قريبة من انتقال عازل معدني. يعتمد نموذج هوبارد على التقريب المُلزم بإحكام، ويمكن أن يفسر التحولات العازلة للموصل في عوازل موت مثل أكاسيد المعادن الانتقالية عن طريق وجود تفاعلات كولومبية مثيرة للاشمئزاز بين الإلكترونات. تعتبر النسخة ذات البعد الواحد نموذجًا أصليًا لمشكلة الارتباطات القوية وتعرض العديد من المظاهر الدرامية مثل تجزئة شبه الجسيمات. ومع ذلك، لا يوجد حل دقيق لنموذج هوبارد في أكثر من بُعد واحد
يمكن أن يفسر تفاعل RKKY ارتباطات الإلكترون بالدور بين إلكترونات الصدف الداخلية غير المتزاوجة في ذرات مختلفة في بلورة موصلة بتفاعل من الدرجة الثانية يتم توسطه بواسطة إلكترونات التوصيل.
يقترب نموذج السائل Tomonaga Luttinger من تفاعلات الإلكترون الإلكتروني من الدرجة الثانية كالتفاعلات البوزونية.
مصادر
- "معلومات عن ارتباط إلكتروني على موقع britannica.com". britannica.com. مؤرشف من الأصل في 2015-09-18.
نظرية الكم لإنظمة الجسيمات المتعددة https://doi.org/10.1103%2FPhysRev.97.1509
التفاعلات الكيميائية في المعادن https://journals.aps.org/pr/abstract/10.1103/PhysRev.46.1002
رسائل الفيزياء الكيميائية https://www.sciencedirect.com/science/article/pii/S0009261416306947?via%3Dihub
مجلة كيمياء الحاسوبية https://www.worldcat.org/title/journal-of-computational-chemistry/oclc/1004533436
انظر أيضا
- بوابة كيمياء فيزيائية
- بوابة ميكانيكا الكم
- بوابة الفيزياء
- بوابة الكيمياء