إدارة مرض باركنسون
بسبب طبيعة المرض المزمنة، تتطلب إدارة مرض باركنسون برنامجًا واسعًا النطاق بما في ذلك تعليم المريض وأسرته، مجموعات الدعم، ممارسة الرياضة، التغذية الجيدة. في الوقت الحاضر، لا يوجد علاج معروف لمرض باركنسون، ولكن يمكن للأدوية أو الجراحة أن تقلل من تلك الأعراض.
بالرغم من وجود العديد من الأدوية التي يتم وصفها لعلاج مريض الباركنسون، لا شيء منها في الواقع يقوم بعكس آثار المرض. بالإضافة إلى أن وصف العلاج يختلف مع حالة المريض. ولذلك، فإن الأشخاص الذين يعانون من مرض باركنسون غالبا ما يحتاجون إلى مجموعة متنوعة من الأدوية لعلاج أعراض المرض.[1] يتم تنمية العديد من الأدوية حاليا لكي تسعى إلى معالجة أفضل لمرض باركنسون. ومع ذلك، لا يوجد حتى الآن علاج محدد في السوق ضد مرض باركنسون.[2]
أدوية
ليفودوبا، منبهات الدوبامين، ومثبطات ماو-ب هي الأسر الرئيسية من الأدوية المفيدة لعلاج الأعراض الحركية لمرض باركنسون.[3] استخدام العلاج الأكثر شيوعا يختلف تبعا لمرحلة المرض. وهناك مرحلتين للعلاج. المرحلة الأولية: الأفراد المصابون بالمرض منذ مدة وقد بدأ المرض بالفعل بالتأثير عليهم من الناحية الحركية (عجز حركي) يحتاجون للعلاج الدوائي، والمرحلة الثانية التي يحدث بها مضاعفات بسبب تعاطي أدوية ليفودوبا.[3] يهدف العلاج في الحالة الأولية إلى تحقيق التبادل الأمثل بين الإدارة الجيدة للأعراض والآثار الجانبية الناجمة عن تعزيز وظيفة الدوبامين.(قد يتأخر بدء العلاج ل-دوبا عن طريق استخدام أدوية أخرى مثل مثبطات ماو-ب ومنبهات الدوبامين) على أمل توقف الخلل الحركي. في المرحلة الثانية، الهدف هو تقليل الأعراض في حين السيطرة على تقلبات الاستجابة للأدوية. كما يجب السيطرة علي الانسحاب المفاجئ من الدواء، والاستخدام المفرط من قبل بعض المرضى.[3] عندما تكون الأدوية غير كافية للسيطرة على الأعراض، يمكن استخدام التقنيات الجراحية مثل تحفيز الدماغ العميق أن يخفف من اضطرابات الحركة المرتبطة بها.[4]
ليفودوبا

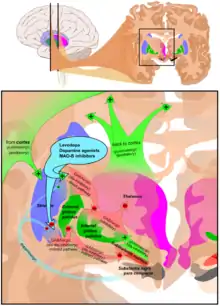
ليفودوبا (L-DOPA) كان العلاج الأكثر استخداما على مدى أكثر من 30 عاما.[3] يتم تحويل L-دوبا إلى الدوبامين في الخلايا العصبية بواسطة دوبا - ديكاربوكسيلاس.[3] وبما أن الأعراض الحركية تنتج عن نقص الدوبامين في المادة السوداء، فإن استخدام L-DOPA يقلل مؤقتا من الأعراض الحركية.[3]
فقط 5-10٪ من L-DOPA يعبر حاجز الدم في الدماغ. وغالبا ما يتم تحويل البقية إلى دوبامين في مكان آخر، مما يسبب مجموعة واسعة من الآثار الجانبية بما في ذلك الغثيان، خلل الحركة.[3] كاربيدوبا وبنسيرازيد هي مثبطات دكاربوكسيلاز دوبا التي تقوم بتثبيط تكوين الدوبامين في الأماكن الأخرى الغير مرغوب بها، وبالتالي تقليص الأعراض الجانبية للعلاج بقدر الإمكان.[3] حيث تمنع عملية التمثيل الغذائي للـ L-DOPA في الأماكن الأخرى، وبالتالي زيادة تسليم ليفودوبا إلى الجهاز العصبي المركزي.[3] المثبطات الحالية هي كاربيدوبا / ليفودوبا (الأسماء التجارية سينيميت، فارماكوبا، اتامت) وبنسيرازيد / ليفودوبا (الاسم التجاري مادوبار).[5]
تولكابون يمنع انزيم الكاتيكول- O- ميثيل ترانسفيراس (ناقل كاتيكول-و-مثيل)، الذي يحط من الدوبامين وليفادوبا، وبالتالي إطالة الآثار العلاجية ل ليفودوبا.[3] يستخد التولكابون، جنبا إلى جنب مع مثبطات ديكاربوكسيلاس دوبا الطرفية، لزيادة القوة العلاجية من L-DOPA. ومع ذلك فهذا العلاج محدود، نظرا لآثاره الجانبية المحتملة مثل فشل الكبد.[3] دواء مماثل، إنتاكابون، لم يظهر أنه يسبب تغييرات كبيرة في وظائف الكبد كما يحافظ على تثبيط كاف من COMT مع مرور الوقت.[3] يمكن استخدام الإنتاكابون كعلاج (كومتان) أو جنبا إلى جنب مع كاربيدوبا وليفودوبا (ستاليفو).[3]
نتائج استخدام ليفودوبا يعمل على انخفاض تكوين الجسم الذاتي لـ L-DOPA، على المدى الطويل يُمكن أن يسبب العلاج تطوير المضاعفات الحركية التي تتميز بالحركات اللاإرادية والخلل الحركي والتقلبات في الاستجابة للأدوية.[3] عندما يحدث ذلك، يتحول مريض باركنسون من مريض مستجيب بشكل جيد جدا للعلاج وتحسن ملحوظ في اختفاء أعراض المرض إلى مريض غير مستجيب إطلاقا للعلاج وظهور الأعراض المرضية بشكل سئ [3] لهذا السبب، يتم إعطاء مرضى باركنسون جرعات مخفضة من ليفودوبا قدر الإمكان للحد من تلك المشكلة.[3] التأخير في بدء العلاج الدوائي، بدلا من استخدام بدائل لبعض الوقت، يعد من الأمور الشائعة أيضا لتفادي تلك المشكلة.[3] كانت الاستراتيجية السابقة للحد من المضاعفات الحركية هي سحب L-DOPA من المرضى لبعض الوقت. ولكنه كان أمر سئ لأنه يمكن أن يجلب آثار جانبية خطيرة مثل متلازمة (خبيثة الذهان).[3] معظم المرضى في نهاية المطاف بحاجة ل ليفودوبا وفي وقت لاحق سوف يتم ظهور المضاعفات الحركية.[3]
ظاهرة المضاعفات المرضية بسبب استخدام العلاج يطلق عليها بالإنجليزية (on-off phenomenon) وهي نتيجة ثابتة تقريبا من العلاج بـ ليفودوبا المستدام في المرضى الذين يعانون من مرض باركنسون. مراحل الجمود والعجز المرتبطة بالاكتئاب. كل هذه الأعراض المسئول عنها هو العلاج، وبالرغم من كل هذه المشاكل التي تسببها العوامل الدوائية لمرضى باركنسون يتم تقديم الأدلة للإشارة إلى أهمية التعامل مع ليفودوبا. إعادة توزيع جرعات ليفودوبا بجرعات أصغر وأكثر تواترا، قد تكون مفيدة في التحكم في التذبذبات في بعض المرضى. وقد يؤدي تقييد البروتينات الغذائية واستخدام هيدروكلوريد السيليجيلين والبروموكريبتين أيضا إلى تحسين تقلبات الحركة بشكل مؤقت. ويشمل النهج الجديد للعلاج استخدام آبومورفين تحت الجلد، وخروج ليفودوبا بكميات صغيرة مع مثبط دوبا كربوكسيل المحيطي يُساعد ذلك على خفض المضاعفات الناتجة عن استخدام L-DOPA.
ناهضات الدوبامين
ناهضات الدوبامين لها تأثير مماثل لـ ليفودوبا لأنها ترتبط بمستقبلات الدوبامين في الدماغ.[3] تم استخدام منبهات الدوبامين في البداية للمرضى الذين يعانون من ظاهرة مشاكل العلاج ب L-DOPA وديسكينيسياس كعلاج تكميلي ل ليفودوبا (on-off phenomenon)، لكنها الآن تستخدم أساسا من تلقاء نفسها كعلاج أولي للأعراض الحركية بهدف تأخير المضاعفات الحركية.[3][6] تشمل منبهات الدوبامين ما يلي: بروموكريبتين، بيرغوليد، براميبكسول، روبينيرول، بيريبيديل، كابرجولين، آبومورفين، ليسوريد.
محفز الدوبامين له اثار جانبية كثيرة وان كانت خفيفة مثل: النعاس، الهلوسة، الأرق، الغثيان، الإمساك.[3] في بعض الأحيان، تظهر الآثار الجانبية حتى في الحد الأدنى من الجرعة الفعالة سريريا، مما يؤدي الطبيب للبحث عن محفز مختلف.[3] بالمقارنة مع ليفودوبا، يقوم محفز الدوبامين بتأخير المضاعفات الحركية، والسيطرة على أعراض أسوأ من ليفودوبا.[3] ومع ذلك، فهي عادة ما تكون فعالة بما يكفي لإدارة الأعراض في السنوات الأولى.[7] كما أن محفزات الدوبامين أكثر تكلفة.[7] منبهات الدوبامين عند الجرعات العالية تسبب اضطرابات السيطرة على النبضات.[5] ديسكينيسياس مع منبهات الدوبامين نادرة في المرضى الأصغر سنا، وأكثر شيوعا في المرضى الأكبر سنا.[7] كل هذا يوضح مدى أهمية منبهات الدوبامين كعلاج أولي لمرضى باركنسون عن ليفودوبا.[7]
آبومورفين، هو محفز للدوبامين والذي لا يُؤخذ عن طريق الفم، يمكن استخدامه للحد من فقدان الحركة في أواخر المرض.[3] وبما أن الآثار الثانوية مثل الارتباك والهلوسة ليست نادرة مع علاج آبومورفين، ينبغي مراقبة المرضى عن كثب.[3] آبومورفين يمكن أن يُؤخذ عن طريق الحقن تحت الجلد باستخدام مضخة صغيرة يحملها المريض. ويتم إعطاء جرعة منخفضة تلقائيا على مدار اليوم، وبالتالي الحد من تقلبات الأعراض الحركية من خلال توفير جرعات ثابتة من محفزات الدوبامين.عند استخدام مضخة آبومورفين يجب تغيير موقع الحقن يوميا لتجنب تشكيل العقيدات. آبومورفين متاح أيضا بجرعات كبيرة كقلم أوتينجكتورالمُستخدم لجرعات الطوارئ مثل السقوط أو أول جرعة في الصباح. الغثيان والقيء أمر شائع مع آبومورفين، وقد يتطلب ذلك أخذ الدومبيريدون (مضاد للقىء).
في دراسة تقييم فعالية لمنبهات الدوبامين بالمقارنة مع ليفودوبا، أظهرت النتائج أن المرضى الذين أخذوا منبهات الدوبامين كانوا أقل عرضة لتطوير خلل الحركة، خلل التوتر، وتقلبات الحركات، على الرغم من أنهم أكثر عرضة لوقف العلاج بسبب الآثار الجانبية السلبية مثل الغثيان، والإمساك، وما إلى ذلك.
مثبطات ماو-ب
تقوم مثبطات أكسيداز أحادي الأمين (سيليجيلين، راساجيلين) على زيادة مستوى الدوبامين في العقد القاعدية. حيث تقوم بتثبط مونوامين أوكسيديز-ب (ماو-ب) ((Mono amine oxidase-B (MAO- B) الذي يقوم بتكسير الدوبامين الذي يتم افرازه من الخلايا العصبية. ولذلك، فإن تقليل ماو-ب يؤدي إلى كميات أعلى من L-DOPA.[3] وبالمثل لمحفزات الدوبامين، مثبطات ماو-ب تحسن الأعراض الحركية وتأخر الحاجة إلى اتخاذ ليفودوبا كعلاج وحيد في المراحل الأولى من المرض، ولكن تلك المثبطات تنتج آثار أكثر سلبية وتكون أقل فعالية من ليفودوبا. كما أن فعاليتها في المرحلة المتقدمة من المرض ضعيفة.[3]
وتشمل الأيضات من سيليجيلين على: L- الأمفيتامين و L- الميثامفيتامين. هذا قد يؤدي إلى آثار جانبية مثل الأرق. تأثير جانبي آخر يمكن أن يكون التهاب الفم. وخلافا لغيرها من مثبطات أوكسيديز مونوامين، الأطعمة التي تحتوي على تيرامين لا تسبب أزمة ارتفاع ضغط الدم.
الأدوية الأخرى
بعض الأدلة تشير إلى أدوية أخرى مثل أمانتادين ومضادات الكولين قد تكون مفيدة كعلاج للأعراض الحركية في مرض باركنسون المبكر والمتأخر، ولكن تلك الأدوية لا تُعتبر العلاج الأول للمرض.[3] بالإضافة إلى الأعراض الحركية، يرافق مرض باركنسون مجموعة من الأعراض المختلفة والتي يتم استخدام مركبات مختلفة لتحسين بعض من هذه المشاكل.[8] ومن الأمثلة على ذلك استخدام كلوزابين للذهان، مثبطات الكولينستراز للخرف، ومودافينيل للنعاس.[8][9]
وتشير دراسة أولية إلى أن أخذ دواء دونبيزيل قد يساعد على منع سقوط مرضى باركنسون. دونيبيزيل يعزز مستويات الناقلات العصبية لل أستيل كولين، وهو حاليا العلاج المعتمد للأعراض المعرفية لمرض ألزهايمر.[10]
إدخال كلوزابين (كلوزاريل) يمثل انفراجة كبيرة في علاج الأعراض الذهانية من مرض باركنسون. قبل إدخال الكلوزابين، كان التعامل مع الأعراض الذهانية يعتمد على الحد من علاج الدوبامين أو العلاج بواسطة الجيل الأول من مضادات الذهان، وكلها كانت تسئ إلى وظيفة الحركة في المرضى. وتشمل مضادات الذهان الغير نمطية المفيدة في العلاج كيتيابين (سيروكيل)، زيبراسيدون (جيودون)، أريبيبرازول (أبيليفي)، وباليبيريدون (إنفيغا). ويعتقد أن كلوزابين لديها أعلى فعالية وأقل اثار جانبية.[9]
الجراحة

كان علاج مرض باركنسون يقتصر على الجراحة، ولكن بعد اكتشاف ليفودوبا، اقتصرت الجراحة على عدد قليل فقط من الحالات.[11] وقد أدت الدراسات في العقود القليلة الماضية إلى تحسينات كبيرة في التقنيات الجراحية، ويتم استخدام الجراحة مرة أخرى في الأشخاص الذين يعانون من أعراض مرض باركنسون المتقدمة الذين لم يعد العلاج الدوائي كافيا لهم.[11]
أقل من 10٪ من مرضى باركنسون مؤهلين كمرشحين مناسبين للاستجابة الجراحية. ثلاثة آليات مختلفة للاستجابة الجراحية ل مرض باركنسون هي: (حرق لا رجعة فيه أو تجميد أنسجة المخ)، أو تحفيز العميق للدماغ (DBS)، أو الجراحة التصالحية.[12]
المناطق المستهدفة لتحفيز الدماغ العميق (DBS) تشمل المهاد، الكرة الشاحبة (تقنية الآفة التي تسمى باليدوتومي)، أو النواة أسفل المهاد[11]
جراحة الآفة العصبية
يتم تدمير الآفة العصبية عن طريق الحرارة، وأجزاء من الدماغ المرتبطة بإنتاج أعراض عصبية باركنسونية. الإجراءات عموما تنطوي على المهاد و / أو باليدوتومي. بالنسبة للمهاد يتم تدمير جزء منه وخاصة فينتيراليس إنترمديوس، لقمع الرعاش في 80-90٪ من المرضى. إذا أصبحت الأكينيسيا واضحة، يكون موقع الاجتثاث هو نواة تحت المهاد.
في المرضى المصابون بالأكينيسيا يتم تدمير الشاحبة غلوبوس، ولا سيما في غلوبوس باليدوس إنتيرنا. ولأنه من الصعب قياس كمية الأنسجة التي يتم تدميرها بدقة، وأن الأنسجة التي تضررت لا رجعة فيها، قد تم استبدال هذه الطريقة عموما بالجراحة العميقة في الدماغ.
تحفيز الدماغ العميق
التحفيز العميق للدماغ (DBS) هو حاليا الأسلوب الأكثر استخداما من العلاج الجراحي لأنه لا يدمر أنسجة المخ، بل هو عكسها، ويمكن أن يكون مصمما للأفراد في مرحلة خاصة من المرض. يستخدم (DBS) ثلاثة مكونات: محفز عصبي، يسمى أيضا مولد النبض المزروع (IPG)، الذي يولد نبضات كهربائية تستخدم لتعديل النشاط العصبي، سلك الرصاص الذي يوجه النبضات لعدد من الأقطاب المعدنية نحو طرف الرصاص بالقرب من هدف التحفيز، وسلك التمديد الذي يربط الرصاص. يتم زرع (IPG)، وهو عبارة عن بطارية تعمل بالطاقة والمغطاة بالتيتانيوم، تقليديا تحت الترقوة، ويتم توصيله عن طريق التمديد تحت الجلد إلى الرصاص، والذي يمتد من خارج الجمجمة تحت فروة الرأس وصولا إلى الدماغ ثم إلى الهدف.
ويمكن تحقيق الاستهداف قبل الجراحة لمواقع الزرع المناسبة عن طريق الطرق غير المباشرة والمباشرة. الطريقة غير المباشرة تستخدم التصوير المقطعي بالحاسوب، التصوير بالرنين المغناطيسي، أو البطين لتحديد موقع الصوار الأمامي والخلفي ثم توظف الإحداثيات والمسافات المحددة سلفا من الخط بين الصائم لتحديد المنطقة المستهدفة. ويمكن أيضا استخدام خرائط الأطلس المحددة نسيجيا لاحقا للتحقق من المنطقة المستهدفة. الطريقة المباشرة توفر التصور واستهداف نواة عميقة من خلال تطبيق التصوير بالرنين المغناطيسي، والتي على عكس الطريقة غير المباشرة، يأخذ في الاعتبار الاختلاف التشريحي لحجم النوى، والفصل الوظيفي بين الأفراد.[13]
وقد وضعت الخرائط الوظيفية الكهربية، وهي أداة تستخدم في كلا الطريقتين للتحقق من نوى الهدف، بسبب المخاطر المرتبطة من النزيف، واضطراب أو تقلصات كزازي. في الآونة الأخيرة، أظهرت حساسية التصوير المرجح، وهو نوع من التصوير بالرنين المغناطيسي، قوة لا تصدق على التمييز بين نوى الدماغ العميقة، ويجري استخدامها في (DBS) للحد من الإفراط في EFM.[14]
يوصى التحفيز العميق للدماغ (DBS) لمرضى باركنسون الذين يعانون من التقلبات الحركية بسبب الدواء، أو لأولئك الذين هم يرفضون الدواء.[4]
التحفيز العميق للدماغ فعال في قمع أعراض مرض باركنسون، وخاصة الهزة. وأدت دراسة سريرية أجريت مؤخرا إلى توصيات بشأن تحديد أي مرضى باركنسون هم الأكثر احتمالا للاستفادة من (DBS).[4]
النظام الغذائي
العضلات والأعصاب التي تتحكم في عملية الهضم قد تتأثر بمرض باركنسون، لذلك فمن الشائع حدوث الإمساك وشلل المعدة (المواد الغذائية المتبقية في المعدة تبقى لفترات أطول من المعتاد).[15] يُنصح باتباع نظام غذائي متوازن للمساعدة في تحسين عملية الهضم. يجب أن يتضمن النظام الغذائي الأطعمة الغنية بالألياف الغذائية والكثير من الماء.[15] تستخدم ليفودوبا والبروتينات نفس نظام النقل في الأمعاء والحاجز الدموي في الدماغ، ويوجد بينهما تنافس للوصول إلى تلك المناطق.[15] عندما يتم أخذ الأدوية في وقت واحد، فإن عواقب هذه المنافسة هو انخفاض فعالية الدواء.[15] لذلك، عندما يتم أخذ ليفودوبا، يتم تثبيط البروتينات، في حين أنه في المراحل المتقدمة، يوصى بتناول إضافي من المنتجات منخفضة البروتين مثل الخبز أو المعكرونة لأسباب مماثلة.[15] لتقليل التفاعل مع البروتينات، يوصى أن تُؤخذ ليفودوبا قبل 30 دقيقة من وجبات الطعام.[15] في الوقت نفسه، يتم تقييد استخدام البروتينات أثناء الإفطار والغداء وعادة ما تؤخذ في العشاء.[15] مع تطور المرض، قد يظهر عسر البلع. في مثل هذه الحالات، تشمل تدابير محددة لاستهلاك السائل، والمواقف الخاصة عند تناول الطعام، وفغر المعدة في أسوأ الحالات.[15]
إعادة التأهيل
دراسة إعادة التأهيل في مرض باركنسون نادرة وذات جودة منخفضة.[16][17] تشير أدلة جزئية إلى قدرة إعادة التأهيل على حل مشاكل الكلام والحركة، ولكن هذه الدراسات نادرة ومنخفضة الجودة.[16][17] يمكن ممارسة الرياضة البدنية العادية و / أو العلاج الفيزيائي لتحسين الحركة والمرونة والقوة، وسرعة المشي، ونوعية الحياة.[17] إعادة التأهيل قد يحسن من الإمساك أيضا. وقد تبين أن التمارين الرياضية تفيد المرضى الذين يعانون من مرض باركنسون فيما يتعلق بالأداء البدني، ونوعية الحياة والحد من خطر التوازن والسقوط. استعرضت 14 دراسة آثار ممارسة الرياضة على الأشخاص الذين يعانون من مرض باركنسون، ونتجت إلى أنه لم تحدث أي آثار جانبية بسبب الرياضة.[18] ومن المعروف أن هناك خمس آليات مقترحة يمكن من خلالها تعزيز الممارسة العصبية. النشاط المكثف. أنشطة معقدة تعزز التكيف الهيكلي بشكل أكبر؛ والأنشطة المجزية تعمل على زيادة مستويات الدوبامين في الجسم، وبالتالي تعزيز التعلم / إعادة التعلم؛ يتم إدخال التمارين الرياضية في مرحلة مبكرة من المرض، وبالتالي تعمل تلك التمارين على تباطئ تطور مرض باركنسون.[15][19] واحدة من أكثر العلاجات التي تُمارس على نطاق واسع لعلاج اضطرابات الكلام المرتبطة بمرض باركنسون هو العلاج الصوتي لي سيلفرمان (LSVT)، الذي يركز على زيادة الجهارة الصوتية واتباع نهج مكثف لمدة شهر واحد[16][20] علاج النطق باستخدام (LSVT)على وجه التحديد قد يُحسن من وظيفة الصوت والكلام.[16] العلاج الوظيفي (OT) يهدف إلى تعزيز الصحة ونوعية الحياة من خلال مساعدة المرضى للمشاركة في العديد من أنشطة الحياة اليومية.[16] تم إجراء عدد قليل من الدراسات حول فعالية (OT) ونوعيتها، على الرغم من أن بعض المؤشرات تدل على أنه قد تتحسن المهارات الحركية ونوعية الحياة.[16][21]
التمارين الرياضية
ممارسة التمارين البدنية العادية مع أو بدون العلاج الفيزيائي يمكن أن يكون مفيدا للحفاظ على تحسين التنقل والمرونة والقوة، وسرعة المشي، ونوعية الحياة.[17][22] تم اكتشاف تقنيات استرخاء مثل هزاز لطيف لتقليل التوتر العضلي المفرط لتحسين المرونة للمرضى الذين يعانون من الصلابة. تقنيات فعالة أخرى لتعزيز الاسترخاء تشمل حركة دورانية بطيئة للأطراف والجذع.[23] يتم تناول التغيرات الشائعة في المشية المرتبطة بهذا المرض مثل نقص الحركة (بطء الحركة)، خفض الذراع من خلال مجموعة متنوعة من الاستراتيجيات لتحسين التنقل الوظيفي. وتشمل الأهداف برامج إعادة تأهيل لتحسين سرعة المشي، وطول الخطوة. كما تشمل الاستراتيجيات استخدام المعدات المساعدة والكتابة اللفظية (اليدوية والبصرية والسمعية).[24]
وقد أدت تمارين التقوية إلى تحسينات في وظائف القوة والحركة في المرضى الذين يعانون من ضعف العضلات الأساسي والضعف المرتبط بعدم النشاط في حالات مرض باركنسون المعتدل.[22] يقوم المرضى بتمارين لمدة 45 دقيقة إلى ساعة واحدة بعد الدواء.[25] ووجدت دراسة تدريب أن المقاومة الموجهة نحو الساقين السفلية للمرضى الذين يعانون من مرض باركنسون لمدة 8 أسابيع اكتسبوا قوة في البطن، وتحسن في سرعة المشي.[26] تمارين التنفس العميقة هي مفيدة لتحسين حركة الصدر وتلك التمارين ضرورية بسبب وجود اختلالات في الجهاز التنفسي لمرضى باركنسون.[27] ممارسة الرياضة قد تحسن من الإمساك.[28]
التلقين
يتم استخدام الأجهزة البصرية والسمعية والحسية والجسدية [29] جنبا إلى جنب مع مساعدات المشي لتحسين المشي في الأفراد الذين يعانون من مرض باركنسون.[30]
تدريب المشي
قد يؤدي التدريب على مشية محددة المهام إلى تحسين المشي على المدى الطويل للمرضى الذين يعانون من مرض باركنسون. وقد استخدمت الدراسات البحثية السابقة نظم دعم وزن الجسم أثناء تدريب المشي، وقد تبين أن هذا التدريب على المشي يساعد على تحسين سرعة المشي على المدى الطويل.[31]
تبحث الدراسات في تأثير تاي تشي على أداء المشية، والتوازن في الأشخاص الذين يعانون من مرض باركنسون.[32][33] وخلصت الدراسة الأولى إلى أن تاي تشي كان غير فعال لأنه لم يكن هناك تحسن في أداء المشية وليس هناك تحسن في درجة الجزء الثالث من مقياس تصنيف مرض باركنسون الموحد (UPDRS).[32]
الكلام والعلاج المهني
واحدة من العلاجات الأكثر ممارسة على نطاق واسع لعلاج اضطرابات الكلام المرتبطة بمرض باركنسون هو العلاج النفسي لي سيلفرمان (LSVT).[16][20]
أجريت دراسة لتحديد ما إذا كان LSVT مفيد في تحسين وضوح الجملة من 8 لمكبرات الصوت مع مرض باركنسون، وفقا لمستمعي السمع العادي.[34] وخلصت الدراسة إلى أنه بعد LSVT، كان هناك تحسن كبير في نسبة الكلمات التي يفهمها المستمعين.[34] على الرغم من أن LSVT لم يكن مفيدا ل 2 من المتكلمين، والعلاج لم يعمل على زيادة بريق الصوت.[34] ولذلك، أظهر LSVT أنه يمكن أن يُحسن من الكلام والصوت لدى الأشخاص الذين يعانون من مرض باركنسون.[34]
يمكن للأشخاص المصابين بمرض باركنسون أيضا أن يصابوا بالاضطراب الذي يتميز بانخفاض وضوح الكلام.[35]
العلاج الوظيفي يهدف إلى تعزيز الصحة ونوعية الحياة من خلال مساعدة الأشخاص المصابين بالمرض للمشاركة في أكبر قدر ممكن من روتينهم اليومي قدر الإمكان.[16] هناك مؤشر على أن العلاج المهني قد يحسن المهارات الحركية ونوعية الحياة طوال فترة العلاج.[16][21]
العلاج بالموسيقى
الدراسات تدرس ما إذا كان العلاج بالموسيقى يمكن أن يكون له تأثير مفيد على مرضى باركنسون.[36] دراسة لمدة 3 أشهر تحققت ما إذا كان هناك أي فائدة حركية للعلاج بالموسيقى والعلاج الطبيعي على مرضى باركنسون، وما إذا كانت العلاجات لها أي تأثير على رفاههم العاطفي ونوعية حياتهم.[36] يتكون العلاج الموسيقي من الغناء الكوري، والممارسة الصوتية والحركات الإيقاعية وحرية الجسم، في حين أن العلاج الطبيعي يتألف من تمارين التمدد، والمهام الحركية محددة وسبل تحسين التوازن والمشية.[36] وخلصت الدراسة إلى أن العلاج بالموسيقى كان له تأثير مفيد على مشاعر المريض، فإنه أظهر تحسنا في بطء الحركة، وفي نوعية الحياة. لكن العلاج بالموسيقى كان يفتقر إلى الفائدة الحركية، في حين أظهر العلاج الطبيعي تحسن في صلابة المرضى.[36]
الرعاية التلطيفية
غالبا ما تكون الرعاية التلطيفية مطلوبة في المراحل النهائية من المرض، عندما يصبح العلاج بالدوبامين غير فعال. والهدف من الرعاية التلطيفية هو تحقيق أقصى قدر من نوعية الحياة للشخص المصاب بالمرض. يتم الحد من أو سحب تناول مخدرات الدوبامين للحد من الآثار الجانبية للدواء، ومنع قرح الفراش التي تأتي للمرضى الغير نشطين أو الغير قادرين على الحركة.[37]
العلاجات الأخرى
يحسن التحفيز المغناطيسي للدماغ مؤقتا من خلل الحركة التي يسببها ليفودوبا [38] وقد اقترحت العناصر الغذائية المختلفة كعلاجات ممكنة. ومع ذلك، لا يوجد دليل يدل على أن الفيتامينات أو المضافات الغذائية تعمل على تحسين الأعراض.[39] لا توجد أدلة كافية تشير إلى أن الوخز بالإبر، وممارسة تاي تشي شوان لها أي تأثير على الأعراض.[40][41][42] الفول والميقونة هي مصادر طبيعية من ل-دوبا يتم اتخاذها من قبل العديد من المرضى المصابين بمرض باركنسون. في حين أنها أظهرت بعض الفعالية[43] تناول مثل تلك الأشياء ليس خاليا من المخاطر.[44][45]
هناك أيضا جهاز يمكن ارتداؤه يمكن أن يعمل على الحد من هزات يد المريض والأصابع وبالتالي استعادة الوظائف الطبيعية.[46][47][48]
التاريخ

وقد وصفت الآثار الإيجابية وإن كانت متواضعة من مضادات الكولين شبه القلوية التي تم الحصول عليها من مصنع بيلادونا (ست الحسن) خلال القرن التاسع عشر من قبل شاركوت، إرب، وغيرهم. قد جرت تجربة الجراحة الحديثة للرعاش، والتي تتكون من ليسيونينغ لبعض الهياكل العقد القاعدية لأول مرة في عام 1939، وتحسنت على مدى السنوات ال 20 التالية.[49] قبل هذا التاريخ، كانت مضادات الكولين والجراحة هي التريمات الوحيدة حتى وصول ليفودوبا، مما قلص استخدامها بشكل كبير.[49][50]
تم تصنيع ليفودوبا لأول مرة في عام 1911 من قبل كازيمير فانك، لكنها لم تحظ باهتمام يذكر حتى منتصف القرن العشرين.[51] ودخلت الممارسة السريرية في عام 1967، ونشرت أول دراسة كبيرة تحسينات في الأشخاص الذين يعانون من مرض باركنسون الناتجة عن العلاج مع ليفودوبا في عام 1968. ليفودوبا جلبت ثورة في علاج مرض باركنسون.[51][52] وبحلول أواخر الثمانينيات ظهرتحفيز الدماغ العميق كعلاج ممكن، وتمت الموافقة عليه للاستخدام السريري من قبل إدارة الغذاء والدواء (الولايات المتحدة) في عام 1997.[53]
اتجاهات البحث
لا يتوقع حدوث علاجات جديدة على المدى القصير، ولكن هناك عدة خطوط بحث نشطة للعلاجات الجديدة.[54] وتشمل هذه الاتجاهات البحثية البحث عن نماذج حيوانية جديدة للمرض، والفائدة المحتملة للعلاج الجيني، وزرع الخلايا الجذعية.[55]
نماذج حيوانية
مجموعة من مدمني المخدرات في ولاية كاليفورنيا في أوائل 1980s الذين استهلكوا دفعة ملوثة بشكل غير مشروع من الأفيون الاصطناعية جلب إلى الضوء الأعراض الباركنسونية.[56] وهناك نماذج أخرى سائدة تعتمد على السموم وتستخدم روتنون المبيدات الحشرية، وباراكوات مبيدات الأعشاب، ومانيب الفطريات.[57] النماذج التي تعتمد على السموم هي الأكثر استخداما في الرئيسيات. كما توجد نماذج القوارض المعدلة وراثيا أيضا [58]
علاجات الأعصاب

التحقيقات في الحماية العصبية هي في طليعة البحوث لمرض باركنسون. حاليا، لا يوجد أي علاج مثبت لعلاج مريض الباركنسون. في حين لا يزال نظريا، يستند علاج الأعصاب على فكرة أن بعض الخلايا العصبية التي تنتج الدوبامين تكون عرضة للانحلال المبكر وموت الخلايا يمكن أن يكون محمي من خلال إدخال الأدوية العصبية. يمكن أن تحدث هذه الحماية قبل أن تظهر أي أعراض على أساس المخاطر الوراثية.
وقد اقترحت عدة جزيئات كعلاجات محتملة.[55] ومع ذلك، لم يظهر أي من تلك الأدوية للحد من انحلال الأعصاب.[55] تشمل تلك الأدوية استماتة (omigapil، CEP-1347), حمض الجلوتاميك، أكسيداز أحادي الأمين (سيليجيلين، راساجيلين), ميتوكندريون (مرافق الإنزيم Q10، كرياتين), محصرات قنوات الكالسيوم و (إسراديبين) - عامل نمو (GDNF).[55] تستهدف الأبحاث قبل السريرية أيضا ألفا-ساينوسلين.[54]
زرع الأعصاب
منذ أوائل الثمانينيات من القرن العشرين استخدمت الأنسجة الجنينية والخنازير والشريان السباتي الأصلي أو الشبكية في زرع الخلايا لمرضى باركنسون.[55] وعلى الرغم من وجود دليل أولي على أن زرع الخلايا المنتجة للدوبامين في الدماغ المتوسط مفيد، فإن أفضل الدراسات التي شيدت حتى الآن تشير إلى أن زرع الخلايا ليس له أي تأثير.[55] وهناك مشكلة أخرى هامة هي الإفراط في إطلاق الدوبامين من الأنسجة المزروعة، مما يؤدي إلى خلل التوتر.[59] زرع الخلايا الجذعية هي هدف البحث الرئيسي الأخير: عندما زُرعت الخلايا في أدمغة القوارض والقردة، عملت على تحسين التشوهات السلوكية من الحيوانات.[55][60] ومع ذلك، فإن استخدام الخلايا الجذعية الجنينية مثير للجدل.[55] وقد اقترح البعض أن هذا الجدل يمكن التغلب عليه باستخدام خلية جذعية مستحثة وافرة القدرة من البالغين.[55]
مراجع
- "Medications & Treatments - Parkinson's Disease Foundation (PDF)". مؤرشف من الأصل في 2016-11-24. اطلع عليه بتاريخ 2020-09-20.
- "Medications for Parkinson's Disease: What's on the Horizon? - Parkinson's Disease Foundation (PDF)" [en]. مؤرشف من الأصل في 2016-12-07. اطلع عليه بتاريخ 2019-12-26.
- The National Collaborating Centre for Chronic Conditions، المحرر (2006). "Symptomatic pharmacological therapy in Parkinson's disease". Parkinson's Disease. London: Royal College of Physicians. ص. 59–100. ISBN:1-86016-283-5. مؤرشف من الأصل في 2017-05-10. Guidance was reviewed in 2011 and no changes were made. According to NICE as of July 2014 a revised guidance was under development with anticipated publication in 2017.
- Bronstein JM، Tagliati M، Alterman RL، وآخرون (أكتوبر 2010). "Deep Brain Stimulation for Parkinson Disease: An Expert Consensus and Review of Key Issues". Arch Neurol. ج. 68 ع. 2: 165–65. DOI:10.1001/archneurol.2010.260. PMID:20937936.
- Ceravolo R، Frosini D، Rossi C، Bonuccelli U (ديسمبر 2009). "Impulse control disorders in Parkinson's disease: definition, epidemiology, risk factors, neurobiology and management". Parkinsonism Relat. Disord. 15 Suppl 4: S111–15. DOI:10.1016/S1353-8020(09)70847-8. PMID:20123548.
- Goldenberg MM (أكتوبر 2008). "Medical management of Parkinson's disease". P & T. ج. 33 ع. 10: 590–606. PMC:2730785. PMID:19750042.
- Samii A، Nutt JG، Ransom BR (مايو 2004). "Parkinson's disease". Lancet. ج. 363 ع. 9423: 1783–93. DOI:10.1016/S0140-6736(04)16305-8. PMID:15172778.
- The National Collaborating Centre for Chronic Conditions، المحرر (2006). "Non-motor features of Parkinson's disease". Parkinson's Disease. London: Royal College of Physicians. ص. 113–33. ISBN:1-86016-283-5. مؤرشف من الأصل في 2014-04-01.
- Hasnain M، Vieweg WV، Baron MS، Beatty-Brooks M، Fernandez A، Pandurangi AK (يوليو 2009). "Pharmacological management of psychosis in elderly patients with parkinsonism". Am. J. Med. ج. 122 ع. 7: 614–22. DOI:10.1016/j.amjmed.2009.01.025. PMID:19559160.
- Donepezil (Aricept) Reduces Falls in People with Parkinson’s نسخة محفوظة 20 ديسمبر 2016 على موقع واي باك مشين.. Parkinson's Disease Foundation Science News. 11 November 2010. "نسخة مؤرشفة". مؤرشف من الأصل في 2011-07-19. اطلع عليه بتاريخ 2017-05-14.
{{استشهاد ويب}}: صيانة الاستشهاد: BOT: original URL status unknown (link) - The National Collaborating Centre for Chronic Conditions، المحرر (2006). "Surgery for Parkinson's disease". Parkinson's Disease. London: Royal College of Physicians. ص. 101–11. ISBN:1-86016-283-5. مؤرشف من الأصل في 2014-04-01.
- Parkinson's disease surgeryneurology Channel. Retrieved on 2010-02-02نسخة محفوظة 30 مارس 2010 على موقع واي باك مشين.
- Nolte, 2012
- Abosch, 2010
- Barichella M، Cereda E، Pezzoli G (أكتوبر 2009). "Major nutritional issues in the management of Parkinson's disease". Mov. Disord. ج. 24 ع. 13: 1881–92. DOI:10.1002/mds.22705. PMID:19691125.
- The National Collaborating Centre for Chronic Conditions، المحرر (2006). "Other key interventions". Parkinson's Disease. London: Royal College of Physicians. ص. 135–46. ISBN:1-86016-283-5. مؤرشف من الأصل في 2014-04-01.
- Goodwin VA، Richards SH، Taylor RS، Taylor AH، Campbell JL (أبريل 2008). "The effectiveness of exercise interventions for people with Parkinson's disease: a systematic review and meta-analysis". Mov. Disord. ج. 23 ع. 5: 631–40. DOI:10.1002/mds.21922. PMID:18181210.
- Goodwin V. A., Richards S. H., Taylor R. S., Taylor A. H., Campbell J. L. (2008). "The effectiveness of exercise interventions for people with Parkinson's disease: a systematic review and meta-analysis". Movement disorders. ج. 23 ع. 5: 631–40. DOI:10.1002/mds.21922. PMID:18181210.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - Fox CM, Ramig LO, Ciucci MR, Sapir S, McFarland DH, Farley BG (2006). "The science and practice of LSVT/LOUD: neural plasticityprincipled approach to treating individuals with Parkinson's disease and other neurological disorders". Semin Speech Lang. ج. 27: 283–299. DOI:10.1055/s-2006-955118. PMID:17117354.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - Fox CM، Ramig LO، Ciucci MR، Sapir S، McFarland DH، Farley BG (نوفمبر 2006). "The science and practice of LSVT/LOUD: neural plasticity-principled approach to treating individuals with Parkinson disease and other neurological disorders". Seminars in Speech and Language. ج. 27 ع. 4: 283–99. DOI:10.1055/s-2006-955118. PMID:17117354.
- Dixon L، Duncan D، Johnson P، وآخرون (2007). Deane K (المحرر). "Occupational therapy for patients with Parkinson's disease". Cochrane Database Syst Rev ع. 3: CD002813. DOI:10.1002/14651858.CD002813.pub2. PMID:17636709.
- Roeder، Luisa؛ Costello، Joseph T.؛ Smith، Simon S.؛ Stewart، Ian B.؛ Kerr، Graham K. (6 يوليو 2015). "Effects of Resistance Training on Measures of Muscular Strength in People with Parkinson's Disease: A Systematic Review and Meta-Analysis". PLoS ONE. ج. 10 ع. 7: e0132135. DOI:10.1371/journal.pone.0132135. PMC:4492705. PMID:26146840. مؤرشف من الأصل في 2020-03-04.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - O'Sullivan & Schmitz 2007، صفحات 873, 876
- O'Sullivan & Schmitz 2007، صفحة 879
- O'Sullivan & Schmitz 2007، صفحة 877
- Scandalis TA، Bosak A، Berliner JC، Helman LL، Wells MR (2001). "Resistance Training and Gait Function in Patients with Parkinson's Disease". Am J Phys Med Rehabil. ج. 80 ع. 1: 38–43. DOI:10.1097/00002060-200101000-00011.
- O'Sullivan & Schmitz 2007، صفحة 880
- Barichella، M؛ Cereda, E؛ Pezzoli, G (15 أكتوبر 2009). "Major nutritional issues in the management of Parkinson's disease". Movement disorders : official journal of the Movement Disorder Society. ج. 24 ع. 13: 1881–92. DOI:10.1002/mds.22705. PMID:19691125.
- van Wegen et al 2006; Nieuwboer et al. 2007
- "Parkinson Home Exercises App". Efox.nl. European Foundation for Health and Exercise. مؤرشف من الأصل في 2016-04-23. اطلع عليه بتاريخ 2015-12-04.
- Miyai I.؛ Fujimoto Y.؛ Yamamoto H.؛ وآخرون (2002). "Long-term effect of body weight-supported treadmill training in Parkinson's disease: a randomized controlled trial". Arch Phys Med Rehabil. ج. 83 ع. 10: 1370–73. DOI:10.1053/apmr.2002.34603.
- Amano S، Nocera JR، Vallabhajosula S، Juncos JL، Gregor RJ، Waddell DE، Wolf SL، Hass CJ (2013). "The effect of Tai Chi exercise on gait initiation and gait performance in persons with Parkinson's Disease". Parkinsonism Relat Disord. ج. 19 ع. 11: 955–60. DOI:10.1016/j.parkreldis.2013.06.007.
- Hackney ME، Earhart GM (2008). "Tai Chi improves balance and mobility in people with Parkinson disease". Gait & Posture. ج. 28 ع. 3: 456–60. DOI:10.1016/j.gaitpost.2008.02.005.
- Cannito MP، Suiter DM، Beverly D، Chorna L، Wolf T، Pfeiffer RM (2012). "Sentence Intelligibility Before and After Voice Treatment in Speakers With Idiopathic Parkinson's Disease". Journal of Voice. ج. 26 ع. 2: 214–19. DOI:10.1016/j.jvoice.2011.08.014.
- Tjaden,K (2008). "Speech and swallowing in parkinson's disease". Top Geriatric Rehabilitation. ج. 28 ع. 2: 115–26. DOI:10.1097/01.TGR.0000318899.87690.44. PMC:2784698. PMID:19946386.
- Pacchetti C، Mancini F، Aglieri R، Fundaro C، Martignoni E، Nappi G (2000). "Active Music Therapy in Parkinson's Disease: An Integrative Method for Motor and Emotional Rehabilitation". Psychosomatic Medicine. ج. 62 ع. 2: 386–93. DOI:10.1097/00006842-200005000-00012.
- The National Collaborating Centre for Chronic Conditions، المحرر (2006). "Palliative care in Parkinson's disease". Parkinson's Disease. London: Royal College of Physicians. ص. 147–51. ISBN:1-86016-283-5. مؤرشف من الأصل في 2014-04-01.
- Koch G (2010). "rTMS effects on levodopa induced dyskinesias in Parkinson's disease patients: searching for effective cortical targets". Restor. Neurol. Neurosci. ج. 28 ع. 4: 561–68. DOI:10.3233/RNN-2010-0556. PMID:20714078.
- Suchowersky O، Gronseth G، Perlmutter J، Reich S، Zesiewicz T، Weiner WJ (أبريل 2006). "Practice Parameter: neuroprotective strategies and alternative therapies for Parkinson disease (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology". Neurology. ج. 66 ع. 7: 976–82. DOI:10.1212/01.wnl.0000206363.57955.1b. PMID:16606908.
- Lee MS، Lam P، Ernst E (ديسمبر 2008). "Effectiveness of tai chi for Parkinson's disease: a critical review". Parkinsonism Relat. Disord. ج. 14 ع. 8: 589–94. DOI:10.1016/j.parkreldis.2008.02.003. PMID:18374620.
- Lee MS، Ernst E (يناير 2009). "Qigong for movement disorders: A systematic review". Mov. Disord. ج. 24 ع. 2: 301–03. DOI:10.1002/mds.22275. PMID:18973253.
- Lee MS، Shin BC، Kong JC، Ernst E (أغسطس 2008). "Effectiveness of acupuncture for Parkinson's disease: a systematic review". Mov. Disord. ج. 23 ع. 11: 1505–15. DOI:10.1002/mds.21993. PMID:18618661.
- Katzenschlager R، Evans A، Manson A، وآخرون (2004). "Mucuna pruriens in Parkinson's disease: a double blind clinical and pharmacological study". J. Neurol. Neurosurg. Psychiatr. ج. 75 ع. 12: 1672–77. DOI:10.1136/jnnp.2003.028761. PMC:1738871. PMID:15548480.
- Ladha SS، Walker R، Shill HA (مايو 2005). "Case of neuroleptic malignant-like syndrome precipitated by abrupt fava bean discontinuance". Mov. Disord. ج. 20 ع. 5: 630–31. DOI:10.1002/mds.20380. PMID:15719433.
- Raguthu L، Varanese S، Flancbaum L، Tayler E، Di Rocco A (أكتوبر 2009). "Fava beans and Parkinson's disease: useful 'natural supplement' or useless risk?". Eur. J. Neurol. ج. 16 ع. 10: e171. DOI:10.1111/j.1468-1331.2009.02766.x. PMID:19678834.
- Jones، Brad (8 ديسمبر 2016). "Wearable Device Helps Steady Hand of Designer Who Has Parkinson's Disease". digitaltrends.com. مؤرشف من الأصل في 2019-02-17.
- Thomas، Josh (9 ديسمبر 2016). "Cambridge inventor helps Parkinson's disease suffer to write again". cambridge-news.co.uk. Cambridgeshire, England: Cambridge News. مؤرشف من الأصل في 2018-06-16. اطلع عليه بتاريخ 2016-12-15.
- Mann، Tanveer (8 ديسمبر 2016). "Woman with Parkinson's can write again using incredible invention". metro.co.uk. مؤرشف من الأصل في 2019-04-17. اطلع عليه بتاريخ 2016-12-15.
- Lanska DJ (2010). "Chapter 33: the history of movement disorders". Handb Clin Neurol. ج. 95: 501–46. DOI:10.1016/S0072-9752(08)02133-7. PMID:19892136.
- Guridi J، Lozano AM (نوفمبر 1997). "A brief history of pallidotomy". Neurosurgery. ج. 41 ع. 5: 1169–80, discussion 1180–83. DOI:10.1097/00006123-199711000-00029. PMID:9361073.
- Fahn S (2008). "The history of dopamine and levodopa in the treatment of Parkinson's disease". Mov. Disord. 23 Suppl 3: S497–508. DOI:10.1002/mds.22028. PMID:18781671.
- Hornykiewicz O (2002). "L-DOPA: from a biologically inactive amino acid to a successful therapeutic agent". Amino Acids. ج. 23 ع. 1–3: 65–70. DOI:10.1007/s00726-001-0111-9. PMID:12373520.
- Coffey RJ (مارس 2009). "Deep brain stimulation devices: a brief technical history and review". Artif Organs. ج. 33 ع. 3: 208–20. DOI:10.1111/j.1525-1594.2008.00620.x. PMID:18684199.
- Dimond PF (16 أغسطس 2010)، "No New Parkinson Disease Drug Expected Anytime Soon"، GEN news highlights، GEN-Genetic Engineering & Biotechnology News، مؤرشف من الأصل في 2016-03-24، اطلع عليه بتاريخ 2010-10-25
- Obeso JA، Rodriguez-Oroz MC، Goetz CG، وآخرون (مايو 2010). "Missing pieces in the Parkinson's disease puzzle". Nat Med. ج. 16 ع. 6: 653–61. DOI:10.1038/nm.2165. PMID:20495568.
- Langston JW، Ballard P، Tetrud JW، Irwin I (فبراير 1983). "Chronic Parkinsonism in humans due to a product of meperidine-analog synthesis". Science. ج. 219 ع. 4587: 979–80. DOI:10.1126/science.6823561. PMID:6823561.
- Cicchetti F، Drouin-Ouellet J، Gross RE (سبتمبر 2009). "Environmental toxins and Parkinson's disease: what have we learned from pesticide-induced animal models?". Trends Pharmacol. Sci. ج. 30 ع. 9: 475–83. DOI:10.1016/j.tips.2009.06.005. PMID:19729209.
- Harvey BK، Wang Y، Hoffer BJ (2008). "Transgenic rodent models of Parkinson's disease". Acta Neurochir. Suppl. ج. 101: 89–92. DOI:10.1007/978-3-211-78205-7_15. PMC:2613245. PMID:18642640.
- Redmond DE (أكتوبر 2002). "Cellular replacement therapy for Parkinson's disease – where we are today?". The Neuroscientist. ج. 8 ع. 5: 457–88. DOI:10.1177/107385802237703. PMID:12374430.
- "Stem Cell Research Aims to Tackle Parkinson's Disease". مؤرشف من الأصل في 2019-05-22. اطلع عليه بتاريخ 2010-04-16.