أسيتات الكالسيوم
خلات الكالسيوم أو أسيتات الكالسيوم مركب كيميائي له الصيغة C4H6O4Ca، ويكون على شكل بلورات بيضاء تسترطب بسرعة. وهو ملح الكالسيوم لحمض الخل.
| أسيتات الكالسيوم | |
|---|---|
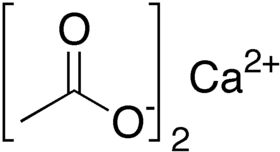 أسيتات الكالسيوم | |
| الاسم النظامي (IUPAC) | |
أسيتات كالسيوم | |
| أسماء أخرى | |
خلات كالسيوم | |
| المعرفات | |
| رقم CAS | 62-54-4 خالي من الماء |
| بوب كيم | 6116 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | C4H6O4Ca |
| الكتلة المولية | 158.138 غ/مول |
| المظهر | بلورات بيضاء |
| الكثافة | 1.6 غ/سم3 |
| نقطة الانصهار | يتفكك |
| الذوبانية في الماء | 40 غ/100 مل ماء ، انحلالية جيدة |
| الذوبانية | ينحل قليلاً في الميثانول غير منحل في الإيثانول والأسيتون |
| المخاطر | |
| ترميز المخاطر |  Xi Xi |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
الخواص
- انحلالية خلات الكالسيوم في الماء جيدة جداً، ينحل بعض الشيء في الميثانول، لكنه لا ينحل في الإيثانول والأسيتون.
- يكون الأس الهيدروجيني لمحلول 3% من خلات الكالسيوم حوالي 7.5.
- يتفكك مركي خلات الكالسيوم بالتسخين فوق 160°س إلى الأسيتون وكربونات الكالسيوم.
- Ca(CH3COO)2 → H3C-CO-CH3 + CaCO3
التحضير
يحضر خلات الكالسيوم من تفاعل الكالسيوم أو هيدروكسيد الكالسيوم مع حمض الخليك :
- CaCO3(s) + 2CH3COOH(aq) → Ca(CH3COO)2(aq) + H2O(l) + CO2(g)
- Ca(OH)2(s) + 2CH3COOH(aq) → Ca(CH3COO)2(aq) + 2H2O(l)
الاستخدامات
المصادر
- Calcium acetate (بالإنجليزية), QID:Q278487
- ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- Taschenbuch chemische Substanzen, Willmes, Verlag Harri Deutsch, ISBN 3-8171-1662-4
- بوابة الكيمياء
- بوابة صيدلة
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.