Yperiet
Yperiet, of mosterdgas, is 'n chemiese wapen, vir die eerste keer gebruik deur die Duitsers in die Eerste Wêreldoorlog.
|
Algemeen | |
|---|---|
| Naam | Yperiet |
| Ander name | mosterdgas |
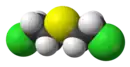 Struktuurformule van |
 |
| Chemiese formule | C4H8Cl2S |
| Molêre massa | 159,08 [g/mol][1] |
| CAS-nommer | 505-60-2[1] |
| Voorkoms | Kleurlose vloeistof; geel tot swart deur onsuiwerhede [1] |
| Reuk | Reukloos tot knoffelrig[1] |
| Fasegedrag | |
| Smeltpunt | 13-14 °C[1] |
| Kookpunt | 216 ° @ 1 Atm [1] |
| Digtheid | 1,274 [1] |
| Oplosbaarheid | sleg; 6,8 [mg/L] @ 25 °C[1] |
|
Suur-basis eienskappe | |
| pKa | |
|
Veiligheid | |
| Flitspunt | 104 °C [1] |
| LD50 | 100 [mg/kg] (mens; vel) |
| LC50 | 100 mg/m3 (rot; 10 minute) |
|
Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |
Swaelmosterd is 'n dik helder amberkleurige olierige vloeistof by omgewingstemperatuur, maar word 'n vaste stof by 13-14 °C. Dit is swaarder as water as 'n vloeistof en swaarder as lug as 'n damp. Dit is nie maklik brandbaar nie. Die dampe is swaarder as lug; hulle is baie giftig en kan deur die vel geabsorbeer word. Die effekte van blootstelling aan die materiaal sluit blindheid in wat vertraag kan optree. Dit kom nie natuurlik in die omgewing voor nie. Dit word dikwels mosterdgas genoem, maar swawelmosterd sal waarskynlik nie dadelik in 'n gas verander as dit by gewone temperature vrygestel word nie. [1]
Yperiet word algemeen beskou as 'n "aanhoudende" chemiese middel vanweë sy lae vlugtigheid. In koel weer is daar min dampe; mosterd se verdamping neem egter toe soos die temperatuur toeneem. By hoër temperature, soos dié in die Midde-Ooste gedurende die warm seisoen (38–49°C), word mosterddamp 'n groot gevaar.[2]
As 'n suiwer vloeistof is dit kleurloos en reukloos, maar wanneer dit met ander chemikalieë gemeng word, lyk dit bruin en het 'n knoffelagtige reuk. Swaelmosterd is in chemiese oorlogvoering gebruik. Dit is tydens die Eerste en Tweede Wêreldoorloë in groot hoeveelhede gemaak. Dit is glo in die Iran-Irak-oorlog in 1980-1988 gebruik. Dit word nie tans in die Verenigde State gebruik nie, behalwe vir navorsingsdoeleindes, en die Amerikaanse departement van verdediging het alle oorblywende voorraad swaelmosterd teen 2004 vernietig.[1]
Chemiese eienskappe
Die molekule kan deur 'n reaksie van eteen met swaeldichloried gevorm word:
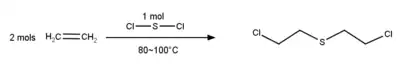
Yperiet of bis(2-chlooretiel)sulfied is 'n etielsulfied waarin een waterstofatoom van elk van die terminale metielgroepe deur 'n chloor vervang is. Dit is 'n kragtige blasiemiddel wat onder die Chemiese Wapenkonvensie gereguleer word. Dit speel 'n rol as 'n alkileringsmiddel, 'n blêrmiddel en 'n kankerverwekkende middel. Dit is 'n organochloorverbinding en 'n organiese disulfied.[1]
Dit los maklik op in vette en petroleumprodukte. Dit los stadig in water op, waar dit vinnig in minder giftige chemikalieë verander. Daarom is drink, kook, bad en swem in mosterdgas-besmette water aktiwiteite wat onwaarskynlik tot noemenswaardige blootstelling sal lei. Die chemikalieë wat in water geproduseer word, kan egter wel vel- of oogirritasie veroorsaak, eerder as die kenmerkende blase.[3]
Swaelmosterd (SM) het twee relatief nie-selektiewe elektrofiele sentrums. Aanvanklike reaksies van SM met water en glutathion, plus die oksidasie van swael, lei tot die vorming van baie metaboliete. Hierdie metaboliete word in urine uitgeskei, waarvan tien in die rot geïdentifiseer is. SM vorm sulfoniumione in die liggaam en alkileer DNA wat lei tot die breek van DNA-kettings en seldood. As gevolg van die sterk elektrofiele eienskap van die sulfoniumioon, bind swaelmosterd aan 'n verskeidenheid sellulêre makromolekules.[4]
Toksiese eienskappe
Dit is 'n sitotoksiese en alkielerende verbinding. Inaseming, die hoofweg van blootstelling, veroorsaak respiratoriese en sistemiese toksisiteit. Die oë is die sensitiefste organe, maar die respiratoriese kanaal is die belangrikste teikenorgaan. Yperiet is lipofiel en versamel in die brein- en vetweefsel.[5]
| Wikimedia Commons bevat media in verband met Sulfur mustard. |
Verwysings
- "Musterd gas (compound)". PubChem NIH.
- Mahdi Balali-Mood, (2015). Chapter 5 - Early and Delayed Effects of Sulfur Mustard in Iranian Veterans After the Iraq–Iran Conflict; in:Handbook of Toxicology of Chemical Warfare Agents (Second Edition),. Academic Press. pp. 37–46. doi:10.1016/B978-0-12-800159-2.00005-1. ISBN 9780128001592.
{{cite book}}: AS1-onderhoud: ekstra leestekens (link) - Harry Salem, Frederick R. Sidell (2005). Blister Agents/Vesicants; in: Encyclopedia of Toxicology (Second Edition). Elsevier. pp. 319–323. doi:10.1016/B0-12-369400-0/10032-8. ISBN 9780123694003.
- D. Thavaselvam, Swaran S. Flora (2014). Chapter 30 - Chemical and biological warfare agents; in: Biomarkers in Toxicology. Academic Press. pp. 521–538. doi:10.1016/B978-0-12-404630-6.00030-0. ISBN 9780124046306.
{{cite book}}: AS1-onderhoud: gebruik authors-parameter (link) - M. Balali-Mood, B. Balali-Mood, M. Moshiri (2014). Sulfur Mustard; in: Encyclopedia of Toxicology (Third Edition). Academic Press. pp. 427–431. doi:10.1016/B978-0-12-386454-3.00632-1. ISBN 9780123864550.
{{cite book}}: AS1-onderhoud: gebruik authors-parameter (link)