Waterstofelektrode
Die waterstofelektrode is 'n spesiale elektrode wat 'n belangrike rol in die elektrochemie speel.
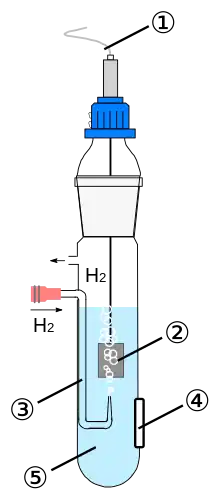
Waterstof is onder die Aarde se omstandighede nie 'n elektriese geleier nie, maar 'n gas. Hierdie gas kan egter adsorbeer op 'n katalitiese elektrode van platinum en dit is die basis vir 'n praktiese gebruik van die halfreaksie:
Hierdie halfreaksie word in die elektrochemie gebruik om die nulpunt van standaardreduksiepotensiale te definieer.[1] Die definisie stel dat
Die standaardwaterstofelektrode (SHE) is gedefinieer as:
- 'n platinumelektrode
- wat in kontak is met waterstofgas van 1013 hPa druk (~1 Atm)
- in 'n oplossing waarin die aktiwiteit van H+=1.
Dit is in die praktyk nie altyd moontlik om dit te bereik nie en daarom word gewoonlik die normaalwaterstofelektrode (NHE) gebruik wat 'n oplossing het met 'n suuroplossing wat se waterstofioonoplossing [H+]=1 [mol/L] is en die waterstofdruk gelyk aan die atmosferiese druk van die laboratorium is. Die potensiaalverskille tussen SHE en NHE is baie klein en daarvoor kan gekorrigeer word.
Die normaalwaterstofelektrode het 'n diafragma wat die elektrode se oplossing elektries met die oplossing van die ander ondersoekte elektrode verbind en daar word gesorg dat suurstof van die lug nie die waterstofelektrode kan bereik nie.
Waterstofelektrodes bly nogtans duur vanweë die platinum en vereis die beskikbaarheid van (brandbare!) waterstofgas. Om hierdie rede word dikwels van ander elektrodes soos die kalomel- of die silwer/silwerchloried-elektrode as referensie gebruik gemaak. Hulle is nie nul nie, maar die waarde is goed bekend en kan maklik afgetrek word.
Verwysings
- "Standard hydrogen electrode". Libre Text.