Water (molekuul)
Hierdie artikel bespreek water vanuit 'n wetenskaplike en tegniese oogpunt. Sien water vir 'n meer algemene bespreking van water en die belangrikheid daarvan vir die mensdom
|
Algemeen | |
|---|---|
| Naam | Water (molekuul) |
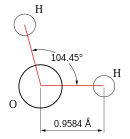 Struktuurformule van |
 |
| Chemiese formule | H2O |
| Molêre massa | 18,01528 |
| CAS-nommer | 7732-18-5 |
| Voorkoms | deurskynend, byna kleurlose vloeistof met'n effense blou tint |
| Fasegedrag | |
| Smeltpunt | 0°C (273.15 K) |
| Kookpunt | 100 °C (373.15 K) |
| Digtheid | 1 g/cm3 |
| Oplosbaarheid | |
| Viskositeit | 1 mPa·s teen 20 °C |
|
Suur-basis eienskappe | |
| pKa | 15.74 |
|
Veiligheid | |
| Flitspunt | |
|
Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |
Water het die chemiese formule H2O, wat beteken dat dit 'n watermolekule uit twee waterstofatome en een suurstofatoom bestaan. By kamertemperatuur, ongeveer 25 °C, is dit 'n bykans kleurlose- (met 'n effense blou tint), smaaklose- en reuklose stof. Dit is die mees algemene oplosmiddel en ook die enigste suiwer stof wat in al drie sy toestande op aarde aangetref word.
Vorms van water
Water kan vele vorms aanneem. Die vastestof staan bekend as ys; die gastoestand staan bekend as waterdamp (of stoom). Water kan egter ook baie ander vorms aanneem soos onder andere glasys, wat 'n nie-kristallyne vastetoestand van water is.
Bo 'n sekere kritieke temperatuur en druk (647 K en 22.064 MPa), neem watermolekules 'n superkritiese toestand aan.
Swaarwater is water waarby die waterstofatome vervang word met die swaarder isotoop, deuterium. Chemies gesproke is dit dieselfde as gewone water. Swaarwater word tipies in die kern-nywerheid gebruik om neutrone te vertraag.
'n Algemene stof
Water in die Heelal
Water is bespeur in die intersterwolke in ons sterrestelsel, die Melkweg. Daar word geglo dat water in oorvloed in ander sterrestelsels ook bestaan omdat sy boustene, waterstof en suurstof onder die oorvloedigste elemente in die heelal tel.
Intersterwolke versamel uiteindelik om sterrenewels en sterrestelsels soos ons s'n te vorm. Hierdie oorspronklike water kan ook in komete, planete en hul natuurlike satelliete gevind word. In ons sonnestelsel is tekens van water dan ook gevind:
Water op Aarde
Die watersiklus verwys na die voortdurene uitruiling van water binne die hidrosfeer, tussen die atmosfeer, oppervlakwater, grondwater en plante.
Daar is ongeveer 1 360 000 000 km³ water op aarde. Hierdie water is rofweg as volg versprei:
- 1,320,000,000 km³ is in die oseane
- 25,000,000 km³ (1.8%) is in gletsers en die pole
- 13,000,000 km³ (0.9%) is grondwater.
- 250,000 km³ (0.02%) is varswater in mere, binnelandse seë, en riviere.
- 13,000 km³ (0.001%) is atmosferiese waterdamp op enige gegewe oomblik.
Vloeistofwater word in verskeie watermassas op aarde gevind soos byvoorbeeld in oseane, seë, mere, riviere, strome, kanale of poele. Die grootste hoeveelheid water op Aarde is seewater. Water is ook teenwoordig in die atmosfeer in beide vloeistof- en dampfases. Dit bestaan ook as grondwater in ondergrondse bronne. Water kook normaalweg teen 100 °C by seevlak maar in diepsee spuite kan superverhitte water teen 400 °C aangetref word terwyl water teen die lae drukke op die berg Everest teen 'n skamele 70 °C sou kook.
Water in nywerhede
Water word ook in vele nywerheidsprosesse en majinerie gebruik soos stoomturbines en hitteruilers, bowen die gebruik daarvan as chemiese oplosmiddel. Die uitlaat van onbehandelde water vanaf nywerhede veroorsaak besoedeling. Besoedeling kan opgeloste stowwe in die water insluit (chemiese besoedeling) of verkoelingswater wat te warm is (termiese besoedeling). Nywerhede vereis suiwer water vir baie toepassings en maak van 'n verskeidenheid suiweringstegnieke gebruik.
Fisika en Chemie van Water
Digtheid van water en ys
By die meeste stowwe is die vastestofvorm van die stof digter as die vloeistofvorm; dus sou 'n blok van daardie stof in daardie vloeistof sink. 'n Blok ys sal egter bo op water dryf aangesien water in sy vastestofvorm minder dig as vloeistofwater is. Dit is maar een van die ongewone eienskappe van water. Teen kamertemperatuur sal water wat afgekoel word soos die meeste ander stowwe al hoe digter word. Maar by 4 °C, net so 'n bietjie bo vriespunt, bereik water egter sy maksimum digtheid en soos dit dan verder verkoel word, word dit minder dig. Die fisiese verklaring hiervoor hou verband met die kristalstruktuur van gewone ys. Water, gallium en bismut is van die min materiale wat uitsit wanneer dit vries; die meeste ander materiale krimp. As water nie die eienskap gehad het nie sou die oseane byna almal gevries.
Hierdie ongewone uitsetting van water soos dit vanaf 4 °C bo sy vriespunt verkoel word bied varswaterdiere ook 'n belangrike voordeel in die wintertyd. Water op die oppervlak wat verkoel word, word digter en begin sink wat konveksiestrome veroorsaak wat die hele watermassa laat afkoel, maar wanneer die temperatuur van 'n dam of mer 4 °C bereik sal die water op die oppervlak wat verder afkoel minder dig word en op die oppervlak bly en uiteindelik ys bo-op vorm. Aangesien die konveksie deur die laer digtheid verhoed word sal enige groot watermassa se temperatuur op sy koudste by die oppervlak wees, terwyl die bodem teen die uiterste koue beskerm word.
Digtheid van soutwater en ys
Die situasie is ietwat anders in die geval van soutwater. Ys dryf steeds bo-op en verhoed dat die oseane vries, maar die soutinhoud van die oseane verlaag die vriespunt van water met ongeveer 2 °C en verlaag ook die temperatuur waarteen die maksimum digtheid van water voorkom na baie nader aan die vriespunt. Dus sal die afwaartse konveksiestrome van koue water nie verhoed word in soutwater nie en sal die koue water aanhou om al dieper te sink.
Wanneer die oppervlak van seewater begin om te vries (teen -1.9 °C vir seewater van normale soutgehalte) is die ys wat gevorm word bykans soutloos met 'n digtheid naby aan die van varswaterys. Hierdie ys dryf op die oppervlak en die sout wat sodoende uitgevries is, verhoog dus die oorblywende water se soutgehalte. Die hoër soutgehalte het dan tot gevolg dat die oorblywende water na die bodem sink, met die gevolg dat die diepwater in oseane ook 'n temperatuur van &1.9deg;C behoort te hê.
Drievoudpunt
Die temperatuur en druk waarteen 'n vastestof-, vloeistof- en gasvormige water saam in ewewig bestaan word die drievoudpunt van water genoem. Hierdie punt word gebruik om die eenhede van temperatuur (die kelvin en indirek daardeur die graad Celsius). Die trippelpunt kom voor by 'n temperatur van 273.16K (0.01 °C) volgens ooreenkoms en teen 'n druk van 611.2 Pa. Hierdie is 'n baie lae druk, ongeveer 150 keer laer as die barometriese druk by seevlak van 101 300 Pa.
Die Mpemba verskynsel
Die Mpemba verskynsel is die verrassende verskynsel waar warm water onder sekere omstandighede vinniger as koue water kan vries ten spyte daarvan dat dit eers na die laer temperature verkoel moet word om te kan vries. Hierdie verskynsel kan egter deeglik verklaar word aan die hand van verdamping, konveksie, superverkoeling en die isolerende werking van ryp.
Oppervlakspanning
Waterdruppels is stabiel danksy die hoë oppervlakspanning van water. Dit kan gesien word wanneer klein hoeveelhede water op 'n onoplosbare oppervlak geplaas word soos glas: Die water bly in druppels saamgebind. Hierdie is 'n belangrike eienskap vir lewensvorme. Water word byvoorbeeld deur die xileem in die stamme van plante na bo vervoer word maak sterk staat op die sterk intermolekulêre kragte tussen watermolekules.
Elektriese eienskappe
Suiwer water is eintlik 'n goeie isoleerder (swak geleier). Omdat water egter so 'n goeie oplosmiddel is, kom dit byna altyd saam met opgeloste stowwe daarin voor, dikwels in die vorm van 'n sout. Water met selfs 'n klein hoeveelheid onsuiwerhede is 'n baie beter geleier van elektriesiteit omdat die sout ontbind na vrye ione in waterige oplossings wat dien as draers vir die elektriese stroom.
Water kan ontbind word na die bousteen-elemente, waterstof en suurstof, deur 'n stroom daardeur te laat vloei. Die proses staan bekend as elektrolise. Watermolekules ontbind natuurlik in H+ en OH- ione, wat na die katode en anode respektiewelik aangetrek word. By die katode neem twee H+ ione elektrone op om H2 gas te vorm. By die anode gee vier OH- ione, vier elektrone af en vorm sodoende 'n molekule O2 gas en twee molekules water. Die gasse borrel na die oppervlak waar hulle dan versamel kan word. Dit is bekend dat die teoretiese maksimum elektriese weerstand van water ongeveer 182 kilo-ohm-meter (of 18.2 MΩ·cm) teen 25 grade Celsius. Hierdie syfer kom goed ooreen met wat tipies waargeneem word by tru-osmose, ultafiltreerde en dionisasie-gesuiwerde ultrasuiwer water wat tipies in halfgeleier aanlegte teëgekom word. 'n Sout of suurbesoedelingsvlak wat selfs net 100 dele per triljoen (dpt) in ultrasuiwer water sal 'n noemenswaardige impak op die elektriese weerstand van water hê.
Dipolêre aard van water
'n Belangrike eienskap van water is sy polêre aard. Die watermolekule vorm 'n hoek, met waterstofatome aan die punte en suurstof by die hoekpunt. Aangesien suurstof 'n hoër elektronegatiwiteit as waterstof het, sal die kant van die molekule waar die suurstofatoom geleë is 'n effense negatiewe lading hê. 'n Molekule met so 'n ladingsverskil word 'n dipool genoem. Die ladingsverskille veroorsaak dat watermolekule s na mekaar aangetrek word (die relatief positiewe kante na die relatief negatiewe kante toe) en na ander molekules. Hierdie aantrekkingskrag word waterstofbinding genoem en verklaar baie van water se fisiese eienskappe.
Al is die aantrekkingskrag van die waterstofbindings relatief tot die kovalente verbindings binne-in die watermolekule swak is dit tog verantwoordelik vir baie van water se fisiese eienskappe. Een van die eienskappe is sy relatief hoë smelt- en kookpunte; meer warmte-energie word vereis om die waterstofbindings tussen die molekules te verbreek. 'n Verbinding met soortgelyke struktuur soos waterstofsulfied (H2S), wat 'n baie swakker waterstofbinding het, is 'n gas by kamertemperatuur al het dit dubbel die molekulêre massa van water. Die ekstra verbinding tussen watermolekules gee aan watervloeistof 'n groot soortlike warmtekapasiteit wat dit dan 'n goeie medium maak vir die stoor van warmte-energie. Waterstofbinding gee aan water ook sy ongewone gedrag wanneer dit vries. Wanneer dit tot naby sy vriespunt afgekoel word veroorsaak dit dat die molekules herrangskik om die energie te minimiseer en vorm sodoende die heksagonale kristalstruktuur van ys wat 'n laer digtheid het: en daarom dryf die vastestofvorm op water.
'n Belangwekkende gevolg van die feit dat die vastestof 'n laer digtheid het as die vloeistof is dat ys sal smelt as 'n voldoende hoë druk daarop uitgeoefen sou word. Met toenemende druk sal die smeltpunt afneem totdat die temperatuur van die omgewing bereik is, waar die ys dan sal smelt. Die druk moet egter noemenswaardig wees om die smeltpunt betekenisvol te verlaag – die druk wat deur 'n ysskaatser uitgeoefen word verminder die smeltpunt met ongeveer 0.09 °C.
Water as 'n oplosmiddel
Water is 'n baie goeie oplosmiddel vanweë sy polariteit. Wanneer 'n ioniese of polêre verbinding in kontak met water kom kan die relatief klein watermolekules die stof wat opgelos word heeltemal omring. Die deels negatiewe dipoolgedeelte van die water word na die positief gelaaide komponente van die stof wat opgelos word aangetrek en teenoorgestelde vir die positiewe dipoolgedeeltes.
Oor die algemeen is ioniese en polêre stowwe soos sure, alkohole en soute geredelik oplosbaar in water en nie-polêre stowwe soos vette en olies nie. Nie-polêre molekules bly bymekaar in water aangesien die waterstofbindings tussen die watermolekules sterker is as die van der Waalskragte tussen Watermolekule s en die nie-polêre molekules.
'n Voorbeeld van ioniese oplosbare stowwe is tafelsout; die natriumchloried, NaCl, ontbind na Na+ katione en Cl- anione waarna beide spesies deur water omring word. Die ione word maklik vanaf hul oorspronklike kristalraamwerk weggevoer na die oplossing toe. 'n Voorbeeld van 'n nie-ioniese oplosbare stof is gewone suiker. Die waterdipole vorm waterstofbindings met die polêre dele van die suikermolekule (OH groepe) en laat toe dat dit in die oplossing in weggevoer word.
Die oplosmiddel-eienskappe van water is van uiterste belang in biologie, aangesien baie biochemiese reaksies in waterige oplossings plaasvind (bv, reaksies in die selplasma en bloed).
Die waterewewig
Chemies gesproke is water amfoteries – d.w.s. dit kan as 'n suur of 'n basis optree. By 'n pH van 7 (neutraal) is die konsentrasie hidroksiedione (OH-) gelyk aan die konsentrasie van die hidronium- (H3O+) of waterstofione (H+).
Die ewewigskonstante by kamertemperatuur. In suiwer water is daarom
As die ewewig versteur word kan die oplossing suur word (meer hidronium-ione) of basies word (meer hidroksied-ione).
Water kan of as suur of basis aan reaksies deelneem. Volgens die Brønsted-Lowrystelsel, word 'n suur gedefinieer as 'n spesie wat 'n proton ('n H+ ioon) in 'n reaksie skenk en 'n basis as een wat 'n proton ontvang. Wanneer dit met 'n sterker suur reageer, tree water as 'n basis op; wanneer dit met 'n swakker suur reageer tree dit as 'n suur op. Water ontvang byvoorbeeld 'n H+ ioon in die HCl ewewig:
Hier tree water as 'n basis op deurdat dit 'n H+ ioon ontvang. Omdat HCl 'n sterk suur is val amper alle HCl in ione uitmekaar.
'n Suur skenk 'n H+ ioon en water kan dit ook doen, soos in die reaksie met ammoniak, NH3:
In hierdie geval is die reaksie 'n ewewig. Nie alle ammoniak sal reageer nie, omdat ammonia (die ammoniakoplossing) 'n swak basis is.
Suurgehalte in die natuur
Teoreties behoort suiwer water 'n pH van 7 te hê. In die praktyk is dit egter uiters moeilik om suiwer water te maak. Water wat aan lug blootgestel word vir 'n gegewe tyd sal baie vinnig koolstofdioksied absorbeer en koolsuur vorm, wat 'n pH van so laag as ongeveer 5.7 kan hê. Met die vorming van wolkdruppels in die atmosfeer en met die val van die reëndruppels deur die lug word klein hoeveelhede CO2 geabsorbeer en daarom is reën meestal effe suur. As groot hoeveelhede stikstof- en swaeloksiede in die lug teenwoordig is, sal dit ook oplos en ernstiger suurreën probleme tot gevolg hê.
Waterstofbinding in water
Watermolekule s kan 'n maksimum van vier waterstofbindings vorm omdat dit twee waterstofatome kan aanvaar en twee kan skenk. Ander molekules soos fluorsuur, ammoniak, metanol vorm waterstofbindings maar toon nie die afwykende termodinamiese, kinetiese of strukturele eienskappe van water nie. Die verklaring vir hierdie skynbare verskil tussen water en ander vloeistowwe wat waterstofbindings vorm is dat buiten water nie een van die ander molekules vier waterstofbindings kan vorm nie hetsy dit is as gevolg van die onvermoë om waterstowwe te kan skenk/aanvaar of vanweë steriese effekte.
Sien ook
- Swaarwater
- Die Mpemba verskynsel
Eksterne skakels
| Wikimedia Commons bevat media in verband met Water (molekuul). |
- Engelstalige werf oor Water se struktuur en gedrag
- 'n Humoristiese opstel in Engels oor die "gevare" van diwaterstofmonoksied
- Stockholm Internasionale Waterinstituut (SIWI)
- 'n Werf waar die afwykende eienskappe van water verklaar word
- 'n Berekeningschemie Wiki (Engels) Geargiveer 27 September 2007 op Wayback Machine