Trinitrotolueen
2,4,6-Trinitrotolueen is 'n organiese chemiese verbinding met die formule C6H2(NO2)3CH3. Hierdie geel vaste stof word soms gebruik as reagens in chemiese sintese, maar dit is veral bekend as 'n plofbare materiaal wat maklik hanteerbaar is. Die plofbare opbrengs van TNT word beskou as die standaard vergelykende konvensie vir die vernietigende krag van bomme en plofstof.




|
Algemeen | |
|---|---|
| Naam | Trinitrotolueen |
| IUSTC-naam | 2,4,6-Trinitrotolueen |
| Ander name | 2,4,6-Trinitrometielbenseen 2,4,6-Trinitrotoluol 2-Metiel-1,3,5-trinitrobenseen TNT, Toliet, Triliet, Trinitrotoluol, Trinol, Tritolo, Tritolol, Triton, Tritoon, Trotol, Trotiel |
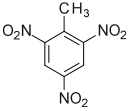 Struktuurformule van Trinitrotolueen |
 |
| Chemiese formule | C7H5N3O6 |
| Molêre massa | 229,10 g•mol-1 |
| CAS-nommer | 118-96-7 |
| Voorkoms | liggeel vastestof |
| Fasegedrag | |
| Smeltpunt | 80,35 °C |
| Kookpunt | 240 °C (ontbind) |
| Digtheid | 1,654 g•cm-3 |
| Oplosbaarheid | 0,13 g•L-1 (teen 20 °C) |
|
Suur-basis eienskappe | |
| pKa | |
|
Veiligheid | |
| Flitspunt | |
|
Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |
Gebruike
TNT is een van die mees gebruikte plofstof vir militêre, industriële en mynbou-toepassings. Dit word deels verkies vanweë die ongevoeligheid vir skok en wrywing, met 'n verminderde risiko vir toevallige ontploffing in vergelyking met meer sensitiewe plofstowwe soos nitrogliserien. TNT smelt teen 80 ° C wat ver onder die temperatuur waarteen dit spontaan sal ontplof is. Daarom kan dit gegiet of veilig met ander plofstowwe gekombineer word. TNT absorbeer nie water nie en los ook nie in water op nie, wat dit moontlik maak om dit effektief in nat omgewings (of onder water) te gebruik. Om te ontplof, moet TNT geatikveer word deur 'n drukgolf wat van 'n aansitterplofstof af kom. Alhoewel blokke TNT in verskillende groottes beskikbaar is, kom dit meer voor in mengsels wat 'n veranderlike persentasie TNT plus ander bestanddele bevat.[1][2][3]
Ontploffingsreaksie
TNT ondergaan 'n ontbindingsreaksie:
- 2 C7H5N3O6 → 3 N2 + 5 H2 + 12 CO + 2 C
en twee verdere reaksies kom ook voor:
- H2 + CO → H2O + C
- 2 CO → CO2 + C.
Die hoof reaksie is eksotermies en het 'n matige aktiveringsenergie van ongeveer 146kJ/mol. Aangesien die reaksies baie koolstof lewer kan mengsels van TNT met suurstofryke verbindings meer energie oplewer as suiwer TNT alleen.[4]
Energie-inhoud
Die energiedigtheid van TNT word gebruik as verwysingspunt vir baie ander plofstowwe, insluitend kernwapens, waarvan die energie-inhoud gemeet word in ekwivalente kiloton (4,184 TJ of 1,162 GWh) of megaton (4,184 PJ of 1,162 TWh) TNT.[5]
Ter vergelyking bevat kruit 3 MJ/kg, dinamiet 7,5 MJ/kg en petrol 47,2 MJ/kg. Petrol benodig 'n oksidant, dus 'n geoptimaliseerde petrol- en O2-mengsel bevat net 10,4 MJ/kg.
Voorbereiding
In die industrie word TNT vervaardig in 'n drie-stap proses. Eerstens word tolueen met 'n mengsel van swael- en salpetersuur genitreer om mononitrotolueen (MNT) te produseer. Die MNT word geskei en dan tot dinitrotolueen (DNT) genitreer. In die laaste stap word die DNT na trinitrotolueen (TNT) genitreer met behulp van 'n watervrye mengsel van salpetersuur en oleum.[Nota 2] Salpetersuur word deur die vervaardigingsproses verbruik, maar die verdunde swaelsuur kan weer gekonsentreer en hergebruik word. Na nitrasie word TNT gestabiliseer deur 'n proses genaamd sulfitasie, waar die ru TNT behandel word met waterige natriumsulfietoplossing om minder stabiele isomere van TNT en ander ongewenste reaksieprodukte te verwyder. Die spoelwater van sulfitasie staan bekend as rooiwater en is 'n belangrike besoedelings- en afvalproduk van TNT-vervaardiging.[6]
Veiligheid en toksisiteit
TNT is giftig, en velkontak kan velirritasie veroorsaak, wat veroorsaak dat die vel 'n helder geel-oranje kleur kry. Tydens die Eerste Wêreldoorlog het vroulike ammunisiewerkers wat die chemikalie gehanteer het gevind dat hul vel heldergeel word, wat daartoe gelei het dat hulle die bynaam "kanarie-meisies" of bloot "kanaries" verkry het.[7]
Mense wat oor 'n lang tydperk aan TNT blootgestel is, is geneig om bloedarmoede en abnormale lewerfunksies te ervaar. Bloed- en lewereffekte, vergroting van milt en ander skadelike effekte op die immuunstelsel is ook gevind by diere wat trinitrotolueen ingeneem of asemhaal. Daar is bewyse dat TNT manlike vrugbaarheid nadelig beïnvloed.[8] TNT word gelys as 'n moontlike menslike karsinogeen.[9] Inname van TNT produseer rooi urine deur die teenwoordigheid van afbreekprodukte en nie bloed soos soms geglo nie.[10]
Geskiedenis
TNT is die eerste keer in 1863 deur die Duitse chemikus Julius Wilbrand voorberei en oorspronklik as 'n geel kleurstof gebruik.[11] Die potensiaal daarvan as 'n plofstof is vir drie dekades nie erken nie, veral omdat dit te moeilik was om te ontplof en omdat dit minder kragtig was as alternatiewe. Die plofbare eienskappe daarvan is die eerste keer in 1891 deur 'n ander Duitse chemikus, Carl Häussermann, ontdek.[12] TNT kan veilig gegiet word wanneer dit vloeibaar is, en is so ongevoelig dat dit vrygestel is van die wet op plofstof van die Verenigde Koninkryk van 1875 en nie as 'n plofstof beskou was vir die vervaardiging en opberging daarvan nie.[13]
In 1902 het die Duitse weermag dit as vulmiddel vir artillerieprojektiele aanvaar. TNT-gevulde pantser-deurdringende projektiele sou ontplof nadat hulle die Britse pantser binnegedring het, terwyl die Britse Lyddiet-gevulde projektiele geneig was om te ontplof op impak en het dus baie van hul energie buite die skip uitgegee.[13]
Die Amerikaanse vloot het voortgegaan om pantser-deurdringende projektiele met Dunniet[Nota 3] te vul nadat sommige ander lande na TNT oorgeskakel het, maar het begin om vlootmyne, bomme en diepteladings te vul met ru-"graad-B" TNT, met die kleur van bruinsuiker. Die ladings het 'n plofbare versterkerlading van korrelgekristalliseerde "graad-A" TNT vir ontploffing vereis. Hoë-plofbare projektiele is gevul met "graad-A" TNT, wat begin voorkeur geniet het vir ander gebruike, aangesien industriële chemiese kapasiteit beskikbaar geword het vir die verwydering van xileen en soortgelyke koolwaterstowwe uit die tolueen-grondstof en ander nitrotolueen-isomeerbyprodukte van die nitreringsreaksies.[14]
Kyk ook
Aantekeninge
- RDX is 'n plofbare organiese verbinding wat deel uitmaak van die groep verbindings wat nitramiede genoem word. Bekende plofstowwe C-4 en Semtex bevat albei RDX.
- Oleum is 'n mengsel van swaeltrioksied en swaelsuur. Dit word ook rokende swaelsuur genoem.
- Dunniet is ammoniumpikraat.
Verwysings
- "Explosives - Compounds". www.globalsecurity.org (in Engels).
- Campbell, J (1985). Naval weapons of World War Two (in Engels). London: Conway Maritime Press. p. 100. ISBN 978-0-85177-329-2.
- Cooper, PW (1996). Explosives Engineering (in Engels). Wiley-VCH. ISBN 978-0-471-18636-6.
- Furman, David; Kosloff, Ronnie; Dubnikova, Faina; Zybin, Sergey V.; Goddard, William A.; Rom, Naomi; Hirshberg, Barak; Zeiri, Yehuda (6 Maart 2014). "Decomposition of Condensed Phase Energetic Materials: Interplay between Uni- and Bimolecular Mechanisms". Journal of the American Chemical Society (in Engels). American Chemical Society. 136 (11): 4192–4200. doi:10.1021/ja410020f. ISSN 0002-7863.
- Babrauskas, Vytenis (2003). Ignition Handbook (in Engels). Issaquah, WA: Fire Science Publishers/Society of Fire Protection Engineers. p. 453. ISBN 978-0-9728111-3-2.
- Urbanski, T (1964). Chemistry and Technology of Explosives (in Engels). Vol. 1. Pergamon Press. pp. 389–91. ISBN 978-0-08-010238-2.
- "The Canary Girls: The workers the war turned yellow". BBC News (in Engels). 20 Mei 2017.
- "Toxicological Profile for 2,4,6-Trinitrotoluene" (PDF) (in Engels). atsdr.cdc.gov.
- "2,4,6-Trinitrotoluene". www.nlm.nih.gov (in Engels).
- "2,4,6-Trinitrotoluene" (PDF) (in Engels). atsdr.cdc.gov.
- Wilbrand, J. (1863). "Notiz über Trinitrotoluol". Annalen der Chemie und Pharmacie (in Duits). 128 (2): 178–179. doi:10.1002/jlac.18631280206.
- Krehl, Peter O. K. (2008). History of Shock Waves, Explosions and Impact: A Chronological and Biographical Reference (in Engels). Springer Science & Business Media. p. 404. ISBN 978-3-540-30421-0.
- GI, Brown (1998). The Big Bang: a History of Explosives (in Engels). Sutton Publishing. pp. 151–153. ISBN 978-0-7509-1878-7.
- Fairfield, Arthur P. (1921). Naval Ordnance (in Engels). Lord Baltimore Press. pp. 49–52.