Sellulose
Sellulose is 'n polisakkaried, 'n polimeer van glukose.
|
Algemeen | |
|---|---|
| Naam | Sellulose |
Struktuurformule van |
 |
| Chemiese formule | (C6O5H10)n |
| Molêre massa | 50 000 -3 000 000 [g/mol] |
| CAS-nommer | 9004-34-6 |
| Voorkoms | Wit vastestof |
| Reuk | geen |
| Fasegedrag | |
| Smeltpunt | 500-518 °C [1] |
| Kookpunt | (ontbind)[1] |
| Digtheid | 1,27-1,61 (*water)[1] |
| Oplosbaarheid | Onop. in water. oplosbaar in ZnCl2.3H2O[1] |
| Termodinamies | |
|
Suur-basis eienskappe | |
| pKa | |
|
Veiligheid | |
| Flitspunt | |
|
Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |
Hierdie koolhidraat is volop in plante, want dit kom voor in 'n plant se selwand. Die Franse chemikus Anselme Payen (1795–1871) was die eerste navorser wat dit in 1834 uit selwande van plante geïsoleer het. Hierdie polimeer vorm lang vesels wat aan die selwande hul stewigheid verleen.[2]
Sellulose en stysel
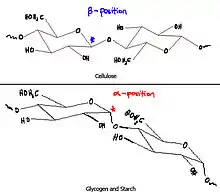
Sellulose en stysel is altwee polisakkariede maar daar is 'n belangrike strukturele verskil. Die skakel tussen die een glukosemonomeer en die volgende een is in 'n beta-posisie vir sellulose en in 'n alfa-posisie vir stysel. Dit verander die eienskappe grootliks. Die beta-skakel maak sellulose in teenstelling tot stysel vir die meeste organismes onverteerbaar. Daar is nogtans bepaalde mikrobes wat dit wel kan verteer. Termiete het 'n mikrobefauna in hul derms. Hierdie simbiotiese fauna bevat bakterieë, protosoë soos Trichonympha agilis, Personympha sp. asook archaea wat saam sellulose in vetsure kan omsit. Hierdeur vermag die termiete dit om hout te vreet.[3]
Oplosbaarheid
Die sellulosemolekuul is ook meer 'n lineêre molekuul. Verder is daar deur die teenwoordigheid van die ketting se hidroksielgroepe talle waterstofbindings tussen buurmolekule moontlik wat hierdie molekule in vesels saampak. Dit verklaar sy stewigheid. Sellulose los nie in water op nie, maar vloeibare sinkchloriedhidrate ZnCl2.nH2O (n~3) kan dit oplos.[4] Die trihidraat is 'n vloeibare ioniese verbinding wat bestaan uit heksa-akwosink (Zn2+(H2O)6)- en tetrachlorosinkaat (ZnCl2−4)-ione. Die heksa-akowsink-ione kan waterstofbindings met die kettings se hidroksielgroepe vorm. 'n Ander oplosmiddel is koolstofdisulfied.
Kettinglengte
Die polimerisasiegraad (PG; aantal glukosemonomere in 'n ketting wat sy lengte bepaal) kan taamlik van bron tot bron verskil:[5]
| bron | PG | massa [g/mol] |
|---|---|---|
| Katoen (onoopgemaak) | 15 300 | 2 754 000 |
| Populus tremula/tremuloides (hardehout) | 10 300 | 1 854 000 |
| Pinus banksiana (sagtehout) | 7 900 | 1 422 000 |
| Bakterie | 5 000 | 900 000 |
| Sulfietpulp, gebleek | 1 255 | 225 900 |
| Kraft pulp | 975 | 175 500 |
| Rayon | 305 | 54 900 |
Kristalliniteit
Sellulose is 'n semikristallyne polimeer, wat party kristalstrukture het: sellulose I, II, III en IV. Van die strukture is die I-vorm die bekendste. Sellulose met 'n hoë molêre massa kristalliseer gewoonlik in 'n mengsel van twee strukture, die trikliene Iα en die monokliene Iβ-struktuur. In die hoër plante oorheers die beta-struktuur. Die kristalliete is in die breedte gewoonlik baie klein: ongeveer 5 nm en wissel af met amorfe gebiedjies. Die kristalliniteit kan met X-straalkristallografie, NMR, FTIR or Raman-spektroskopie bepaal word, maar hierdie waardes is nie altyd dieselfde nie. [6]
Bronne
Hout
Hout is 'n belangrike bron van sellulose, maar dit bevat ook party ander stowwe:[7]
- Makromolekulêre stowwe
- Sellulose
- Hemiselluloses of polioses
- Lignien
- Verbindings met 'n lae molekulêre massa
- Organiese verbindings wat geëkstraheer kan word
- Anorganiese verbindings wat by verbranding houtas vorm
Polioses is ook polisakkariede, maar hulle bevat ander heksoses en pentoses soos mannose, glaktose, xilose en arabinose. Lignien is nie 'n polisakkaried nie. Dit is 'n polimeer wat uit aromatiese monomere soos fenielpropaan is opgebou.
Katoen
Een van die suiwerste bronne van sellulose is katoen, wat se vesel amper 90% sellulose bevat. [8]
Vlas
Die vesels van die vlasstingel wat sedert die vroegste eeue tot linne verwerk is, bestaan ook 78% uit sellulose. Daarnaas bevat dit 4,7% hemisellulose, 0,4% lignien, die res is klein molekule soos lipiede of anorganiese stowwe. [9]
Bakterieë
Van die bakterieë soos Acetobacter xylinum kan sellulose vervaardig. [8]
Selluloseprodukte
Viskose-rayon
Cross en Bevan patenteer in 1892 'n proses wat vermag sellulose vloeibaar te maak. Hulle bewerk sellulose eers met loog, gebruik koolstofdisulfied as oplosmiddel en verkry ná 'n rypingsproses'n stroperige oplossing wat xantaat genoem word. Hierdie stroop kan deur klein gaatjies gespers word. Hulle vervaardig hiermee 'n filament wat tot vesels en drade verwerk kan word wat as rayon of kunssy bekend is. Ongelukkig lei die grootskaalse gebruik van CS2 tot groot gesondheidsprobleme onder die werkers in die kunssynywerheid, omrede dit giftig is.[11]
Verwysings
- Science Lab MSDS.
- "Science clarified" (in Engels). Geargiveer vanaf die oorspronklike op 6 Mei 2020.
- Kenneth Noll U. Connecticut.
- Ionic Liquid Character of Zinc Chloride Hydrates Define Solvent Characteristics that Afford the Solubility of Cellulose Sanghamitra Sen, Bradley P. Losey, Elijah E. Gordon, Dimitris S. Argyropoulos, James D. Martin J. Phys. Chem. B, 2016, 120 (6), pp 1134–1141.
- Wood chemistry Washington.edu.
- Cellulose crystallinity index: measurement techniques and their impact on interpreting cellulase performance Sunkyu Park, John O Baker, Michael E Himmel, Philip A Parilla en David K Johnson Biotechnol Biofuels. 2010; 3: 10..
- Wood: chemistry, ultrastructure, reactions Dietrich Fengel, Gerd Wegener, Walter de Gruyter, 1983, ISBN 3-11-083965-2, ISBN 978-3-11-083965-4 bls. 26
- "MyOrganic Chemistry" (in Engels). Geargiveer vanaf die oorspronklike op 8 Junie 2018. Besoek op 3 Maart 2017.
- Cellulose Fibers: Bio- and Nano-Polymer Composites: Green Chemistry and Technology, Susheel Kalia, B. S. Kaith, Inderjeet Kaur, Springer Science & Business Media, 2011, ISBN 3642173705, ISBN 9783642173707, bls. 84
- Uber Kapok-Cellulose F. Zapf 1953.
- Fake Silk: The Lethal History of Viscose Rayon, Paul David Blanc, Yale University Press, 2016, ISBN 0-300-22488-5, ISBN 978-0-300-22488-7