Kaliumkarbonaat
Kaliumkarbonaat is 'n verbinding van kalium met formule K2CO3. Dit is 'n sout van kaliumhidroksied (KOH) en koolsuur (H2CO3).
|
Algemeen | |
|---|---|
| Naam | Kaliumkarbonaat |
| Sistematiese naam | Kaliumkarbonaat |
 Struktuurformule van |
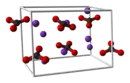 |
| Chemiese formule | K2CO3 |
| Molêre massa | 138,21 [g/mol][1] |
| CAS-nommer | 584-08-7[1] |
| Voorkoms | Wit vastestof |
| Fasegedrag | |
| Selkonstantes | a=564 pm; b=980; c=688; β=98,8° [2] |
| Ruimtegroep | P2₁/c |
| Nommer | 14 |
| Smeltpunt | 891 °C[1] |
| Kookpunt | (ontbind) °C[1] |
| Digtheid | 2,428 [g/cm3] [1] |
| Oplosbaarheid | oplosbaar in water[1] 138 [g/L] water @293K[1] |
|
Suur-basis eienskappe | |
| pKa | |
|
Veiligheid | |
| Flitspunt | onbrandbaar |
| LD50 | >2.000 [mg/kg][1] |
|
Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |
Die stof word ook potas genoem, omdat dit vroeër veral uit die as van plante (dikwels houtas) verkry is.
Eienskappe
Kaliumkarbonaat is sterk higroskopies en aan lug blootgestel vervloei dit. Dit is maklik oplosbaar in water en vorm 'n sterk basiese oplossing wat 'n bytende smaak veroorsaak. Die stof neem ook koolstofdioksiedgas op en vorm daarmee kaliumwaterstofkarbonaat KHCO3 (kaliumbikarbonaat). Hierdie stof kan by verhitting weer kaliumkarbonaat lewer:[3]
In die natuur word dit gevorm deur verwering van minerale soos veldspaat:[4]
Die kieselsuur word saam met die kaliumkarbonaat deur die reën weggespoel en wat agterbly is kaoliniet Al2Si2O7.2H2O.
Die bikarbonaat van kalium KHCO3 is minder oplosbaar as die karbonaat K2CO3, maar vir litium is die omgekeerde die geval. Kaliumkarbonaat kom voor in litiumhoudende pekel soos dit in Tibet in die Zabuye en Dogai Coring-mere aangetref word. Deur die pekel aan CO2-gas onder hoë druk bloot te stel kan die kaliumbikarbonaat selektief neergeslaan word. Dit is 'n belangrike stap vir die litiummynbou. 'n Komplikasie is dat ander fases kan optree soos die seskwihidraat K2CO3.1,5H2O en 'n karbonaat-bikarbonaatdubbelsout: K2CO3.2KHCO3.1,5H2O.[5]
Aanwending
Kaliumkarbonaat word gebruik as 'n komponent van diepeutektiese oplosmiddels soos 'n mengsel van kaliumkarbonaat met gliserol.[6] Dit word gebruik in die drinkwatervoorsiening om die hardheid van water te versag, in die bewerking van kakao tot sjokolade, en vir kontrole van die suurgraad in wyne en vrugtesappe.[7]
Verwysings
- "safety data sheet". Besoek op 5 Augustus 2023.
- B.M. Gatehouse; D.J. Lloyd (1973). "Crystal structure of anhydrous potassium carbonate". Journal of the Chemical Society, Dalton Transactions.
{{cite web}}: AS1-onderhoud: gebruik authors-parameter (link) - Roscoe; J.D. van der Plaats (1903). Roscoe's beknopt leerboek der scheikunde. Van Broekhoven.
{{cite book}}: AS1-onderhoud: gebruik authors-parameter (link) - Roscoe; J.D. van der Plaats (1903). Roscoe's beknopt leerboek der scheikunde. Van Broekhoven.
{{cite book}}: AS1-onderhoud: gebruik authors-parameter (link) - Xue, Yuli, Zhang, Yan, Tan, Xiaoling, Li, Wenqing, Li, Zhongshu, Xu, Shaonan, Zhang, Peng, Wang, Jian, Zhang, Peiping and Miao, Shiding. (2021). ""Separation of K2CO3 from Li+ Brine with Aid of CO2 and Trace of Metastable Quaternary System Li+–K+–CO32−–HCO3−–H2O"". Zeitschrift für Physikalische Chemie. 235 (4): 451–466. doi:10.1515/zpch-2019-1550.
{{cite journal}}: AS1-onderhoud: gebruik authors-parameter (link) - J. Naser, F. Mjalli, B. Jibril, S. Al-Hatmi, and Z. Gano (2013). "Potassium Carbonate as a Salt for Deep Eutectic Solvents". International Journal of Chemical Engineering and Applications. 4 (3).
{{cite journal}}: AS1-onderhoud: gebruik authors-parameter (link) - "Potassium Carbonate". ATP group.